王琳 魏启舜 周影 张培 郭成宝
摘要:羽毛质量约占鸡总质量的5%~7%,已成为家禽屠宰的主要废弃物。羽毛中90%以上的成分为角蛋白,可作为多肽、氨基酸类有机肥来源。利用传统理化方法降解羽毛能耗大,且可造成氨基酸结构破坏。相比之下,利用角蛋白降解细菌降解羽毛高效节能、反应条件温和,具有广阔的市场前景。本文着重介绍角蛋白降解细菌种类、产酶特点以及角蛋白降解机制,角蛋白降解产物及降解细菌对植物具有抗病促生作用,废弃羽毛的生物降解及肥料化利用可促进有机农业发展、改善农业生态系统和提高土壤生物活性。
关键词:生物肥料;羽毛角蛋白;角蛋白降解菌;有机肥料
中图分类号:X172;X713?文献标志码:A?文章编号:1002-1302(2020)21-0040-06
我國目前已成为世界上第二大家禽生产国,2018年我国家禽出栏量达到130亿只,根据推算产生的干羽毛量约为130万t,其中江苏省家禽出栏量达6.420 1亿只,产生的干羽毛量约为6.4万t,为避免禽流感等病害危害人们健康,全国已基本实现家禽的集中屠宰,屠宰产生的以羽毛为主的角蛋白类废弃物产量越来越大,目前只有少量优质的羽毛被服装、工艺品等行业利用,或者经理化方法处理后添加到饲料中,大多数羽毛均被废弃,而角蛋白在自然环境下降解缓慢,有时甚至造成局部的环境污染。角蛋白被认为是一种除了纤维素和几丁质外第三大蕴藏丰富高分子化合物的资源[1]。羽毛角蛋白含量达到90%左右,还包含钾、钙、镁、铁、锌、铜等矿物质,是很好的蛋白质与氨基酸来源。
角蛋白有多种存在形式,包括蹄甲、鱼鳞、角、动物皮毛等,由于角蛋白结构中含有较多的二硫键且高度交联,结构非常稳定,不易在环境中降解,成为固体废物管理的一部分。传统的角蛋白处理工艺包括高温、高压和酸碱水解等,这不仅能耗大,成本高,会对环境造成二次污染,而且还会破坏部分氨基酸,从而影响角蛋白的利用率。利用产角蛋白酶的微生物或角蛋白酶对富含角蛋白的有机废弃物进行降解是一种效率高、成本低和环境友好的方式,通过生物转化羽毛废弃物形成的营养均衡易消化物质中含有氨基酸、多肽和铵离子,既可以作为动物饲料又能作为生物肥料原料。细菌产生的角蛋白酶已经在皮革工业中有了一定应用,利用产角蛋白酶的细菌对角蛋白废弃物进行降解在有机肥料产业中具有相当大的应用潜力。
1 细菌角蛋白酶特点
角蛋白是一种机械强度高、化学性质稳定、不溶性的硬质蛋白,根据二级结构的不同,可分为α-角蛋白和β-角蛋白。α-角蛋白是由具有螺旋构象的多肽链构成的纤维状蛋白[1-2],其亚基间的氨基酸序列由富含α螺旋的中央棒状区和两侧的非螺旋区构成,亚基之间形成大量的二硫键;β-角蛋白由反向平行的β-折叠片以平行的方式堆积而成[2]。由于内部具有高度交联的二硫键、氢键,且分子间具有相互疏水作用,角蛋白很难被一般蛋白酶如木瓜蛋白酶、胃蛋白酶、胰蛋白酶等所降解[3]。
角蛋白酶是一种特殊的蛋白酶,它能够降解羽毛、蹄甲、毛发、羊毛等难溶的硬质角蛋白。这类酶对角蛋白具有较高的底物特异性。很多微生物包括细菌、真菌、放线菌都能产生角蛋白酶。产角蛋白酶的微生物广泛存在于自然界中,目前国内外已经分离筛选到很多能降解角蛋白的菌株,已报道的具有降解角蛋白能力的细菌主要来源于芽孢杆菌属,如地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(B. subtilis)、短小芽孢杆菌(B. pumilus)和蜡样芽孢杆菌(B. cereus)[4-7],还有革兰氏阴性菌如嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)[8];已报道的能降解角蛋白的放线菌主要属于马杜拉放线菌属(Actinomadura sp. )、链霉菌属(Streptomyces sp.)[9-10]。
Lin等最早从地衣芽孢杆菌中纯化到属于S8蛋白酶家族的角蛋白酶[11]。早期对角蛋白酶的研究发现,大多数角蛋白酶属于丝氨酸蛋白酶中的枯草杆菌蛋白酶,主要来源于芽孢杆菌属和放线菌属微生物[12]。后来也有一些金属蛋白酶中的角蛋白酶被陆续发现。来源于金黄杆菌(Chryseobacterium sp. ) kr6的角蛋白酶Q1被鉴定属于M14金属蛋白酶家族[13]。来源于链霉菌(Streptomyces sp.) 594[14]、溶杆菌(Lysobacter sp.)NCIMB 9497[15]、金黄杆菌(Chryseobacterium sp.) [16]、枯草芽孢杆菌(B. subtilis) MTCC 9102 [17]、微杆菌(Microbacterium sp.) kr10[18]和铜绿假单胞菌(Pseudomonas aeruginosa)[19]的金属蛋白酶也能降解角蛋白,这些金属蛋白酶对金属抑制剂乙二酸四乙酸(EDTA)敏感。
角蛋白酶的特性取决于产酶微生物。大多数角蛋白酶都为胞外酶,一般为碱性或中性酶,最适反应pH值为7.5~9.0,但也有少数角蛋白酶具有极强的耐碱性[20],部分角蛋白酶在酸性条件下具有酶解活性[17]。有些角蛋白酶有着较宽的最适反应pH值范围,巨大芽孢杆菌(Bacillus megatherium)的角蛋白酶在pH值为7~11时都具有角蛋白酶活性,但在pH值为7~8之间活性最高[21]。 芽孢杆菌比如枯草芽孢杆菌、短小芽孢杆菌、蜡样芽孢杆菌的角蛋白酶最适反应温度为40~50 ℃,最适pH值为5~9[22]。嗜麦芽寡养单胞菌的角蛋白酶最适反应温度为60 ℃,最适pH值为10[23]。不同微生物来源的角蛋白酶最适反应温度差异较大,有些细菌角蛋白酶的耐热性较好,最适反应温度在40~70 ℃之间,比如微白黄链霉菌(Streptomyces albidoflavus)、热紫链霉菌(Streptomyces thermoviolaceus)和Streptomyces gulbargensis[24-26];闪烁杆菌(Fervidobacterium pennavorans) 的角蛋白酶最适反应温度为80 ℃[27];高温菌F. islandicum AW-1的角蛋白酶最适反应温度达到100 ℃[28]。
羽毛水解液可以促進种子发芽率的提高和作物生长。盆栽条件下浇施羽毛生物降解液的处理,小白菜的叶片SPAD值、株高、地上部分生物量均显著高于CK处理,叶片SPAD值显著大于浇施三元素水溶复合肥(FH)的处理,株高、地上部分生物量和氮肥利用率与FH处理没有显著差异[37]。Paul等研究表明,羽毛水解液能够促进孟加拉鹰嘴豆的出芽和生长,添加羽毛水解液的处理侧根数与根瘤菌数量是其他处理的3倍,主要是由于羽毛水解液的施用增加了土壤中可直接利用的氨基酸或营养物质浓度,促进了根表面积的提高,更有利于固氮菌在根部附着、入侵和生长,从而促进根瘤的形成[49]。
施加羽毛水解液可以增加土壤中的有益菌群数量,Paul等认为,施加羽毛水解液的处理相比空白对照土壤中固氮菌和溶磷细菌的数量分别增加了1.9倍和5.8倍[49],与Rai等的研究结果[51]一致。土壤中加入含有角蛋白降解细菌的羽毛水解液后,有益菌群数量显著增加[42],但过量添加则会减少有益菌群的数量,可能是因为高浓度的NaCl会对土壤中土著微生物产生毒性[49-50]。
4 农业方面其他应用
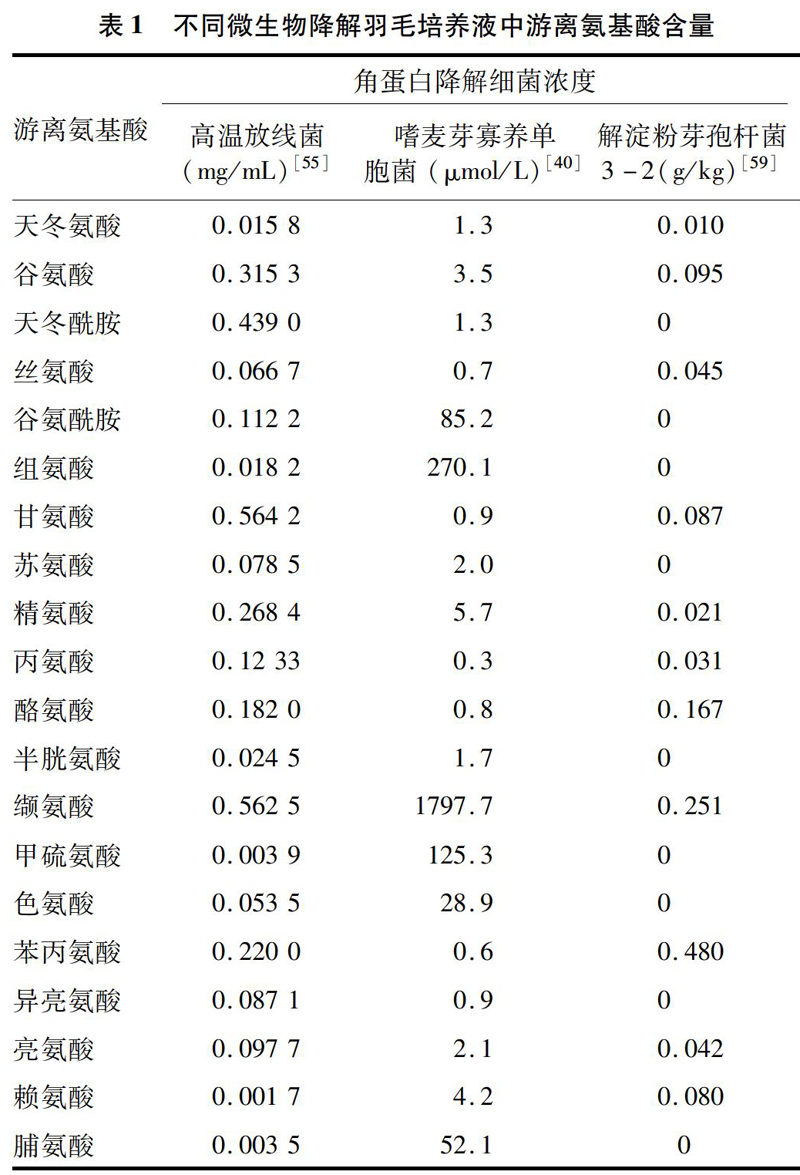
利用角蛋白降解细菌降解羽毛释放游离氨基酸的工艺在制药、饲料、可生物降解膜制作、制胶行业均可应用[12,40,52-53]。羽毛是一种很好的氨基酸来源。不同的菌降解羽毛后获得的氨基酸组分有所差异(表1)[54-55]。羽毛粉经过微生物酶解之后营养特性提高,更利于动物吸收[56-57]。羽毛降解后产物中的营养组成类似于大豆蛋白。地衣芽孢杆菌已经在工业中被用于生产商业角蛋白酶。在含有羽毛的堆肥中添加角蛋白降解菌可起到除臭的作用,同时还能产生抗生素,抑制病原菌的产生[58]。
5 总结
目前,我国农田尤其是集约化农业区,化肥过量投入现象十分普遍。过量化肥投入并未带来作物产量的同步提升,化肥(尤其是氮肥)过量施用引发了一系列环境问题,如温室气体排放量增加、水体富营养化等。来自家禽业的羽毛废弃物是很好的氮碳来源,利用角蛋白降解细菌将废弃羽毛转化为含氨基酸的肥料,替代化肥提高农作物产量和品质,有利于农业的可持续发展。
利用角蛋白降解菌降解羽毛形成一种优质的有机肥料在农业中应用,既能促进植物生长、提高作物品质,还能起到生物防治作用,是一种非常经济、环境友好的有机废弃物利用方式。利用微生物降解羽毛的产物作为肥料,既能提供有利于植物生长的大量元素C、N及微量元素,同时还产生促进植物细胞分裂的植物生长激素IAA。有的角蛋白降解菌不仅具有降解羽毛的作用,同时也是一种植物益生菌,通过分泌蛋白酶抑制病原菌生长,起到生物防治的作用。因此利用角蛋白降解菌降解羽毛废弃物生产的生物有机肥料,对于农田生态、环境保护、人类健康、土壤生物活性维持起着重要作用,有利于有机农业的可持续发展。
参考文献:
[1]Mckittrick J,Chen P Y,Bodde S G,et al. The structure,functions,and mechanical properties of keratin[J]. JOM,2012,64(4):449-468.
[2]Meyers M A,Chen P Y,Lin A Y,et al. Biological materials:structure and mechanical properties[J]. Progress in Materials Science,2008,53(1):1-206.
[3]贾如琰,何玉凤,王荣民,等. 角蛋白的分子构成、提取及应用[J]. 化学通报,2008(1):1-6.
[4]刘柏宏,张 娟,堵国成,等. 地衣芽孢杆菌来源角蛋白酶N端对活力及其热稳定性的影响[J]. 微生物学通报,2014,41(8):1491-1497.
[5]Rajput R,Tiwary E,Sharma R,et al. Swapping of pro-sequences between keratinases of Bacillus licheniformis and Bacillus pumilus:altered substrate specificity and thermostability[J]. Enzyme and Microbial Technology,2012,51(3):131-138.
[6]Abdel-Naby M A,El-Refai H A,Mohammad H I. Structural characterization,catalytic,kinetic and thermodynamic properties of keratinase from Bacillus pumilus FH9[J]. International Journal of Biological Macromolecules,2017,105(1):973-980.
[7]E Silva L A D,Macedo A J,Termignoni C . Production of keratinase by Bacillus subtilis S14[J]. Annals of Microbiology,2014,64(4):1-9.
[8]Zhen F,Juan Z,Liu B H,et al. Cloning,heterologous expression and characterization of two keratinases from Stenotrophomonas maltophilia BBE11-1[J]. Process Biochemistry,2014,49(4):647-654.
[9]Habbeche A,Saoudi B,Jaouadi B,et al. Purification and biochemical characterization of a detergent-stable keratinase from a newly thermophilic actinomycete Actinomadura keratinilytica strain Cpt29 isolated from poultry compost[J]. Journal of Bioscience and Bioengineering,2014,117(4):413-421.
[10]Xie F,Chao Y,Yang X,et al. Purification and characterization of four keratinases produced by Streptomyces sp. strain 16 in native human foot skin medium[J]. Bioresource Technology,2010,101(1):344-350.
[11]Lin X,Lee C G,Casale E S,et al. Purification and characterization of a keratinase from a feather-degrading Bacillus licheniformis strain[J]. Applied and Environmental Microbiology,1992,58(10):3271-3275.
[12]Brandelli A,Daroit D J,Riffel A. Biochemical features of microbial keratinases and their production and applications[J]. Applied Microbiology and Biotechnology,2010,85(6):1735-1750.
[13]Riffel A,Brandelli A,Bellato C D,et al. Purification and characterization of a keratinolytic metalloprotease from Chryseobacterium sp. kr6[J]. Journal of Biotechnology,2007,128(3):693-703.
[14]Azeredo L I,Lima M B,Coelho R R,et al. Thermophilic protease production by Streptomyces sp. 594 in submerged and solid-state fermentations using feather meal[J]. Journal of Applied Microbiology,2006,100(4):641-647.
[15]Wang S L,Wan-Ting H,Tzu-Wen L,et al. Purification and characterization of three novel keratinolytic metalloproteases produced by Chryseobacterium indologenes TKU014 in a shrimp shell powder medium[J]. Bioresource Technology,2008,99(13):5679-5686.
[16]Silveira S T,Gemelli S,Segalin J,et al. Immobilization of keratinolytic metalloprotease from Chryseobacterium sp. strain kr6 on glutaraldehyde-activated chitosan[J]. Journal of Microbiology and Biotechnology,2012,22(6):818-825.
[17]Balaji S,Kumar M S,Karthikeyan R,et al. Purification and characterization of an extracellular keratinase from a hornmeal-degrading Bacillus subtilis MTCC (9102)[J]. World Journal of Microbiology and Biotechnology,2008,24(11):2741-2745.
[18]Thys R S,Brandelli A. Purification and properties of a keratinolytic metalloprotease from Microbacterium sp.[J]. Journal of Applied Microbiology,2006,101(6):1259-1268.
[19]Lin H H,Yin L J,Jiang S T. Expression and purification of Pseudomonas aeruginosa keratinase in Bacillus subtilis DB104 expression system[J]. Journal of Agricultural and Food Chemistry,2009,57(17):7779-7784.
[20]Shinji M,Ichikawa M,Oka T,et al. Molecular characterization of a keratinolytic enzyme from an alkaliphilic Nocardiopsis sp. TOA-1[J]. Enzyme and Microbial Technology,2004,34(5):482-489.
[37]魏啟舜,赵荷娟,周 影,等. 施用羽毛生物降解液对白菜生长和基质养分的影响[J]. 江苏农业科学,2019,47(20):156-159.
[38]魏启舜,赵荷娟,郭成宝,等. 羽毛生物降解氨基酸肥对草莓生长和果实品质的影响[J]. 中国农学通报,2019,35(32):46-52.
[39]Nagarajan S,Eswaran P,Masilamani R P,et al. Chicken feather compost to promote the plant growth activity by using keratinolytic bacteria[J]. Waste and Biomass Valorization,2018,9(4):531-538.
[40]Jin-Ha J,Lee O M,Young-Dong J,et al. Production of keratinolytic enzyme by a newly isolated feather-degrading Stenotrophomonas maltophilia that produces plant growth-promoting activity[J]. Process Biochemistry,2010,45(10):1738-1745.
[41]Kshetri P,Roy S S,Sharma S K,et al. Transforming chicken feather waste into feather protein hydrolysate using a newly isolated multifaceted keratinolytic bacterium Chryseobacterium sediminis RCM-SSR-7[J]. Waste and Biomass Valorization,2019,10(1):1-11.
[42]Bhange K,Chaturvedi V,Bhatt R. Ameliorating effects of chicken feathers in plant growth promotion activity by a keratinolytic strain of Bacillus subtilis PF1[J]. Bioresources and Bioprocessing,2016,3(1):13.
[43]Khan M S,Zaidi A,Wani P A. Role of phosphate-solubilizing microorganisms in sustainable agriculture-A review[J]. Agronomy for Sustainable Development,2007,27(1):29-43.
[44]张艾明.磷在农田土壤中的迁移转化规律及其对农业环境的影响[C]//组学大数据整合生物信息学研讨会论文集,2017.
[45]Rodriguez H,Gonzalez T,Goire I,et al. Gluconic acid production and phosphate solubilization by the plant growth-promoting bacterium Azospirillum spp[J]. Die Naturwissenschaften,2004,91(11):552-555.
[46]Kaur G,Reddy M S. Influence of P-solubilizing bacteria on crop yield and soil fertility at multilocational sites[J]. European Journal of Soil Biology,2014,61:35-40.
[47]Sudhir K R,Mukherjee A K. Optimization for production of liquid nitrogen fertilizer from the degradation of chicken feather by iron-oxide (Fe3O4) magnetic nanoparticles coupled β-keratinase[J]. Biocatalysis and Agricultural Biotechnology,2015,4(4):632-644.
[48]Teale W D,Paponov I A,Palme K. Auxin in action:signalling,transport and the control of plant growth and development[J]. Nature Reviews Molecular Cell Biology,2006,7(11):847-859.
[49]Paul T,Halder S K,Das A,et al. Exploitation of chicken feather waste as a plant growth promoting agent using keratinase producing novel isolate Paenibacillus woosongensis TKB2[J]. Biocatalysis and Agricultural Biotechnology,2013,2(1):50-57.
[50]Asik B B,Turan M A,Celik H,et al. Effects of humic substances on plant growth and mineral nutrients uptake of wheat (Triticum durum cv. Salihli) under conditions of salinity[J]. Asian Journal of Crop Science,2009,1(2):87-95.
- 高校公共英语课堂教学成效提升策略探析
- 发挥大学生专业优势参与社区建设的路径探究
- “全民记者”时代大学生新闻素养教育调研
- “00后”大学生入学教育现状探究
- 基于转化医学视域分析医学院校科技管理创新
- 国家级非物质文化遗产项目的传承与保护
- 对国内外航空服务质量管理的比较
- 二孩政策后某医院新生儿随访情况分析
- 2008-2018年全国档案工作者年会统计与分析
- 创新网络意识形态工作的方式方法
- 标准化和卓越绩效融合提升企业经营质量
- 电力企业内部管理建设存在的问题及优化路径
- 如何做好新入职员工思想政治教育工作
- 电力系统党建与精神文明建设问题探析
- 如何强化国有企业党风廉政建设
- 电力信息通信人员岗位胜任力素质模型的构建
- 从汉钢公司成本领先战略谈企业经营管理关系
- 企业融资约束与创新绩效研究
- 国企改革背景下的国有投资公司作用浅析
- 大型国有企业战略设计研究
- 基于战略导向的企业预算管理创新
- 会计财务管理及内部控制的探讨
- 企业金融投资常见的风险及控制对策
- 构建企业财务管理和资产管理相结合模式的思考
- 现代风险导向审计模式下的企业内部审计问题
- half-lunatic
- half-lunged
- half-mad
- half-made
- half-madly
- half-madness'
- half-madness
- half-madnesses
- half-madnesses'
- half-madness's
- half-marked
- half-mast
- half-matured
- halfmeant
- half-meant
- half-merited
- half-monthly
- half-moslem
- half-mumbled
- half-muslim
- half-naked
- halfness
- halfnesses
- half-normal
- half-normally
- 蛇无大小,毒性一般
- 蛇无头不行
- 蛇无头不行,鸟无翅不飞
- 蛇无头不行, 鸟无翼不飏。
- 蛇无头儿不行
- 蛇无头而不行
- 蛇无头而不行,鸟无翅而不飞
- 蛇有蛇路,鼠有鼠路
- 蛇有蛇踪,鼠有鼠路
- 蛇村
- 蛇杖
- 蛇杯
- 蛇杯弓影
- 蛇柳
- 蛇欲吞象
- 蛇毛马角
- 蛇求人助
- 蛇没吃饱,蛤蟆可掉了命了
- 蛇没吃饱,青蛙丧了命
- 蛇滑
- 蛇灰蚓线
- 蛇灵
- 蛇状的虹
- 蛇獴
- 蛇珠