赵许朋 刘勇 魏加练

摘要:以贵长猕猴桃茎段为外植体,研究不同激素组合培养基对愈伤组织诱导、不定芽分化增殖、无菌苗生根等的影响。结果表明,贵长猕猴桃茎段在MS+2,4-D 2.0 mg/L+6-BA 0.4 mg/L+蔗糖30 g/L+琼脂粉8 g/L培养基上愈伤组织诱导率相对最高,达100.0%,且愈伤组织生长状况相对较好,质地最优,呈黄白色湿润致密状,在MS+6-BA 5 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂粉8 g/L培养基上不定芽出芽率相对最高,达83.33%,在MS+6-BA 4.0 mg/L+NAA 0.5 mg/L+GA3 0.4 mg/L+蔗糖30 g/L+琼脂粉8 g/L培养基上不定芽增殖率相对最高,达100%,继代培养6代时的平均繁殖系数达6.48;不定芽在含IBA 0.6 mg/L的1/2MS培养基上培养生根率相对最高,达到95.83%,且形成庞大的根系,50株试管苗经炼苗移栽成活率可达96.0%。
关键词:贵长猕猴桃;茎段;增殖;植株再生
中图分类号: S663.404+.3 ?文献标志码: A ?文章编号:1002-1302(2019)22-0043-04
猕猴桃为猕猴桃科猕猴桃属(Actinidia Lindl.)多年生藤本果树,雌雄异株,在我国发现最早,其种群数量、分布范围均为世界之首,有“猕猴桃故乡”之称[1]。猕猴桃果实中含有丰富的维生素C、多种矿物质及膳食纤维,素有“水果之王”的美誉[2]。贵长猕猴桃为贵州省选育的中华猕猴桃优良品种[3],被国家质检总局认定为国家地理标志保护产品[4],具有十分广阔的研究和应用前景。自贵长猕猴桃出现伊始,学者们主要对其病害防治、生理特性、保鲜等方面[5-7]开展研究,而有关其组织培养离体再生的研究几无报道。
组织培养是一项通过无性繁殖方式快速再生植株的生物技术,其育苗效率高于扦插嫁接等传统繁殖手段,且具有保持母本优良性状、克服有性繁殖造成品种退化的优势[8-11]。组织培养技术是品种遗传改良和遗传转化等技术的基础,从20世纪70年代開始,组织培养技术育苗已成为猕猴桃良种繁育的重要方法[12-13]。本研究以贵长猕猴桃幼嫩茎段为外植体,通过组织培养对其愈伤组织诱导、愈伤组织分化不定芽、无菌苗生根等进行研究,以建立贵长猕猴桃茎段高效再生体系,为其快速繁殖和遗传转化研究提供技术支持。
1 材料与方法
1.1 枝条采集与消毒处理
于贵州省修文县谷堡乡猕猴桃基地采集贵长猕猴桃(Actinidia chinensis cv. Guichang)幼嫩枝条,洗净,短截成长约3 cm的无腋芽茎段;75%乙醇消毒处理40 s,再用0.1%氯化汞(HgCl2)消毒处理9 min;用无菌水冲洗3~4次,切成长为0.5~1.0 cm的茎段。
1.2 愈伤组织的诱导
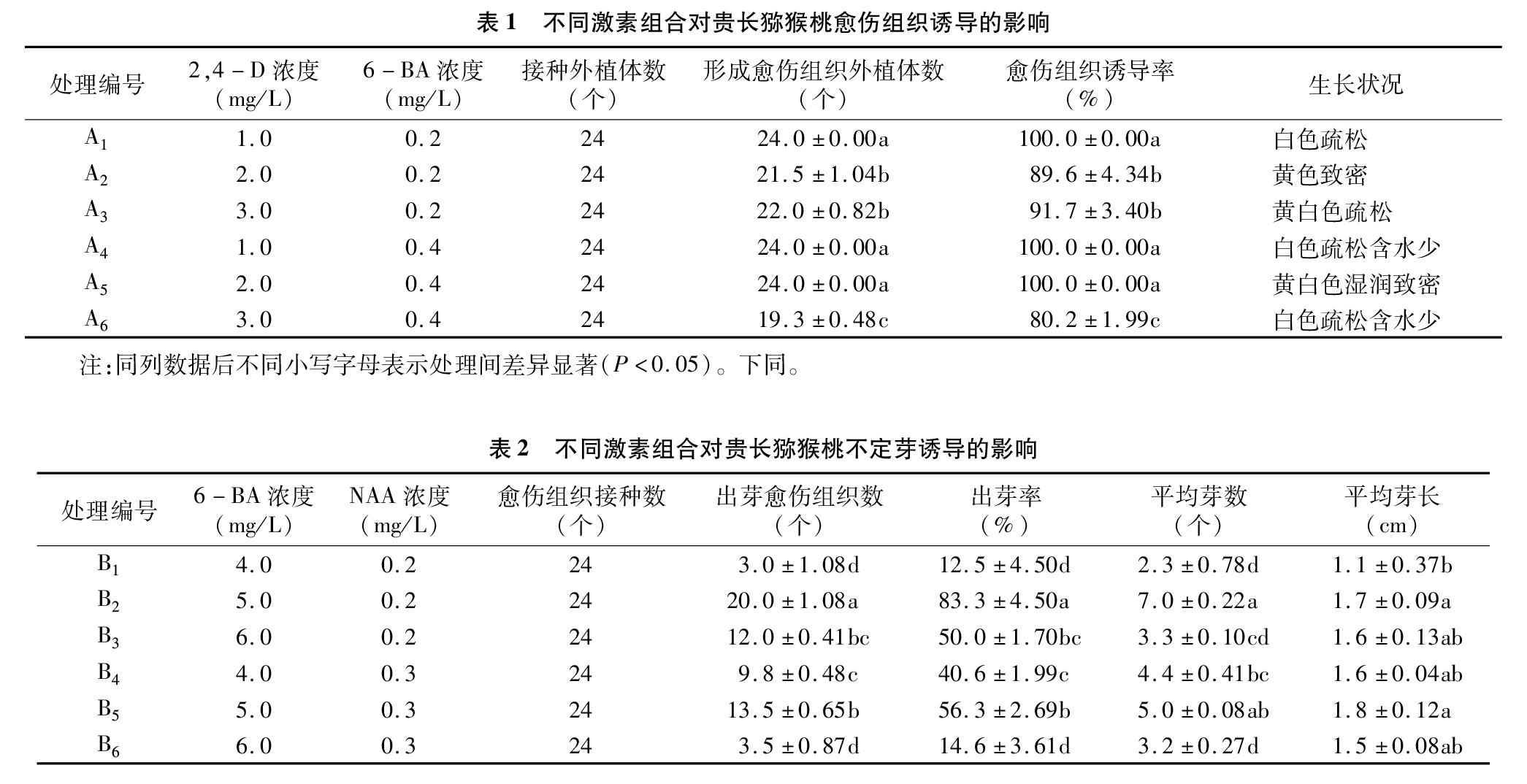
将消毒处理的茎段作为外植体,接种到以MS为基础培养基,含2,4-二氯苯氧乙酸(2,4-D)质量浓度分别为1.0、2.0、3.0 mg/L、6-苄氨基嘌呤(6-BA)质量浓度分别为02、0.4 mg/L 不同激素组合的培养基上暗培养1周、光照培养3周,每处理接种茎段24个,重复3次,处理编号依次为A1~A6(表1);调查愈伤组织生长状况,统计愈伤组织诱导率。
1.3 不定芽的诱导与增殖
1.3.1 不定芽的诱导 挑选质地致密、生长旺盛的愈伤组织,接种到以MS为基础培养基,含6-BA质量浓度分别为4.0、5.0、6.0 mg/L、萘乙酸(NAA)质量浓度分别为0.2、0.3 mg/L 不同激素组合的不定芽诱导培养基上暗培养1周、光照培养8周,每处理接种愈伤组织24个,重复3次,处理编号依次为B1~B6(表2);调查统计不定芽诱导情况。
1.3.2 不定芽的增殖 取长1 cm左右的不定芽,接种到以MS为基础培养基,含6-BA质量浓度分别为2.0、3.0、4.0 mg/L、NAA质量浓度分别为0.5、1.0 mg/L、赤霉素(GA3)质量浓度为 0.4 mg/L 不同激素组合的不定芽增殖培养基上光照培养3周,每处理接种不定芽24个,重复3次,处理编号依次为 C1~C6(表3);连续继代培养6代,调查统计不定芽繁殖情况。
1.4 不定芽生根与试管苗移栽
切取长约3 cm的不定芽,接种到含吲哚丁酸(IBA)质量浓度分别为0.0、0.2、0.4、0.6、0.8、1.0 mg/L的1/2 MS固体培养基上光照培养2周,每处理接种不定芽24个,重复3次,处理编号依次为D1~D6(表4);调查统计不定芽生根率和不定根数量。将生根情况较好的带根苗转入以珍珠岩为基质的1/2 MS培养基上光照培养2周,检查根系发育状况;打开50株组培苗的瓶盖进行炼苗1周,洗净根系,移栽至装有珍珠岩、田间土壤比例为1 ∶ 4的营养钵中培养2周,每天适量浇水;统计移栽成活率。
1.5 组织培养条件
试验在无菌条件下进行,培养基中同时加蔗糖、琼脂粉分别为30、8 g/L,pH值为5.85。组织培养环境条件温度为 (25±2) ℃,光照度4 500 lx、光照周期为16 h/d。
1.6 数据分析
采用SPSS 17.0软件对试验数据进行统计分析。
2 结果与分析
2.1 不同激素组合对贵长猕猴桃茎段愈伤组织诱导的影响
试验结果表明,接种后1周,茎段始膨大萌动,接种后2周左右分化出愈伤组织(图1-1),接种后4周茎段愈伤组织诱导率达到最大。由表1可见,处理A6的愈伤组织诱导率相对最低,为80.2%,处理A1、A4、A5的愈伤组织诱导率最高,高达100.0%,显著高于其他3个处理(P<0.05),其中,愈伤组织在A5培养基上生长状况相对较好,质地最优,呈黄白色湿润致密状。因此,贵长猕猴桃茎段愈伤组织诱导最佳培养基为A5,即MS+2,4-D 2.0 mg/L+6-BA 0.4 mg/L+蔗糖30 g/L+琼脂粉8 g/L。
2.2 不同激素组合对贵长猕猴桃不定芽诱导与增殖的影响
2.2.1 不定芽的诱导 由表2、图1-2、图1-3可见,组织培养2周,愈伤组织开始变绿;组织培养7周,处理B2、B5培养基上最先分化出不定芽;组织培养9周,不定芽分化基本稳定,处理B2的不定芽出芽率相对最高,达83.33%,显著高于其他5个处理(P<0.05),分化出的不定芽有明显的茎、叶分化,长势良好,其形成的平均芽数也相对最高,为7.0个,与处理B5差异不显著(P>0.05),显著高于其他4个处理,平均芽长为1.7 cm,略短于B5培养基,且相互间差异不显著。因此,贵长猕猴桃不定芽诱导的最佳培养基为B2培养基,即 MS+6-BA 5 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂粉8 g/L。
2.2.2 不定芽的增殖 由表3、图1-4可见,接种不定芽培养1周,腋芽开始萌动,2周左右有新的不定芽增殖;处理C2、C3的增殖效果相对最好,增殖率达100.00%,处理C1的增殖效果相对最差,增殖率为87.50%,显著低于其他5个处理(P<0.05),说明贵长猕猴桃在一定浓度的6-BA、NAA、GA3刺激下,较易发生增殖现象,且增殖效果良好;培养后6周,新生芽出现簇生状;不定芽处理C3培养基继代培养6代,其平均繁殖系数相对最高,达到6.48,显著高于其他5个处理,且不定芽生长旺盛。因此,贵长猕猴桃不定芽最佳增殖培养基为C3培养基,即MS+6-BA 4.0 mg/L+NAA 0.5 mg/L+GA3 0.4 mg/L+蔗糖30 g/L+琼脂粉8 g/L。
2.3 IBA不同浓度对贵长猕猴桃不定芽生根的影响及炼苗移栽
由表4可见,接种后1周开始萌生不定根,处理D4培养基的生根率相对最高,为95.83%,与处理D3、D5差异不显著(P>0.05),显著高于其他3个处理(P<0.05),其平均生根数相对最多,为4.04条,显著高于其他5个处理,其根平均长度相对较长,为0.52 cm,顯著低于处理D3,显著高于其他4个处理。将处理D4的生根不定芽转入含1/2 MS液体培养基的珍珠岩基质中进行根系增殖,结果显示,无菌苗生长旺盛,根的长度增长、数量明显增加,且有侧根增生,培养2周左右时形成庞大的根系,有利于试管苗移栽成活(图1-5)。50株试管苗炼苗移栽成活48株,成活率达到96.0%,且生长良好(图1-6)。因此,贵长猕猴桃不定芽生根的最佳培养基为1/2 MS+IBA 0.6 mg/L+蔗糖30 g/L+琼脂粉8 g/L。
3 结论与讨论
猕猴桃组织培养是学者们研究的一个热点,具有十分广阔的应用前景。本试验研究贵长猕猴桃茎段组织培养离体再生时发现,茎段在MS+2,4-D 2.0 mg/L+6-BA 0.4 mg/L+ 蔗糖30 g/L+琼脂粉8 g/L培养基上愈伤组织诱导率相对最高,达100.0%,且诱导出的愈伤组织生长良好,与Kim等的研究结果[14-15]一致。
愈伤组织分化成不定芽是组织培养的一个关键点,更是一个难点,有些植物因无法从愈伤组织分化成不定芽而阻碍了其再生体系的建立[16]。在猕猴桃组织培养过程中,常用的植物生长调节剂有玉米素(ZT)和6-苄氨基嘌呤(6-BA),且ZT效果要优于6-BA[17-18],但是,玉米素价格昂贵,必然会明显增加组织培养的成本,而目前有6-BA代替玉米素完成猕猴桃愈伤组织分化不定芽过程的研究报道[19-20]。本试验在诱导愈伤组织形成不定芽时采用6-BA与NAA配合使用,取得了良好的效果,不定芽出芽率高达83.33%,平均出芽数可达到7.0个,与隆前进等的研究结果[21-22]吻合。须说明的是,本研究中,不同激素配比虽然能够诱导产生不定芽,但有的激素组合会导致不定芽顶芽萎缩、叶片膨大形成畸形苗且发育较差等现象产生。
对不定芽进行增殖培养以产生新的不定芽,这是提高试管苗数量的基础。在研究不定芽增殖过程中,学者们多对不定芽的第1代增殖系数进行研究[9,12,23-24],鲜见对不定芽连续继代培养的研究[1]。严姜黎等分别对红肉猕猴桃、红阳猕猴桃、美味猕猴桃不定芽1代增殖培养进行研究,结果表明,其增殖系数分别为3.7、5.2、4.8[12,21,23]。本研究对贵长猕猴桃不定芽继代培养1~6代增殖系数进行研究,结果表明,不定芽在MS+6-BA 4.0 mg/L+NAA 0.5 mg/L+GA3 0.4 mg/L+蔗糖30 g/L+琼脂粉8 g/L培养基上培养可获得较高的增殖系数,达到6.48,且各代不定芽增殖系数相对稳定。
不定芽生根培养是形成离体再生植株的一个重要环节,生根的数量和质量决定炼苗移栽的成活率[25-27]。本研究将不定芽在含IBA的1/2MS固体培养基上刺激生根,再转入以珍珠岩为基质的1/2 MS壮根培养基上进行生根,取得了良好的生根效果,经过增殖培养,无菌苗根的长度延长、数量明显增加,且伴有侧根的增殖,2周左右形成庞大的根系,同时,将其炼苗移栽至装有珍珠岩、田间土壤比例为1 ∶ 4的营养钵中,移栽成活率达到96.0%。
本研究以2,4-D、6-BA、NAA、GA3等为生长调节剂,形成了贵长猕猴桃茎段的高效再生体系,为贵长猕猴桃试管苗的工厂化生产和基因工程育种打下了基础。
参考文献:
[1]赵许朋,周 月,杨 立,等. “红阳”猕猴桃茎段高效再生体系的建立[J]. 西南大学学报(自然科学版),2013,35(2):6-10.
[2]王 然,周 丹,罗 静,等. 猕猴桃病毒病研究进展[J]. 果树学报,2017,34(8):1043-1050.
[3]金方伦,黎 明,韩成敏,等. 贵长猕猴桃在黔北地区的生物学特性及丰产优质栽培技术[J]. 贵州农业科学,2009,37(10):175-177.
[4]王金华,杜 超,梁 晨,等. 贵长猕猴桃多糖提取工艺及体外抗氧化功能[J]. 食品科学,2016,37(20):19-23.
[5]冯 丽,魏 洪,黄亚励,等. 贵长猕猴桃腐烂菌的侵染途径及分离鉴定[J]. 中国酿造,2009,37(2):66-70.
[6]王明力,王文平,周文美,等. “贵长”猕猴桃低糖低甜度果脯护色及脱涩工艺的研究[J]. 食品工业科技,2003,24(1):62-63.
[7]曹 森,马 超,吉 宁,等. 乙烯吸附剂耦合1-MCP对“贵长”猕猴桃保鲜效果的影响[J]. 食品与发酵工业,2018,44(3):186-193.
[8]梁春辉,黄 敏,李秀平,等. 沙姜的组织培养与快繁技术[J]. 北方园艺,2017(19):11-15.
[9]周 玲,姚 振,郭永兵,等. 重楼属植物组织培养研究进展[J]. 北方园艺,2017(20):184-189.
[10]Shahzad,A,Parveen,et al. Plant tissue culture:applications in plant improvement and conservation[M]. Springer Singapore Plant Biotechnology:Principlesand Applications,2017:37-72.
[11]Yan Q,Karau M J,Greenwood-Quaintance K E,et al. Comparison of diagnostic accuracy of periprosthettic tissue culture in blood culture bottles to that of prosthesis sonication fluid culture for diagnosis of prosthetic joint infection(PJI)by use of bayesian latent class modeling and IDSA PJI criteria for classication[J]. Journal of Clinical Microbiology,2018,56(6):1-11.
[12]严姜黎,张 翼,邢 梅,等. 红肉猕猴桃离体快速繁殖技术研究[J]. 华中农业大学学报,2008,27(1):101-104.
[13]Bahar S O,Hikmet B. Application of tissue culture and transformation techniques in model species Brachypodium distachyon[J]. Brachypodium Genomics,2018,1667:289-310.
[14]Kim M,Kim S C,Moon D Y,et al. Rapid shoot propagation from micro-cross sections of kiwifruit(Actinidia deliciosa cv.‘Hayward)[J]. Journal of Plant Biology,2007,50(6):681-686.
[15]Filiz Akba,igˇdem Iikalan,Süreyya Namli. Callus induction and plant regeneration from different explants of Actinidia deliciosa[J]. Applied Biochemistry and Biotechnology,2009,158(2):470-475.
[16]宋启玲,王贵元,孟想想,等. 不同消毒方式及激素配比对毛桃愈伤组织形成的影响[J]. 北方园艺,2017(17):61-66.
[17]Oliveira M M,Pais M S. Plant regeneration from protoplasts of long-term callus cultures of Actinidia deliciosa var.deliciosa cv.Hayword(kiwifruit)[J]. Plant Cell Reports,1991,9(11):643-646.
[18]Bi J H,Liu Y L,Asghar S. In vitro organogenesis and plant regeneration from leaf explants of Actinidia latifolia[J]. Journal of Fruit Science,2005,22(4):405-408.
[19]Takahashi W,Sugawara F,Yamamoto N,et al. Plant regeneration in Actinidia polygama Miq.by leaf,stem,and petiole culture with zeatin,and from stem-derived calli on low-sucrose medium(kiwifruit)[J]. Journal of Forest Research,2004,9(1):85-88.
[20]甘麗萍,阮神清,曾晓琳. “三峡虹”红阳猕猴桃组织培养体系的筛选[J]. 北方园艺,2016(9):114-117.
[21]隆前进,吴延军,谢 鸣. “红阳”猕猴桃叶片和带芽茎段的组织培养快繁技术[J]. 浙江农业学报,2010,22(4):429-432.
[22]Prado M J,Gonzalez M V,Romo S,et al. Adventitious plant regeneration on leaf explants from adult malekiwifruit and AFLP analysis of genetic variation[J]. Plant Cell Tissue and Organ Culture,2007,88:1-10.
[23]Thomas E S,Kortessa N D. Response to increasing rates of boron and NaCl on shoot proliferation and chemical composition of in vitro kiwifruit shoot cultures[J]. Plant Cell Tissue and Organ Culture,2004,79:285-289.
[24]张太奎,郭 腾,刘 峥,等. 国外引进品种“Hort16A”猕猴桃离体再生体系建立[J]. 西南林业大学学报,2017,37(1):54-60.
[25]罗珍珍,由翠荣,张 慧,等. 不同品种彩色马蹄莲不定芽增殖及再生体系的优化[J]. 江苏农业科学,2017,45(11):38-41.
[26]蒋 瑶,陈文波,蒋炷宇. 亚洲百合不定芽的诱导及再生植株的建立[J]. 江苏农业科学,2017,45(12):35-38.
[27]赵许朋,罗克明,周 月,等. “红阳”猕猴桃叶盘高频直接再生体系的建立[J]. 生物工程学报,2013,29(11):1599-1606.
- 新医改背景下民营医院财务管理存在的问题及对策
- 农村远程医疗开展过程中的问题及对策探究
- 浅谈疾控机构公共卫生人力资源现状与管理对策
- 大数据对医院档案管理发展的影响分析
- 加强中医医院宣传文化建设的实践途径
- 提升中医医院品牌建设的微信公众平台建设策略
- 推进医院行政管理科学化和精细化的思考
- 社区儿童意外伤害网络支持性干预研究
- 浅谈环境监测人事管理与思想政治工作的互助性
- 基于心流理论的移动支付用户持续使用意愿研究
- 科研项目内部审计材料采购案例分析
- 试论军队营房保障的信息化
- 新媒体环境和特殊群体关系研究
- 新生代农民工困境探析
- 网络舆情应急管理系统设计的对策建议
- 养老产业PPP项目新模式的探索研究
- 公共政策与相关利益群体关系模式解析
- 试析如何提高房地产企业资金的内控管理水平
- 加强科研机构科研财务助理培养工作的思考
- 跨国集团服务共享下财务人员角色转换探讨
- 跨国公司财务内部控制体系完善策略研究
- 探析“营改增”对企业融资租赁的影响
- 电网企业融资租赁收益问题研究
- 财务数据共享对企业决策的影响及其应用
- 解读我国公司资本认缴制的改革
- reindications
- reindicted
- reindicting
- reindictment
- reindictments
- reindicts
- reindoctrinated
- reindoctrinates
- reindoctrinating
- reindoctrination
- reindorsement
- reindorsements
- reinduce
- reinduced
- reinducement
- reinducements
- reinduces
- reinducing
- reinduct
- reinducted
- reinducting
- re-induction
- reinduction
- re-induction's
- reinductions
- 立志贵专一
- 立忠
- 立性
- 立意
- 立意谴词
- 立愿
- 立懦廉顽
- 立成
- 立户分门
- 立扎
- 立扫千言
- 立把子
- 立报
- 立挣
- 立效
- 立教
- 立断
- 立新
- 立新功
- 立方
- 立方体
- 立方米
- 立时
- 立时三刻
- 立时刻