刘永焘
摘要:大家常见夏天冰块在手中很快的融化,但见过夏天冰块在室温下神奇般的“重新凝固”,并且能把一根刚放上去的绳子迅速冻结起吗?这里存在着什么样的物理原理呢?由于在此过程中的熔化率和凝固率的不同.最终造就了这样神奇现象。
关键词:捕获;重新凝固;热平衡;熔化率;凝固率
中图分类号:G633.7
文献标识码:A
文章编号:1003-6148(2014)5(S)-0050-2
为何在室温下一个正常的冰块会把刚放上去的一根绳子黏起来呢?在正常情况下,水的凝固点是0℃,不过,如果你用食盐水,其凝固点降低。为什么盐水的凝固点会低于0℃呢?这和绳子能拉起冰块之间有什么样的联系呢?
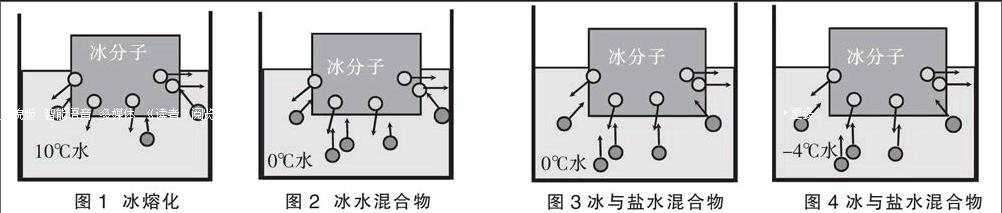
首先,要知道为何盐水的凝固点会降低呢?我们来看熔化是怎么进行的。用10℃自来水、0℃的冰和一个不错的保温杯,把自来水与冰倒入杯中,防止与外界热量交换。在这个过程中水分子不断从冰面逃逸到液态水中(即熔化)。熔化的同时,水分子又被抓回到冰表面上,即这个过程中又伴随着凝固。但是由于水的温度高,水分子运动剧烈,不容易捕获,所以凝固不剧烈。而冰的温度低,运动不剧烈,所以有更多的冰分子被水捕获,导致水量增加,最终结果是,冰开始熔化(如图1所示)。当然,水的温度下降。我们已经把“温水”变成了“冷水”,即熔化吸收了热量。这就是一个动态的过程。事实上,如果我们在容器中有足够的冰。最终容器中的水连同剩下的冰,将一直降温最终达到0℃。
如图2,在容器中的冰和水终于到达0℃。由于温度降低,水分子运动速度降低,最终冻结率和熔化率相同,冰量和水量不会改变。只要保持容器绝热,这种平衡会保持下去。而这个平衡在一标准大气压下的温度是0℃。这就是冰的熔点。
那么,加入盐后情况如何呢?让我们来看看。冻结率和熔化率相同,冰量和水量不会改变。现在若水中含有盐分子,或任何其他比盐分子更易溶于水的物质,破坏了平衡,但不溶于冰。水中的一部分分子被盐取代,这意味着,能够被捕获成冰的水分子的数量出现故障,因此冻结的速度下降。冰熔化的速度是不变的,因此由于盐的存在凝固速度降低,所以熔化速度比冻结快。冰开始熔化,熔化需要能量,吸取热量,温度继续降低,水分子运动放缓,温度下降到足以使水分子的运动放缓到可以使更多的水分子被冰捕获成为冰。最终。冻结的水分子的数量和熔化的冰分子的数量又相等,将再次达到平衡。这将是新的凝固点/熔点。盐的浓度越高,新的冰点/熔点的温度越低。所以盐水的凝固点/熔点会随着加入盐的多少而变化。但是,这并不能无限期地持续下去。在某一点盐水将成为饱和盐水。这时凝固点就不会再降低。最冷的一个盐和水的饱和溶液可以得到。在该温度下,盐就开始结晶。
而在正常情况下。加入了盐降低了其凝固点,所以可以促进冰熔化。但是为何刚开始反而把绳子冻结上去了呢?因为在这个过程中由于其降低了凝固点。加快了熔化,从而需要吸收大量的热,反而吸走了冰水结合处的大量的热,从而使冰水结合处的盐水混合物发生凝固,暂时凝固。从而把绳子也冻上了。
(栏目编辑 陈洁)
- 思维导图法在初中语文写作教学中的应用研究
- 多媒体教学在高中美术教学中的应用分析
- 新课改下高中信息技术教学存在的问题及对策
- 刍议城郊初中学生信息技术课学习能力的培养
- 信息技术课上学生游戏情结的疏导
- “翻转课堂”在高中信息技术教学中的应用研究
- 智慧课堂教学探索与实践
- 基于信息技术构建高中生物实验高效课堂
- 巧用微课,让学生爱上生物
- “互联网+”在生物实践教学中的应用
- 运用信息技术提升高中化学课堂教学效率的探索
- 基于网络环境的高中物理教学模式的研究和实践
- 信息技术在初中数学教学中的作用分析
- 巧用多媒体技术培养学生自主学习能力
- 多媒体下的历史教学探究
- 初中语文教学中多媒体的实际运用
- 微视频:助推语文生命课堂构建的研究策略
- 美术综合实践课程助推学习变革
- 基于核心素养下信息技术与初中语文教学整合实践分析
- 《音频和视频制作》单元项目教学设计
- 解读《鲁科版化学必修一新教材》
- 组织技能在初中生物课堂中的应用
- 谈谈初中数学二次函数中系数a、b、c的作用及相互之间的关系
- “探索直线平行的条件”教学设计与评析
- 最值问题
- cereals
- cerebel
- cerebella
- cerebellar
- cerebellum
- cerebellums
- faint¹
- fair
- fair amount
- fair-and-square
- fairaveragequality
- fair average quality
- fairdealing
- fair dealing
- faired
- fairer
- fairest
- fair game
- fair games
- fairground
- fairgrounds
- fair haired
- fair-haired
- fair haired boy
- fairier
- 上书痛哭
- 上书皇帝论事救人
- 上书谏诤
- 上了一条船
- 上了一课
- 上了别人的当
- 上了圈套
- 上了坡的虾子——跳不了几下了
- 上了大当
- 上了套子的猴子
- 上了套的牲口
- 上了套的牲口——听喝
- 上了套的牲口——听喝的
- 上了套的牲口——由不得自己
- 上了套的猴子——由人玩耍
- 上了套的猴子——跑不了
- 上了套的猴子——身不由己
- 上了山尖想上天
- 上了山顶想上天——贪得无厌
- 上了山顶想飞天
- 上了年纪
- 上了年纪的父母
- 上了弦的箭
- 上了当
- 上了望乡台