高美珠 吴家斌 张丽

[摘要] 目的 探讨细胞因子信号转导抑制蛋白-1(SOCS-1)及高糖培养条件对肾小球系膜细胞(HMC)生长的影响。方法 体外培养人肾小球细胞,应用脂质体2000转染SOCS-1 siRNA表达质粒及SOCS-1 无意义siRNA表达质粒。分为:对照组为甘露醇组;高糖模型组;高糖模型组+SOCS-1 siRNA干扰;高糖模型组+无意义siRNA,高糖模型组用 DMEM 培养液中加入葡萄糖,终浓度为30 mmol/L;流式检测细胞凋亡。Western印迹和荧光定量PCR检测系膜细胞信号转导和转录活化因子3(STAT3)和核转录因子KappaB(NF-κB)的表达。 结果 高糖+SOCS-1干扰组细胞凋亡率1.01%,对照组1.52%,高糖模型组1.95%,SOCS-1 siRNA干扰组细胞凋亡率下调,差异有统计学意义(P<0.05)。高糖模型组相对于对照组,Western Blot检测显示NF-kB水平表达上调[(1.21±0.08) vs (0.47±0.04),t=9.49,P<0.01];STAT3表达上调[(1.37±0.12) vs (0.54±0.06),t=10.64,P<0.01];SOCS-1 siRNA干扰组相对于无意义siRNA组,NF-kB水平表达上调[(0.80±0.08) vs (0.32±0.02),t=10,P<0.01]、STAT3表达上调[(0.87±0.10) vs (0.32±0.02),t=9.17,P<0.01]。(RT-PCR检测提示高糖模型组相对于对照组,NF-kB[(1.15±0.15)vs (0.80±0.16),t=2.9,P<0.05]、STAT3[(0.75±0.02)vs (0.46±0.09),t=5.686,P<0.01]表达上调;SOCS-1 siRNA干扰组相对于无意义siRNA组,NF-kB[(1.15±0.17)vs (0.80±0.09),t=3.18,P<0.05]、STAT3[(0.88±0.06)vs (0.40±0.01),t=13.7,P<0.01]表达上调。 结论 高糖环境会上调HMC的JAK/STAT信号通路,促进HMC的生长;干扰SOCS-1会上调JAK/STAT信号通路,并促进NF-κB的表达,降低细胞凋亡率,促进高糖环境下HMC的生长。
[关键词] SOCS-1;HMC;高糖;STAT3
[中图分类号] R4? ? ? ? ? [文獻标识码] A? ? ? ? ? [文章编号] 1674-0742(2019)07(b)-0037-05
Effect of Cytokine Signal Transduction Inhibitor-1 on the Growth of Mesangial Cells in High Glucose Environment
GAO Mei-zhu, WU Jia-bin, ZHANG Li
Department of Nephrology, Fujian Provincial Hospital, Fuzhou, Fujian Province, 350001 China
[Abstract] Objective To investigate the effects of cytokine signal transduction inhibitor-1 (SOCS-1) and high glucose culture conditions on the growth of mesangial cells (HMC). Methods Human glomerular cells were cultured in vitro, and SOCS-1 siRNA expression plasmid and SOCS-1 nonsense siRNA expression plasmid were transfected with liposome 2000, and were divided into: control group as the mannitol group; high glucose model group; high glucose model group + SOCS-1 siRNA interference; high glucose model group + meaningless siRNA, high glucose model group with DMEM culture medium added glucose, the final concentration was 30 mmol/L; flow detection of apoptosis; Western blot and real-time PCR were used to detect the expression of mesangial cell signal transduction and transcriptional activator 3 (STAT3) and nuclear transcription factor KappaB (NF-κB). Results The apoptotic rate was 1.01% in the high glucose+SOCS-1 interference group, 1.52% in the control group, and 1.95% in the high glucose model group. The apoptosis rate of the SOCS-1 siRNA interference group was down-regulated, the difference was statistically significant (P<0.05). Compared with the control group, Western Blot showed that the expression of NF-kB was up-regulated [(1.21±0.08) vs (0.47±0.04), t=9.49, P<0.01]; STAT3 expression was up-regulated[(1.37±0.12) vs (0.54±0.06), t=10.64, P<0.01]; SOC-kB level was up-regulated in SOCS-1 siRNA interference group compared with non-meaningful siRNA group [(0.80±0.08) vs (0.32±0.02), t=10, P<0.01], STAT3 expression was up-regulated [(0.87±0.10) vs (0.32±0.02), t=9.17, P<0.01]. RT-PCR detection indicated that the high glucose model group was compared with the control group, NF-kB [(1.15±0.15) vs (0.80±0.16), t=2.9, P<0.05], STAT3[(0.75±0.02) vs (0.46±0.09), t=5.686, P<0.01] expression up-regulation; SOCS-1 siRNA interference group vs. nonsense siRNA group, NF-kB[(1.15±0.17) vs (0.80±0.09) , t=3.18, P<0.05], STAT3 [(0.88±0.06) vs (0.40±0.01), t=13.7, P<0.01] expression was up-regulated. Conclusion The high glucose environment up-regulates the JAK/STAT signaling pathway of HMC and promotes the growth of HMC. Interfering with SOCS-1 up-regulates JAK/STAT signaling pathway, promotes the expression of NF-κB, decreases the apoptosis rate, and promotes the growth of HMC in high glucose environment.
[Key words] SOCS-1; HMC; High glucose; STAT3
肾小球系膜细胞(HMC)的过度增殖是导致肾间质纤维化及肾小球硬化的重要原因,甚至会导致肾脏病变,典型的例子就是糖尿病并发症糖尿病肾病。JAK/STAT(Janus激酶-信号传导及转录激活因子)信号通路是细胞内一连串蛋白质的相互作用造成的转导过程,受多种细胞因子和生长因子激发,与细胞的增殖、分化与肿瘤发生等多种行为密切相关[1]。研究显示在糖尿病肾病的发病过程中JAK/STAT信号通路较为活跃,并发挥了重要作用[2],这个信号通路中,相应的细胞因子会促使STAT磷酸化,磷酸化的STAT则会促进下游诸多基因的表达,SOCS-1在此通路中起着负调控因子的作用[3]。糖尿病带来高血糖,而糖浓度同样影响细胞的生长。高糖环境下肾小球系膜细胞生长的影响,以及SOCS-1在这个过程中的作用,是该实验试图探索的内容。该研究时间为2017年11月—2018年3月。
1? 材料与方法
1.1? 实验材料
细胞系:293T,购自北纳细胞资源库;SOCS-1 siRNA:NCBI查找SOCS1基因序列,种属为人,设计siRNA,将siRNA序列在NCBI中的人源非冗余基因数据库进行Blast比对,排除对SOCS-1之外的基因有干扰的序列,再交由上海生工生物工程股份有限公司合成。
1.2? 试剂与仪器
鼠单克隆抗体GAPDH(中杉金桥, TA-08);兔多克隆抗体NF-KB(Bioss, bs-0465R);兔多克隆抗体(STAT3, Boster-A5511);羊抗鼠IgG (中杉金橋, ZB-2305);羊抗兔IgG(中杉金桥, ZB-2301);Annexin V-FITC/PI Apoptosis Kit(MULTI SCIENCES, AP101-100-kit);流式细胞仪(艾森生物, NovoCyte 2060R);Trizon Reagent(康为世纪, CW0580S);超纯RNA提取试剂盒(康为世纪,CW0581M);HiFiScript cDNA Kit(康为世纪, CW2569M);UltraSYBR Mixture(康为世纪, CW0957M);荧光PCR仪(伯乐生命医学产品(上海)有限公司, CFX ConnectTM) ;细胞裂解液(普利莱, C1053);PMSF(索莱宝, A1514061);超敏发光液(赛默飞, RJ239676);BSA(索莱宝, A8020);冷冻高速离心机(常州中捷实验仪器制造有限公司, TGL-16D);蛋白垂直电泳仪(北京市六一仪器厂, DYY-6C);超高灵敏度化学发光成像系统(伯乐生命医学产品(上海)有限公司, Chemi DocTM XRS+);紫外分光光度计(上海美谱达仪器有限公司, UV-1600PC型);BCA蛋白定量试剂盒(康为世纪, CW0014S);Acrylamide(Ultra Pure Grade, A8080);双丙烯酰胺(DAMAO);Tris(Solarbio, T8060);Marker(Thermo, #26617);PVDF膜(Millipore, IPVH 00010)。
1.3? 细胞培养与转染siRNA
细胞培养使用DMEM完全培养基,对照组的DMEM培养液中加入甘露醇,终浓度为30 mmol/L;高糖组的DMEM培养液中加入葡萄糖,终浓度为30 mmol/L,置于37 ℃,5% CO2培养箱中,当六孔板中细胞密度达90%时,准备转染,将DMEM完全培养基取出复温;取灭菌的EP管,每管加125 μL Opti-MEM,加入5 μL Lipofectamine;另取EP管,加入质粒混合液2.5 μg,加入5 uL的P3 000轻轻混匀后室温静置5 min;将上述两个EP管混匀,室温静置60 min,将混合液滴到六孔板中对应的孔内,将细胞放回培养箱培养48 h后用于检测。siRNA序列(5'-3'):SOCS1-siRNA-1的正义链:UCGCCCUUAGCGUGAAGAUTT,反义链:AUCUUCACG CUAAGGGCGATT;SOCS1-siRNA-2的正义链:GGUUG UUGUAGCAGCUUAATT,反义链:UUAAGCUACAACAA CAACCTT;SOCS1-siRNA-3的正义链:CCCAGUA UCUUUGCACAAATT,反义链UUUGUGCAAAGAUACU GGGTT。
1.4? 流式检测细胞凋亡
使用Apoptosis Positive Control Solution调整仪器参数。收集各组细胞用EP管分装好后向每管中加入1 mLPBS溶液2 000 rpm/2min,弃上清,重复3次。离心收集(1~5)×105个细胞。每个样对应用100 μL的5×Binding Buffer 稀释到1×作为工作液,取500 uL工作液重悬细胞。每管加入5 μL Annexin V-FITC 荧光染料和10 μL PI荧光染料。涡旋混匀后,室温避光孵育5 min。在流式细胞仪上,通过 FITC 检测通道检测Annexin V-FITC ,通过PE检测通道检测 PI。
1.5? Western Blot
取各组细胞,每组取约106个细胞,加入200~300 μL含PMSF的RIPA裂解液,放冰上裂解30 min后,收集到2 mLEP管中,超声波震荡5 min。之后于4 ℃,10 000 rpm/min离心10 min,吸取上清,即可获得总蛋白。根据BCA试剂盒测定蛋白样品浓度,取等量总蛋白上样进行SDS-PAGE电泳2 h,后湿法转PVDF膜50 min。使用脱脂牛奶封闭PVDF膜2 h,之后清洗PVDF膜;置PVDF膜于一抗溶液孵育,4 ℃过夜;清洗PVDF膜,置于二抗溶液中室温孵育2 h。在膜上滴加曝光液,在Chemi DocTM XRS+系统中成像拍照,分析各条带灰度值,目的条带和内参条带灰度值的比值为目的基因的相对表达量。
1.6? 荧光定量PCR
取各组细胞进行RNA提取,提取RNA后根据逆转录试剂盒合成cDNA,以cDNA为模板,以GAPDH为内参,进行荧光定量PCR,算出各组细胞中NF-kB、STAT3的相对表达量。引物信息:NF-KB F引物序列为ACCCACCCCACCATCAA,NF-KB R引物序列为CAGAGCCGCACAGCATT,这两者引物长度17bp,产物长度311bp,退火温度57.7 ℃。STAT3 F引物序列为ACCAAGCGAGGACTGAGCA,引物长度19bp,STAT3 R引物序列为CCAGACCCAGAAGGAGAAGC,引物长度20bp,这两个引物的产物长度都为147bp,退火温度60.5 ℃。GAPDH F引物序列为GAAGGTCGGAGTCAACGGAT,引物长度20bp,GAPDH R引物序列为CCTGGAAGATGGTGATGGG,引物长度19bp,这两个引物的产物长度为221bp,退火温度58.6 ℃。引物合成公司:通用生物系统(安徽)有限公司。
1.7? 统计方法
所有数据均用SPSS 19.0统计学软件处理,计量单位用(x±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2? 结果
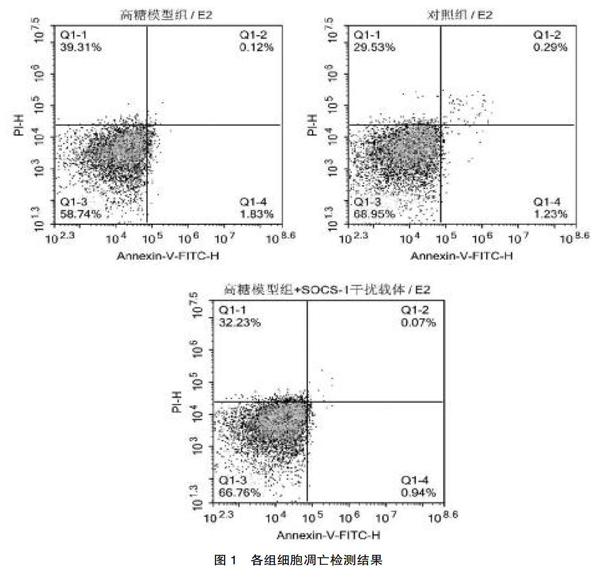
2.1? 各组细胞凋亡检测结果
高糖+SOCS-1干扰组细胞凋亡率(1.01%)低于对照组(1.52%),而对照组细胞凋亡率低于高糖组(1.95%)。差异有统计学意义(P<0.05)。见表1、图1。
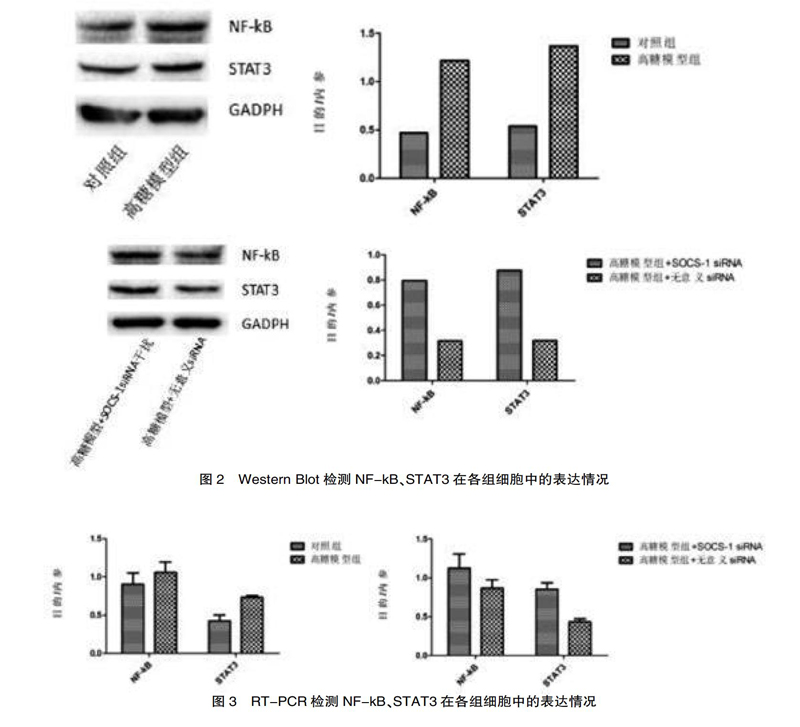
2.2? Western Blot檢测NF-kB、STAT3在各组细胞中的表达情况
结果以NF-kB、STAT3与内参蛋白表达条带的灰度值比表示。结果见图2,Western Blot检测显示NF-kB水平表达上调[(1.21±0.08)比(0.47±0.04),t=9.49,P<0.001];STAT3表达上调[(1.37±0.12)比(0.54±0.06),t=10.64,P<0.001];SOCS-1 siRNA干扰组相对于无意义siRNA组,NF-kB水平表达上调[(0.80±0.08)比(0.32±0.02),t=10,P<0.01]、STAT3表达上调[(0.87±0.10)vs(0.32±0.02),t=9.17,P<0.01]。各组之间的差异有统计学意义(P<0.01)。
2.3? RT-PCR检测NF-kB、STAT3在各组细胞中的表达情况
高糖模型组相对于对照组,NF-kB[(1.15±0.15) vs(0.80±0.16),t=2.9,P<0.05]、STAT3[(0.75±0.02) vs (0.46±0.09),t=5.686,P<0.01]表达上调;SOCS-1 siRNA干扰组相对于无意义siRNA组,NF-kB[(1.15±0.17) vs(0.80±0.09),t=3.18,P<0.05]、STAT3[(0.88±0.06) vs (0.40±0.01),t=13.7,P<0.01]表达上调。差异有统计学意义(P<0.05)。见图3。
3? 讨论
糖尿病肾病已成为导致终末期肾病的首位病因,发病率高且危害严重[4]。肾小球系膜细胞的过度增殖是导致糖尿病肾病肾间质纤维化及肾小球硬化的重要原因。其与多种因素有关,如葡萄糖代谢紊乱,细胞因子异常表达,炎症因子和氧化应激[5]。而其中炎症信号通路的激活扮演重要角色。现有许多研究显示,在糖尿病肾病的发病过程中JAK/STAT信号通路较为活跃,并发挥了重要作用。SOCS-1和SOCS-3在JAK/STAT通路中起着负调控因子的作用。SOCS-1能够调节多种生理过程。在多发性骨髓瘤中,SOCS-1的表达异常偏低,相应的JAK/STAT3通路持续活跃,助长了病症的恶化[6]。SOCS-1的过表达可以调节JAK/STAT信号通路的活性,降低了肾小管上皮细胞中TNF-α介导的氧化应激和凋亡[7]。此外还有研究报道,SOCS-1协同TRL家族参与对病毒的免疫反应,这又进一步加深了人们对SOCS-1的调控的重要性的认识[8]。
该实验建立了肾小球系膜细胞高糖模型,并检测了高糖培养条件下JAK/STAT信号通路中STAT3表达情况,发现高糖模型组相对对照组STAT3表达上调,凋亡率也略上调,而对JAK/STAT信号通路中负调控因子SOCS-1进行siRNA干扰后,其与无意义siRNA组比较,STAT3表达上调[(0.87±0.10) vs (0.32±O.02),P<0.01]。而凋亡率也有明显下降。这些结果说明高糖会促使肾小球系膜细胞JAK/STAT信号通路上调,而抑制这个通路的负调控因子SOCS-1后,此通路能进一步上调,并降低细胞凋亡率,最终促进血管内皮细胞增殖。而史永红等[9]应用脂质体2000分别转染pCR3.1-SOCS-1表达质粒和pCR3.1空质粒载体,与空载体对照组相比,SOCS-1过表达组系膜细胞STATI和STAT3的磷酸化水平显著下降(P<0.05);MCP-1 mRNA表达下调[(0.34+0.04)vs(0.42±0.05),P<0.05]。其与该实验正反两方面证实了SOCS-1对高糖诱导的肾小球系膜细胞JAK/STAT信号起负反馈的作用。近年来陆续有研究报道关于高糖环境中SOCS蛋白及信号通路对系膜细胞的影响。PI3K/STAT1/3信号通路介导高糖诱导的细胞外基质积聚和系膜细胞中SOCS-3的上调[10]。王晨等[11]以脂质体为载体将 PCR3.1 SOCS 3转染至体外培养的HMC,Western Blot检测高糖+SOCS3基因转染组比较高糖+空质粒转染组及对照组,STAT1蛋白酪氨酸磷酸化水平显著下降[(0.978±0.098)vs(0.645±0.067),P<0.05]。
核轉录因子KappaB(NF-κB)通路是炎症反应的中心环节,参与了糖尿病肾病的发病。体外试验也证实了高糖环境中NF-κB损伤肾小管上皮细胞[12]。NF-κB信号传导是复杂的, NF-κB的激活由磷酸化IκBα的多泛素化介导,然后是蛋白酶体降解[13-14]。其稳定性受多种蛋白质修饰的调节,包括磷酸化,泛素化和谷胱甘肽化,以及活性氧和氮的修饰。有学者研究巨噬细胞中一氧化氮合成酶1合成的NO导致SOCS1的蛋白水解,减轻其对NF-κB转录活性的抑制[15]。有报道SOCS2过表达可使高糖诱导下的足细胞中的TLR4/NF-κB途径失活[16]。但目前为止SOCS-1对高糖诱导下NF-κB作用的试验研究甚少,而该实验结果显示SOCS-1 siRNA干扰组相对于无意义siRNA组,NF-kB表达上调,提示SOCS-1可抑制高糖诱导下系膜细胞NF-κB的表达。其具体通过何种机制发挥作用有待进一步深入研究。
[参考文献]
[1]? Shuai K , Liu B . Regulation of JAK–STAT signalling in the immune system[J]. Nature Reviews Immunology, 2003, 3(11):900-911.
[2]? 糖基化终末产物(AGEs)诱导下SOCS基因在肾小管上皮细胞中的表达及意义[J].中国组织化学与细胞化学杂志, 2008, 17(1):56-60.
[3]? Kubo M , Hanada T ,Yoshimura A.Suppressors of cytokine signaling and immunity[J]. Nature Immunology, 2003, 4(12):1169-1176.
[4]? Chokhandre M K, Mahmoud M I, Hakami T, et al.Vitamin D & its analogues in type 2 diabetic nephropathy: a systematic review[J].Journal of Diabetes & Metabolic Disorders, 2015, 14(1):58.
[5]? An Y , Xu F , Le W , et al. Renal histologic changes and the outcome in patients with diabetic nephropathy[J]. Nephrology Dialysis Transplantation, 2015,30(2):257-266.
[6]? Beldiferchiou A , Skouri N , Ali C B , et al. Abnormal repression of SHP-1, SHP-2 and SOCS-1 transcription sustains the activation of the JAK/STAT3 pathway and the progression of the disease in multiple myeloma[J].Plos One, 2017, 12(4):e0174835.
[7]? Du CY,Yao F,Ren YZ, et al.SOCS-1 is involved in TNF-α-induced mitochondrial dysfunction and apoptosis in renal tubular epithelial cells[J].Tissue and Cell.2017,49(5):537-544
[8]? Paul A M , Acharya D , Le L, et al. TLR8 Couples SOCS-1 and Restrains TLR7-Mediated Antiviral Immunity, Exacerbating West Nile Virus Infection in Mice[J].The Journal of Immunology, 2016, 197(11):4425.
[9]? 史永红,杜春阳,任韫卓,等.细胞因子信号传导抑制蛋白1抑制高糖诱导的肾小球系膜细胞单核细胞趋化蛋白1的表达[J].中华肾脏病杂志,2010,26(5):352-357.
[10]? Sheu M L , Shen C C , Jheng J R , et al. Activation of PI3K in response to high glucose leads to regulation of SOCS-3 and STAT1/3 signals and induction of glomerular mesangial extracellular matrix formation[J].Oncotarget, 2017, 8(10):16925-16938.
[11]? 王晨,魏荣,张晓琴,等.细胞因子信号负调控因子3基因转染对高糖刺激下肾小球系膜细胞增殖和凋亡的影响[J].中国药物与临床,2015(5):568-571.
[12]? Zhou L, Xu D , Sha W , et al. High glucose induces renal tubular epithelial injury via Sirt1/NF-kappaB/microR-29/Keap1 signal pathway[J].Journal of Translational Medicine, 2015, 13(1):352.
[13]? Won M , Byun H S , Park K A ,et al. Post-translational control of NF-κB signaling by ubiquitination[J]. Archives of Pharmacal Research,2016,39(8):1075-1084.
[14]? Ikeda, Fumiyo. Linear ubiquitination signals in adaptive immune responses[J]. Immunological Reviews, 2015,266(1):222-236.
[15]? Baig M S ,Zaichick S V ,Mao M , et al.NOS1-derived nitric oxide promotes NF-κB transcriptional activity through inhibition of suppressor of cytokinesignaling-1[J]. Journal of Experimental Medicine,2015,212(10):1725-38.
[16]? Yang S X,Zhang J,Wang S Y, et al.SOCS2 overexpression alleviates diabetic nephropathy in rats by inhibiting the TLR4/NF-κB pathway[J].Oncotarget,2017,8(53): 91185–91198.
- 浅谈中等职业学校校本教材开发与实践
- 技工院校特色专业建设实践和思考
- 浅议开放教育课堂导学与信息技术整合的有效性
- 探析计算机专业实践教学的重要性
- 中职数学实践教学与“双创”教育融合的研究
- 怎样加强中职语文教学中的情感教育
- 浅析技工院校法律教学有效性提升策略
- 提高万能角度尺检测精度的创新方法
- 基于物联网技术的智能物流仓储实验系统开发研究
- 中职电子电工专业教学的创新路径探讨
- 中职计算机专业课教学考评模式的创新
- 基于餐饮转型形势下的烹饪原料学课程教学改革
- 技工院校汽车维修专业教学方法改革策略探究
- 技工学校机械制造工艺基础课程教学改革探微
- “理实一体化”课程教学模式改革探讨
- “互联网+”对技工院校教学改革的影响
- 影视后期制作课程教学的改革与实践
- 对中职卫校教育教学管理改革的分析探讨
- 关于建筑识图与构造课程教学改革的思考
- 基于能力培养的中职体育课程结构改革探讨
- 关于技师学院篮球教学改革的设想与思路探析
- “中国制造2025”背景下中职院校发展面临的困境及改革策略
- 浅谈技工院校数学教学改革
- 基于培养学生素质和能力的高职数学教学改革
- 基于实用性和创新性的中职数学教学改革探析
- rainbowy
- rain-cats-and-dogs
- raincheck
- rain check
- rainchecks
- rain checks
- rain chex
- raincoat
- raincoated
- raincoats
- rain down
- raindrop
- raindrops
- rained
- rainer
- rainfall
- rainfalls
- rain forest
- rainforest
- rainforests
- rainful
- rainier
- rainiest
- raininesses
- raining
- 无求到处人情好,不饮从他酒价高
- 无求到处人情好,不饮恁他酒价高
- 无求生以害仁,有杀身以成仁
- 无油难脱锅
- 无治
- 无法
- 无法一一罗列
- 无法一一详述
- 无法下口
- 无法下嘴
- 无法下手
- 无法下爪
- 无法使
- 无法再活下去
- 无法割裂或阻断
- 无法办到
- 无法办成的事
- 无法去除的弊端或祸患
- 无法发表意见
- 无法可使
- 无法可想
- 无法可施
- 无法可治
- 无法和解的仇恨
- 无法度