于丽侠 李明晖 阮永春

[摘要] 目的 分析免疫缺陷宿主合并隐球菌脑膜炎(CM)的临床特征,以期提高临床医师对本病的诊治水平。 方法 回顾性分析2005年1月至2018年6月我院收治的78例隐球菌脑膜炎患者,依据患者是否存在免疫缺陷分为免疫缺陷宿主合并隐球菌脑膜炎组(ICH-CM组)和非免疫缺陷宿主合并隐球菌脑膜炎组(NON-ICH-CM组),主要观察两组患者的临床表现、影像学改变、脑脊液隐球菌荚膜抗原的差异,并观察血液和脑脊液隐球菌荚膜抗原滴度对隐球菌脑膜炎的评估价值。其中ICH-CM组患者61例,NON-ICH-CM组17例,记录两组患者的基础疾病及激素、免疫抑制剂使用情况和既往或同时存在颅内病变的情况。结果 ICH组与NON-ICH组在临床表现上比较,差异无统计学意义(P>0.05),影像学缺乏典型的表现,两组均可表现为脑膜强化、脑梗死、多发缺血灶,但差异无统计学意义(P>0.05),且脑脊液的隐球菌荚膜抗原滴度为(977.06±799.12),高于血的(498.13±463.71),差异有统计学意义(P<0.05)。ICH-CM组死亡20例(32.78%),NON-ICH-CM组死亡1例(5.88%),两组患者的死亡率比较,差异无统计学意义(P>0.05)。 结论 免疫受损宿主容易合并各种感染,其中隐球菌性脑膜炎发病较隐匿,缺乏特征性,尤其是长期接受激素或免疫抑制剂的患者,早期诊断、及时治疗对预后影响很大。
[关键詞] 隐球菌性脑膜炎;免疫受损宿主;非免疫缺陷宿主;隐球菌荚膜抗原
[Abstract] Objective To analyze the clinical features of immunodeficiency host with cryptoococcal meningitis(CM) in order to improve clinicians′ diagnosis and treatment of this disease. Methods A total of 78 patients with cryptococcal meningitis treated in our hospital from January 2005 to June 2018 were retrospectively analyzed. They were divided into immunocompromised host(ICH) and non-immunocompromised host(NON-ICH), depending on whether the patient had an immune deficiency. The differences in clinical manifestations, imaging changes, and cerebrospinal fluid cryptococcal capsular antigen between the two groups were observed. And the value of blood and cerebrospinal fluid cryptococcus capsular antigen titers in the evaluation of cryptococcal meningitis was observed. Among them, there were 61 ICH patients and 17 NON-ICH patients. The underlying diseases, hormones, immunosuppressive agents, and previous or concurrent intracranial lesions were recorded. Results There were no significant differences in clinical manifestations between the ICH-CM group and the NON-ICH-CM group(P>0.05), and the imaging lacked typical manifestations. Both groups showed meningeal enhancement, cerebral infarction, and ischemic changes, but there were no statistically significant differences between two groups(P>0.05). And the CSF cryptococcus capsular antigen titer(977.06±799.12) was higher than blood cryptococcus capsular antigen titer(498.13±463.71), with significant difference(P<0.05). Twenty patients died in the ICH-CM group(32.78%), and one patient died in the NON-ICH-CM group(5.88%). The mortality rate was high in the two groups, with no significant difference(P>0.05). Conclusion Immunocompromised hosts are susceptible to various infections. Among them, cryptococcal meningitis has relatively insidious disease and lacks characteristics. Especially for patients who have been receiving hormones or immunosuppressants for a long time, early diagnosis and timely treatment have a great impact on the prognosis.
[Key words] Cryptococcal meningitis; Immunocompromised host; Non-immunocompromised host; Cryptococcus capsular antigen
免疫受损宿主(Immunocompromised host,ICH)是指因有程度不同的非特异性(皮肤、黏膜、补体、吞噬细胞、细胞因子)和(或)特异性(细胞、体液)免疫缺陷而容易发生感染的人。先天性免疫缺陷宿主相对少见,临床常见的是获得性免疫受损宿主[1]。基础疾病的存在、进展及医源性因素是造成人体非特异性和(或)特异性免疫功能受损的重要原因。近年来随着化学治疗、脏器和骨髓移植、免疫抑制、生物制剂和介入治疗等各种医疗技术的进步和发展,很多不治或难治之症得到有效治疗,如白血病、淋巴瘤、多发性骨髓瘤、脏器肿瘤转移等,免疫受损宿主继发机会性感染是必然的临床现象[2],真菌感染在临床中也逐渐增多,尤其是隐球菌感染已成为一种世界范围内的常见真菌感染。
每年新发隐球菌性脑膜炎病例高达100万,虽然抗隐球菌药物的获取较过去增多,但死亡率仍较高[3]。有文献报道,未经治疗的隐球菌性脑膜炎患者入院2周内死亡率接近100%。免疫受损宿主容易感染,但有文献报道肺部隐球菌病患者,以无明确免疫功能低下者患病为多[4]。目前,隐球菌性脑膜炎在我国并不少见,由于临床特征不典型,部分临床医生对该病缺乏足够认识,该病误诊率较高。本研究搜集了61例免疫受损宿主与17例非免疫受损宿主合并隐球菌性脑膜炎感染病例,并进行分析,以期提高对其认识,现报道如下。
1 资料与方法
1.1 一般资料
通过回顾性检索病历资料,纳入2005年1月至2018年6月在我院就诊且最终确诊为隐球菌性脑膜炎的病例。纳入标准:根据2018年中华医学会制定的《隐球菌性脑膜炎诊治专家共识》[5];排除标准:①病历资料不完整者;②既往已确诊隐球菌性脑膜炎,本次入院为复查或巩固性治疗者。通过上述纳入排除标准,最后共纳入78例患者,将其分为免疫缺陷合并隐球菌性脑膜炎组(Immunocompromised host,cryptococcal meningitis,ICH-CM,以下简称ICH-CM组)(n=61)和非免疫缺陷合并隐球菌性脑膜炎组(Non immunocompromised host,cryptococcal meningitis,NON-ICH-CM,以下简称NON-ICH-CM组)(n=17)。两组患者年龄、性别、常见的临床症状(发热伴头痛、头痛、发热、精神异常及视力异常)等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
1.2 诊断标准
①脑脊液真菌培养隐球菌阳性,或脑脊液墨汁染色结果阳性;②脑组织病理查见隐球菌;③临床症状支持脑膜炎诊断(临床症状包括脑部症状、脑膜刺激征,脑脊液常规、生化检查异常),脑脊液涂片和培养阴性,但隐球菌抗原检测阳性者。
1.3 方法
1.3.1 脑脊液检测? 患者入院后抽取3管脑脊液,第1管进行生化检验和真菌培养,第2管进行细胞学检验和墨汁染色,第3管进行隐球菌抗原乳胶凝集实验。隐球菌检测采用墨汁染色、真菌培养和乳胶凝集实验。墨汁染色采用印度墨汁或国产优质墨汁,脑脊液真菌培养采用美国BD公司的BACTEC FX全自动血培养系统,通过肉汤增菌培养法培养,对于培养阳性的标本,用沙保弱培养基(法国生物梅里埃公司)分离获得隐球菌。隐球菌的菌种鉴定采用法国生物梅里埃公司的VITEK MS 质谱仪进行;隐球菌的药敏试验(微量肉汤稀释法)采用法国生物梅里埃公司ATBFUNGUS 真菌药敏板条进行,质控菌株为白色假丝酵母ATCC 14053。药敏结果判读标准为美国临床实验室标准化研究所(CLSI)颁布的M27-A 标准。隐球菌抗原检测采用胶体金方法检测(杭州千麦医学检验所有限公司)。
1.3.2 影像学方法? 所有患者均行头颅CT和MRI检查,肺部采用CT检查,脊柱采用MRI检查。CT检查采用飞利浦64 层或西门子128 层螺旋CT 扫描。扫描参数:120 kVp,50~160 mAs,层厚5 mm。经肘前静脉注入非离子碘对比剂,剂量为1.5 mL/kg,注射流率为3.0 mL/s,完成动脉期、静脉期、延迟期扫描,扫描时间分别为25、60、180 s。MRI检查使用我院GE 3.0 T超导磁共振机器进行检测,采用序列为矢状位加权成像(Transverse 1 weighted imaging,T1WI)、横断位加权成像(Transverse 2 weighted imaging,T2WI)、横断位液体衰减反转恢复序列(Fluid- attenuated inversion recovery,FLAIR)、弥散加权成像(Diffusion weighted imaging,DWI),使用矢状位T1加权成像增强扫描,对比剂为钆喷酸葡胺注射液。重点观察指标为:①异常信号分布情况;②病变特征:脑血管间隙(Cerebrovascular VR)扩大、肉芽肿形成、胶样假性囊肿、粟粒样结节或斑片樣信号;③异常信号特征。
1.4 观察指标
回顾性分析入选病例的流行病学资料(包括基础免疫功能受损情况、既往颅内病变情况、同时合并的颅内病变情况)、起病情况、临床症状、脑脊液常规、生化、涂片、培养和荚膜抗原检测(包括血)结果;血液或组织培养结果、相关的影像学变化、治疗方案和临床转归,后期通过门诊或电话随访获得随访数据。
1.5临床转归评价标准
①治愈:临床症状完全消失,脑脊液常规和生化指标正常,连续3次采集脑脊液进行墨汁染色及真菌培养均为阴性;②好转:临床症状明显缓解,但尚未消失,脑脊液常规和生化检测指标时有波动,脑脊液墨汁染色显示隐球菌计数减少;③死亡[6]。
1.6 统计学方法
采用SPSS 22.0统计学软件完成统计分析,数据录入由两人独立完成,两组患者的临床表现、影像学表现及预后情况等计数资料的分析采用χ2检验,脑脊液和血隐球菌荚膜抗原的定量分析采用近似t检验,P<0.05為差异有统计学意义。
2 结果
2.1 两组一般资料的比较
78例确诊隐球菌性脑膜炎患者(6例合并肺部隐球菌感染,5例合并血流感染,1例合并脊柱隐球菌感染)。ICH-CM组的平均年龄(38.93±19.69)岁,NON-ICH-CM组的平均年龄(41.41±22.38)岁,差异均无统计学意义(P>0.05),ICH-CM组男30例,女31例,NON-ICH-CM组男6例,女11例,差异均无统计学意义(P>0.05)。隐球菌性脑膜炎缺乏典型的临床表现,49例患者就诊时主要的症状是发热伴头痛,14例患者主诉为头痛,10例患者仅以发热起病,全部表现为38.5℃以上的高热,最高达40.0℃;2例患者以精神异常起病,3例患者因视力异常起病,部分患者查体可见脑膜刺激征阳性。两组患者在临床表现上均无特异性,最常见的临床症状均为发热伴头痛,组间比较差异无统计学意义(P>0.05),其次为头痛、发热、精神异常及视力异常,组间比较差异均无统计学意义(P>0.05)。见表1。
2.2基础疾病导致的免疫功能受损情况
17例(21.79%)免疫功能正常,61例(78.21%)存在基础疾病导致的免疫功能受损。其中风湿及自身免疫性疾病23例[其中系统性红斑狼疮(Systemic lupus erythematosus,SLE)18例],糖尿病伴靶器官受损4例,血液系统疾病8例,肾脏疾病6例(其中肾脏移植术后1例),肝脏疾病8例,肺部疾病3例(其中活动肺结核1例),其他9例(其中孕妇伴CD4细胞下降1例,HIV 5例,低丙种球蛋白血症1例),以上患者中,长期使用激素25例,长期使用免疫抑制剂5例。见表2。
2.3既往或同时存在颅内疾病
13例患者既往或同时存在颅内疾病,病毒性脑膜炎1例,奴卡菌脑膜炎1例,脑积水1例,脑脓肿1例,脑膜瘤手术1例,化脓性脑膜炎4例,结核性脑膜炎4例;8例患者中合并化脓性脑膜炎6例,合并结核性脑膜炎2例。见表3。
2.4实验室和免疫检查
78例患者均诊断明确,其中仅脑脊液涂片见隐球菌3例,仅脑脊液培养隐球菌阳性20例,血培养隐球菌阳性5例,血和脑脊液培养隐球菌同时阳性3例;乳胶凝集实验定性阳性或定量比值大于1∶8为诊断依据,23例患者脑脊液涂片或培养阳性且乳胶凝集实验阳性,1例患者肺穿刺活检、脑脊液涂片及脑脊液培养均为阳性。见表4。其中29例患者同时行血和脑脊液乳胶凝集定量实验,脑脊液中的乳胶凝集定量滴度比值为(977.06±799.12),明显高于血中的(498.13±463.71),差异有统计学意义(t=2.792,P<0.05)。
2.5 两组影像学表现比较
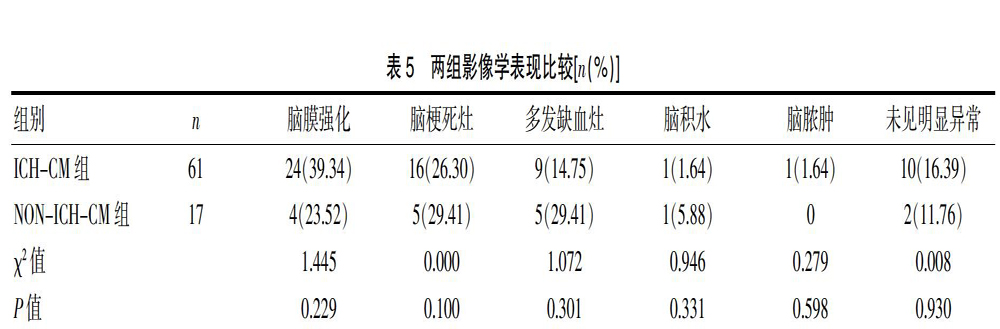
ICH-CM组和NON-ICH-CM组影像学表现为脑梗死分别为16例和5例,组间比较差异无统计学意义(P>0.05),ICH-CM组和NON-ICH-CM组影像学表现为脑膜强化分别为24例和4例,组间比较差异无统计学意义(P>0.05),影像学亦可以表现为多发缺血灶、脑积水、脑脓肿,但组间比较差异均无统计学意义(P>0.05),部分患者影像学无异常改变。见表5。6例合并肺部隐球菌感染的患者,2例表现为多发肿块,早期怀疑肺癌,行肺穿刺术病理确诊为新型隐球菌,1例表现为双肺大片实变,因患者既往有肺结核病史,早期高度怀疑为结核复发,1例表现为多发结节,因患者既往有前列腺癌病史,早期怀疑转移癌,2例表现为单发结节,6例合并肺部病变患者经过治疗肺部病变均较前明显缩小。
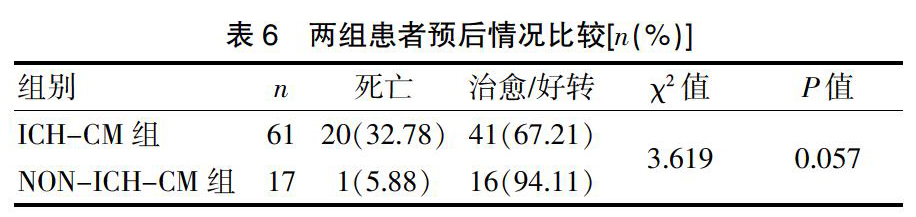
2.6 治疗及预后
78例隐球菌性脑膜炎患者中,6例患者因诊治延迟或放弃治疗全部死亡,其余71例患者接受不同药物治疗,强化治疗期给予两性霉素B或两性霉素B脂质体联合氟胞嘧啶、氟康唑联合或不联合两性霉素B或其脂质体,维持期给予氟康唑治疗,随后对以上患者进行随访(12~96 个月,中位数 54 个月)。ICH-CM组死亡20例,NON-ICH-CM组死亡1例,两组患者的死亡率均较高,但差异无统计学意义(P>0.05)。见表6。
3 讨论
隐球菌性脑膜炎是一种机会性感染,在全球均有报道,属散发病,一些专家推测,隐球菌的传播可能与气候变化、国际旅行等有关[7]。虽然原发性隐球菌感染开始于肺部,但隐球菌很容易潜伏地传播到中枢神经系统,脑膜炎是目前最常见的临床表现,虽然很少或没有局部肺部感染的临床证据,且播散性疾病几乎可影响任何器官,但脑膜炎是最常见的疾病。新型隐球菌对神经趋向性的基础尚不清楚,可能是为了逃避宿主的防御,也有报道称新型隐球菌对中枢神经系统的偏爱可能与脑组织中儿茶酚胺含量高,富含苯酚氧化酶的底物有关。荚膜多糖具有增强感染、抑制炎症、抑制吞噬、抑制体液免疫和细胞免疫的作用。隐球菌病是世界上最常见的机会性侵袭性真菌病之一[8],多见于细胞免疫异常和T细胞亚群缺陷者,在艾滋病患者中负担最重,特别是在撒哈拉以南非洲地区。隐球菌性脑膜炎占艾滋病相关死亡率的15%。有研究对艾滋病患者隐球菌病的尸检结果进行评估,发现平均每例患者涉及3.8个器官。除中枢神经系统外,肺、淋巴结、肾、肝、脾、肾上腺等器官更常受累,本研究中有6例患者同时累及肺部,5例患者同时累及血流,1例患者累及脊柱。
获得性免疫缺陷日益增多[9],主要是指实体器官移植者、骨髓移植受体、由于自身免疫和风湿免疫疾病接受免疫抑制治疗的患者,包括脾切除、烧伤、糖尿病、长期服用类固醇、慢性肾功能衰竭、库欣氏综合征和免疫衰老的老年人,以及免疫防御病原菌的物理屏障(黏液、纤毛组合、咳嗽反射、喷嚏反射)被破坏(如体内长期留置导管、气管插管、气管切开、咳嗽反射消失)。近年来,隐球菌病的发病率在细胞介导免疫功能低下的患者中呈上升趋势。对于隐球菌性脑膜炎免疫损害的定义可能更广泛,包括隐球菌中枢神经系统侵袭的高危人群、任何需要皮质类固醇治疗者、所有的移植受者、淋巴网状肿瘤者、胶原血管疾病、结节病、糖尿病、与T细胞衰竭相关的细胞介导免疫缺陷,与非-HIV相关的、与HIV-AIDS相关的免疫抑制[10]。何杰金氏病和隐球菌病之间的关系至今已有50多年的历史。流行病学研究表明,侵袭性隐球菌病在恶性肿瘤中发病率最高,按下降顺序依次为慢性淋巴白血病、霍奇金淋巴瘤、慢性粒细胞白血病和多发性骨髓瘤[11]。本研究中共61例患者存在免疫缺陷,其中23例患者存在风湿及自身免疫性疾病(其中SLE 18例),糖尿病伴靶器官受损4例、血液系统疾病8例、肾脏疾病6例(其中肾脏移植术后1例),肝脏疾病8例,肺部疾病3例(其中活动肺结核1例),其他9例,这些患者中25例患者为长期或间断使用激素,5例为长期使用免疫抑制剂的患者。隐球菌性脑膜炎可以发生在免疫抑制人群,也可以发生在非免疫抑制人群,其可能独立发生,也可能与其他机会性感染有关。有研究报道近20%的隐球菌病发生于免疫功能正常的患者[12],本研究中17例(21.79%)患者未见明显的免疫功能异常与其研究结果一致。本研究艾滋病患者所占的比例较低,仅有5例,且确诊后很快死亡。这可能与本院传染病专科医院有关。
隐球菌性脑膜炎可发生于任何年龄组,多见20~50岁,本研究中中位年龄为34岁,与报道一致[13],男女之间无明显差异。该病在世界各地均有发生,呈散发性分布。隐球菌性脑膜炎多以亚急性或慢性起病,但偶尔可能是暴发性的。发热伴头痛是最常见的临床表现[14],其次是头痛、发热最常见,临床表现复杂,极易误诊为结核性脑膜炎[15]、病毒性脑膜炎和断头化脑等,尤其对于免疫缺陷人群,症状改变可能更隐蔽。本研究中最常见的临床症状是发热伴头痛,但组间比较差异无统计学意义(P>0.05),其次是头痛、发热、视力异常、精神异常,但组间比较差异无统计学意义(P>0.05)。本研究中有13例患者既往曾有颅内病变,其中既往病毒性脑膜炎、化脓性脑膜炎或结核性脑膜炎、脑积水甚至脑脓肿很容易误诊为原发病的急性加重或复发[16],故早期鉴别诊断及治疗效果差的患者需考虑合并感染的可能性。临床对失能性头痛、进行性视力丧失及相关乳头水肿的患者,应尽早完善腰椎穿刺、乳胶凝集实验、影像学等检查以明确诊断,及时治疗极为重要,对于治疗效果不佳的患者更应注意鉴别诊断。对于各种脑神经麻痹、耳聋以及意识水平下降、存在颅内高压症状的患者要引起注意。隐球菌性脑膜炎中颅内压升高是常见表现[17],高颅内压可导致脑循环受损,引起患者早期死亡及视力丧失。早期很容易误诊和漏诊,尤其是合并结核性脑膜炎、化脓性脑膜炎的患者诊断更加困难。有文献报道,结核是隐球菌性脑膜炎合并HIV感染患者最常见的伴生或相关疾病[18]。因隐球菌颅内感染可同时影响蛛网膜下腔和脑实质,但因免疫抑制程度不同,脑脊液异常可能是微妙的,诊断时脑脊液炎症少、真菌负担大,但有时脑脊液涂片也能出现漏诊,需要多次行涂片、培养、乳胶凝集实验或针对隐球菌抗原的侧流分析。血和脑脊液乳胶凝集实验均可作为诊断的标准,并可以作为评价病情变化的重要依据[19],本研究结果显示,血和脑脊液隐球菌荚膜抗原滴度在隐球菌性脑膜炎患者中明显升高,且脑脊液较血更敏感(P<0.05)。
隐球菌比较容易侵袭的部位是小脑背部和大脑底部,菌落的聚集致使检查中发现脑膜变厚、血管周围间隙扩大,在基底节等部位容易形成胶状假囊;MRI 检查存在优势,有研究报道[20]常见的影像改变为脑实质发现呈长T1长T2 信号的圆形或类圆形肿块;血管周围间隙扩大,部分伴有脑室扩大、脑积水现象。而在CT 检查中主要表现为脑积水[21],少数表现为多发性低密度灶、脑萎缩等。但影像学检查缺乏特异性,容易导致诊断和最终治疗的延迟。本研究中发现常见的影像学表现分别为脑膜强化、脑梗死、多发缺血灶、脑积水、脑脓肿,但在免疫缺陷人群和非免疫缺陷人群之间组间比较差异无统计学意义(P>0.05),部分患者影像学无异常改变。6例合并肺部隐球菌感染的患者,2例表现为多发肿块,早期怀疑肺癌,行肺穿刺术病理确诊为新型隐球菌,1例表现为双肺大片实变,因患者既往有肺结核病史,早期高度怀疑为结核复发,1例表现为多发结节,因患者既往有前列腺癌病史,早期怀疑转移癌,2例表现为单发结节,6例合并肺部病变患者经过治疗肺部病变均较前明显缩小。
隐球菌性脑膜炎在现代医学仍是一种致死性的疾病,特别是当涉及脑积水和失明的风险时,必须完成对复杂疾病形式的早期积极管理和早期识别。治疗隐球菌性脑膜炎的药物方法受到毒性、供货限制和耐药性出现的限制,治疗反应较差[22]。在接受抗真菌治疗后,约有10%的患者因对类固醇有反应的免疫重建炎症综合征而病情恶化。本研究78例隐球菌性脑膜炎患者中,71例患者接受药物治疗,41例强化治疗期给予两性霉素B或两性霉素B脂质体联合氟胞嘧啶,部分患者因肾功能恶化,而改为氟康唑治疗,6例患者死于严重的脏器衰竭。两组患者的死亡率均较高,但差异无统计学意义(P>0.05),可能与本研究中患者数量相对较少,且与患者的免疫受损情况及治疗时机有关。6例患者因诊治延迟或放弃治疗全部死亡,故早期诊断及治疗极为重要。隐球菌性脑膜炎维持治疗的时间尚不确定,艾滋病患者的维持治疗时间可能是终生的,而其他免疫缺陷患者的维持治疗时间尚未明确,可能较短(如6个月),抗隐球菌治疗的同时积极治疗原发病对免疫缺陷人群是至關重要的,定期对免疫状况进行评估亦可以指导临床方案。
[参考文献]
[1] Onke N,Colleen A,Douglas W. Diagnostic and mortality outcomes in a cohort of adult meningitis suspects in KwaZulu-Natal[J].Southern African Journal of Infectious Diseases,2018,33(1):8-11.
[2] Haraga J,LeBlanc M,Chiovaro J.Not all it′s cr aged up to be:Disseminated cryptococcosis[J].Am J Med,2018, 131(12):1452-1455.
[3] Torres RG,Etchebehere RM,Adad SJ,et al.Cryptococcosis in acquired immunodeficiency syndrome patients clinically confirmed and/or diagnosed atnecropsy in a teaching hospital in Brazil[J].Am J Trop Med Hyg,2016,95(4):781-785.
[4] Neal Lori M,Xing Enze,Xu Jintao,et al.A.CD4+T cells orchestrate lethal immune pathology despite fungal clearance during cryptococcus neoformans meningoencephalitis[J].mBio,2017,8(6):e01 415-e01 417.
[5] 劉正印,王贵强,朱利平,等.隐球菌性脑膜炎诊治专家共识[J].中华内科杂志,2018,57(5):317-323.
[6] 游洋伟.22 例隐球菌脑膜炎患儿的临床特征和抗生素敏感性分析[J].中国人兽共患病学报,2019,11(22):1-5.
[7] Jose O,Christa B,Dalia M,et al.Massive cerebral edema resulting in brain death as a complication of cryptococcus neoformans meningitis[J].Journal of Community Hospital Internal Medicine Perspectives,2015,5(1):26 098-26 103.
[8] Sawai T,Nakao T,Koga S,et al.Miliary tuberculosis with co-existing pulmonary cryptococcosis in non-HIV patient without underlying diseases:A case report[J].Bmc Pulmonary Medicine,2018,18(1):6.
[9] Smith N,Sehring M,Chambers J,et al.Perspectives on non-neoformans cryptococcal opportunistic infections[J].Journal of Community Hospital Internal Medicine Perspectives,2017,7(4):214-217.
[10] Raheja H,Sinha A,Irukulla PK,et al.Cryptococcal meningitis masquerading as normal pressure hydrocephalus in an immune-competent adult[J].Journal of Global Infectious Diseases,2017,9(4):157-159.
[11] Huong NTC,Altibi AMA,Hoa NM,et al.Progressive cutaneous cryptococcosis complicated with meningitis in a myasthenia gravis patient on long-term immunosuppressive therapy:A case report[J].Bmc Infectious Diseases,2017,17(1):311.
[12] Geddesmcalister J,Shapiro RS.New pathogens,new tricks:Emerging,drug-resistant fungal pathogens and future prospects for antifungal therapeutics[J].Annals of the New York Academy of Sciences,2018,1435(1):57-78.
[13] George IA,Santos C,Powderly WG,et al.Epidemiology of cryptococcosis and cryptococcal meningitis in a large retrospective cohort of patients following solid organ transplantation[J].Open Forum Infectious Diseases,2017, 4(1):ofx004.
[14] Xu L,Zhang X,Guo Y,et al.Unique clinical features of cryptococcal meningitis among Chinese patients without predisposing diseases against patients with predisposing diseases[J].Med Mycol,2019,57(8):944-953.
[15] Li M,Chen Z,Xu L,et al.A comparison of the clinical characteristics and outcomes of cryptococcal meningitis in HIV-negative individuals with and without immunosuppression[J].Neurologist,2019,24(1):1-5.
[16] Nyazika TK,Kamtchum TJ,Alain KF,et al.Epidemiology and aetiologies of cryptococcal meningitis in Africa,1950-2017:Protocol for a systematic review[J].BMJ Open,2018, 8(7):e020 654-e020 658.
[17] Williamson PR.The relentless march of cryptococcal meningitis[J].Lancet Infectious Diseases,2017,17(8):790-791.
[18] Li XQ,Xia S,Ji JS,et al.Comparison and correlation of magnetic resonance imaging and clinical severity in nonhuman immunodeficiency virus patients with cryptococcal infection of central nervous system[J].Chin Med J(Engl),2018,131(24):2930-2937.
[19] Syazana I,Hing EY.Cryptococcal meningitis:Imaging findings in an immunocompetent patient[J].Journal of Clinical and Diagnostic Research,2018,12(7):TD01-TD02.
[20] Wake RM,Britz E,Sriruttan C,et al.High cryptococcal antigen titers in blood are predictive of subclinical cryptococcal meningitis among HIV-infected patients[J].Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America,2018,66(5):686.
[21] Lawrence DS,Youssouf N,Molloy SF,et al.Correction to:AMBIsome therapy induction optimisatioN (AMBITION):High dose AmBisome for cryptococcal meningitis induction therapy in sub-Saharan Africa:Study protocol for a phase 3 randomised controlled non-inferiority trial[J].Trials,2019,20(1):48.
[22] Henaomartínez AF,Chastain DB,Francoparedes C.Treatment of cryptococcosis in non-HIV immunocompromised patients[J].Current Opinion in Infectious Diseases,2018, 31(4):1.
(收稿日期:2019-12-03)
- 训练口语能力,培养初中英语核心素养
- 在初中英语故事阅读教学中培养学生思维品质的实践探索
- 初中语文提高学生课堂参与度的教学指导策略
- 课本剧编演对提升初中生语文核心素养的实践探究
- 初中语文阅读教学对培养学生核心素养的影响及对策分析
- 浅析提高初中体育课堂教学有效性的途径
- 初中美术教学的有效性探究
- 基于细微之处实现初中化学有效施教
- 刍议九年级化学高效教学路径
- 基于核心素养下的初中生物实验优化教学
- 初中物理有效教学的研究
- 探究以生活化教学模式提高初中物理教学的有效性
- 新课改下构建初中物理有效性课堂教学模式的策略
- 浅谈提高初中数学课堂教学效率的策略
- 探究生活 提高初中数学课堂教学的有效性
- 初中数学高效课堂教学方法初探
- 新课程理念下初中数学高效课堂构建分析
- 实施课堂讨论,提高课堂教学质量
- 新课程理念下如何构建初中数学高效课堂
- 初中数学高效课堂模式的探索
- 初中历史优化课堂情境的教学策略
- 论如何打造初中历史高效课堂
- 新课程理念下中学地理课堂教学的有效性初探
- 论初中道德与法治高效课堂的构建
- 浅析如何提高城乡结合初中文本解读的策略
- personalcare
- personal care
- personalcheque
- personal cheque
- personal column
- personal computer
- personal computers
- per-sonal computers
- personal contract
- personalcontract
- personal credit
- personalcredit
- personal day
- personalday
- personaldevelopment
- personal development
- personalexemption
- personal exemption
- personal finance
- personalfinance
- personal identification number
- personal information manager
- personalinformationmanager
- personal injury
- personalinjury
- 解割
- 解劝
- 解劲
- 解劳
- 解包袱
- 解化
- 解印
- 解印绶
- 解危
- 解卷
- 解卸
- 解去捆缚
- 解发
- 解发佯狂
- 解吸
- 解和
- 解喻
- 解嘲
- 解囊
- 解囊乐助
- 解囊倡助
- 解囊分润
- 解囊唱助
- 解囊相助
- 解囊赠送