陈敏氡 王彬 刘建汀 叶新如 曾美娟 朱海生 温庆放 康玉妹

摘要?[目的]通过CRISPR/Cas9系统构建丝瓜LcPPO1基因编辑载体。[方法]根据前期已经克隆得到的LcPPO1基因序列,设计2个sgRNA靶位点序列,退火制备sgRNA双链,分别与线性PCA1301-Cas9载体连接获得2个重组载体,将重组载体转化DH5α感受态细胞,再对其进行PCR鉴定及测序比对分析。[结果]2个sgRNA靶位点序列已经分别准确地连入PCA1301-Cas9载体,插入序列无突变。[结论]成功构建了丝瓜LcPPO1基因编辑载体PCA1301-Cas9-sgRNA1和PCA1301-Cas9-sgRNA2,为后续研究丝瓜LcPPO1基因功能奠定了基础。
关键词?丝瓜;LcPPO1基因;CRISPR/Cas9技术;基因编辑
中图分类号?S188?文献标识码?A?文章编号?0517-6611(2021)03-0105-05
doi:10.3969/j.issn.0517-6611.2021.03.028
Abstract?[Objective]LcPPO1?gene?editing?vector?for?luffa?was?constructed?by?CRISPR/Cas9?system.?[Method]Based?on?the?sequence?of?LcPPO1?gene?cloned?in?previous?stage,?two?sgRNA?target?sequences?were?designed,?and?the?sgRNA?double?strand?was?prepared?by?annealing.Then?the?sgRNA?double?strands?were?connected?with?the?linear?PCA1301Cas9?vector?to?obtain?two?recombinant?vectors,?respectively.?The?recombinant?vectors?were?transformed?into?E.coli?DH5α,?and?then?identified?by?PCR?and?sequenced.?[Result]Two?sgRNA?target?sequences?were?accurately?linked?into?the?PCA1301Cas9?vector,?respectively,?and?the?insertion?sequence?had?no?mutation.?[Conclusion]Two?LcPPO1?gene?editing?vectors?for?luffa,?PCA1301Cas9sgRNA1?and?PCA1301Cas9sgRNA2,?were?successfully?constructed,?which?laid?a?foundation?for?further?study?on?the?function?of?LcPPO1?gene?in?luffa.
Key?words?Luffa;LcPPO1?gene;CRISPR/Cas9?technique;Gene?editing
絲瓜为葫芦科(Cucurbitaeeae)丝瓜属(Luffa?Mill.)一年生攀援藤本植物,起源于印度,在东亚地区被广泛种植,我国各地也均有大面积栽培,是我国重要的蔬菜品种之一[1-2]。丝瓜主要有普通丝瓜[Luffa?cylindrica(L.)Roem.]和有棱丝瓜[Luffa?acutangula(L.)]两类栽培种,我国大部分地区以栽培普通丝瓜为主,仅广西、广东及海南省等华南地区种植有棱丝瓜[3]。普通丝瓜在储藏、运输、加工和烹饪过程中果肉和果汁容易产生褐变,极大降低了贮藏加工性能,严重影响丝瓜产品的营养品质和商品价值,造成了巨大的经济损失。阐明丝瓜褐变机理并控制褐变的发生已成为丝瓜育种及其采后贮藏保鲜的研究重点[3-6]。
研究发现,普通丝瓜的褐变属于酶促褐变,褐变的主要原因是细胞内酚类物质在多酚氧化酶(PPO)的催化下氧化形成醌,醌聚合形成黑色或褐色沉淀[7-8]。我国台湾的几个学者对丝瓜褐变的生理机制进行了探讨,证实丝瓜的褐变主要是PPO酶引起的酶促褐变,PPO酶的含量和活性与褐变具有直接关系[9-10]。课题组前期通过转录组测序和RT-PCR方法获得了3个丝瓜PPO家族基因(LcPPO1、LcPPO2和LcPPO3),分析显示LcPPO家族基因的表达与丝瓜褐变关系密切,其中LcPPO1、LcPPO2在普通丝瓜果肉褐变过程中发挥着重要作用[11]。通过对丝瓜LcPPO家族基因的功能验证,探究其在果实褐变中的调控作用,可为普通丝瓜品质改良和遗传育种提供科学依据。
CRISPR/Cas9(clustered?regularly?interspaced?short?palindromic?repeats/CRISPR)(CRISPRassociated?proteins?9,Cas9)基因编辑系统是近些年来人们验证特定基因功能的一种新手段[12]。其原理是crRNA与tracrRNA通过碱基配对结合形成sgRNA,引导Cas9蛋白在与crRNA配对靶位点处形成双链断裂(doublestranded?DNA?breaks,DSBs),之后细胞可以通过非同源性末端接合(nonhomologous?end?jouning,NHEJ)修复机制实现基因组特定位点的DNA插入、缺失、碱基突变或修饰,从而使基因发生移码突变[13]。与其他基因组编辑技术相比,CRISPR/Cas9系统的操作性更高,突变效率更高,可轻松实现对目标基因的敲除、替换和定点突变等操作,而且容易在第一代得到纯合的突变体[14]。目前,植物?CRISPR/Cas9?系统日趋完善,已经在拟南芥[15]、烟草[16]、番茄[17]和玉米[18]等多个物种中成功实现了定点基因组编辑。然而迄今为止,CRISPR/Cas9基因编辑技术在丝瓜基因功能研究中的应用鲜见报道。该研究根据前期已经克隆得到的丝瓜LcPPO1基因序列,设计2个sgRNA靶位点序列,构建2个LcPPO1基因CRISPR/Cas9基因编辑载体,以期为接下来的遗传转化及LcPPO1基因的功能研究奠定基础。
1?材料与方法
1.1?材料
1.1.1?质粒与菌株。
植物CRISPR/Cas9基因编辑载体为pCA1301-Cas9,由南京农业大学郭世荣课题组馈赠;所用菌株为大肠杆菌DH-5α,购自宝生物工程(大连)有限公司。
1.1.2?主要酶及试剂。
多功能DNA纯化回收试剂盒、Bbs?I和T4?DNA连接酶购自南京诺唯赞生物科技有限公司;T3?Super?PCR?Mix购自北京擎科生物科技有限公司;DL2000?DNA?Marker购自宝生物工程(大连)有限公司。
1.2?方法
1.2.1?sgRNA靶位点序列的设计与引物合成。
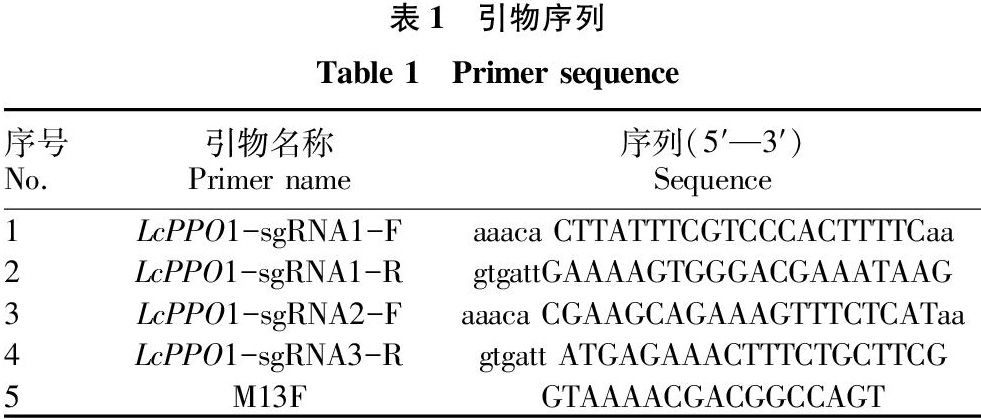
使用CRISPR?Primer?Designer?V1.1.2设计工具,在LcPPO1基因外显子序列寻找Cas9潜在的靶向位点,根据靶位点的位置及GC含量,筛选出2个合适的打靶位点,分别为LcPPO1-sgRNA1和LcPPO1-sgRNA2。根据该靶点得到相应引物,并在引物上添加酶切识别序列,由铂尚生物技术(上海)有限公司合成,引物序列见表?1。
1.2.2?pCA1301-Cas9-sgRNA重组载体的构建。
1.2.2.1?pCA1301-Cas9载体的酶切及回收。
使用限制性内切酶Bbs?I对pCA1301-Cas9载体进行酶切,反应体系为10×buffer?5?μL,Bbs?I酶1?μL,pCA1301-Cas9质粒2?μL,加水补至50?μL。使用金属浴37?℃酶切4?h,酶切产物进行1%琼脂糖凝胶电泳,切取目的条带,经多功能DNA纯化回收试剂盒回收酶切产物。
1.2.2.2?sgRNA引物退火。
将sgRNA寡核苷酸单链以逐步降温的方法退火成双链,程序如下:95?℃5?min;95?℃1?min,-1?℃/循环,40个循环;55?℃30?min;55?℃1?min,-1?℃/循环,22个循环;4?℃保持备用。
1.2.2.3?T4连接。
使用T4?DNA连接酶连接酶切后的载体与退火形成双链产物,反应体系为5×T4?DNA?Ligase?buffer?2?μL,酶切质粒?2?μL,双链产物?3?μL,T4?DNA?Ligase?1?μL,加水补至10?μL;37?℃连接2?h。
1.2.2.4?转化。
在10?μL的连接产物中加入DH5α感受态细胞至100?μL?轻轻混匀,冰水浴放置30?min,42?℃水浴中热激45?s,迅速移到冰中放置5?min,加入600?μL?LB培养基,37?℃振荡培养2?h,取100?μL菌液涂到LB(含卡那抗性)平板,倒置平板于37?℃培養12~16?h。
1.2.2.5?重组载体的鉴定。
挑取单菌落进行菌液PCR鉴定及测序。PCR鉴定使用通用引物M13F与sgRNA1-F和sgRNA2-F。反应体系为T3?Super?PCR?Mix?10?μL,引物各1.5?μL,菌液1?μL,加水补至20?μL;PCR反应条件为94?℃预变性3?min;94?℃?1?min,60?℃?1?min,72?℃?1?min,30个循环;72?℃?5?min,4?℃保存。对PCR产物进行1%的琼脂糖凝胶电泳鉴定,取阳性的重组载体送测序公司测序。
2?结果与分析
2.1?靶向LcPPO1的sgRNA设计
应用CRISPR?Primer?Designer?V1.1.2设计工具,在LcPPO1基因外显子序列找到2个合适的sgRNA序列,分别为LcPPO1-sgRNA1:5′-CTTATTTCGTCCCACTTTTC-3′;LcPPO1-sgRNA2:5′-CGAAGCAGAAAGTTTCTCAT-3′。由图1可知,LcPPO1-sgRNA1位于LcPPO1?CDS序列的55?bp处,LcPPO1-sgRNA2位于LcPPO1?CDS序列的105?bp处,2个sgRNA序列均为20?bp,GC含量达40%,并包含PAM标识位点。
2.2?载体pCA1301-?Cas9的酶切
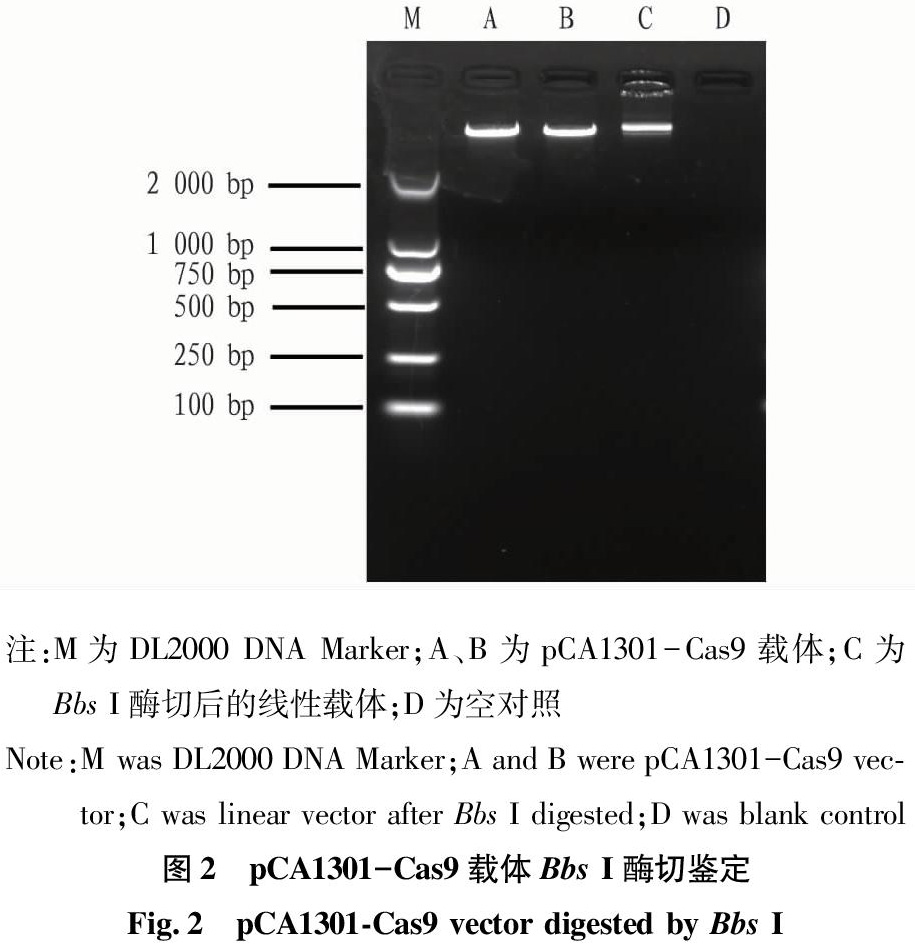
载体pCA1301-Cas9大小为14?847?bp,用限制性内切酶Bbs?I可酶切成大小为20和14?827?bp的2个片段,如图2所示,A、B为pCA1301-Cas9载体;C为Bbs?I酶切后的线性载体,A、B和C的片段差异很小,D为未加质粒的空对照,没有跑出条带,符合预期结果,表明载体pCA1301-Cas9酶切成功。
2.3?重组载体pCA1301-Cas9-sgRNA的构建
重组载体pCA1301-Cas9-sgRNA的构建流程如图3所示,2个sgRNA寡核苷酸单链以逐步降温的方法退火形成双链[图3A(1)和图3A(2)],接着利用限制性内切酶Bbs?I切去pCA1301-Cas9载体中的一小部分(图3B中阴影部分),从而获得线性载体,由于限制性内切酶Bbs?I本身只需识别序列的一端就可以进行酶切,所以该研究利用1个内切酶就能完成双酶切,最后利用T4连接酶将A1和A2序列分别与pCA1301-Cas9线性载体连接,获得重组载体pCA1301-?Cas9-sgRNA1和pCA1301-?Cas9-sgRNA2(图3C)。
2.4?重组载体pCA1301-Cas9-sgRNA的PCR鉴定结果
以M13F和sgRNA1-F为引物对重组载体pCA1301-Cas9-sgRNA1进行菌液PCR鉴定,以M13F与sgRNA2-F为引物对重组载体pCA1301-Cas9-sgRNA2进行菌液PCR鉴定。扩增得到的目的片段(图4)均在250?bp左右,与预期条带大小一致,说明2个sgRNA靶位点序列已经分别准确地连入pCA1301-Cas9载体,然后将阳性克隆菌液送至公司进行测序,结果显示插入片段与设计的序列匹配一致,无突变(图5),表明2个靶向LcPPO1基因的?CRISPR/Cas9基因编辑载体构建成功。
3?讨论
CRISPR/Cas系统是一种新兴起的基因定点编辑技术,它是基于细菌获得性免疫系统原理改造而成的一种全新的人工核酸酶系统,因其操作简单、编辑高效、成本低廉,已被广泛应用于多种农作物的基因功能研究[19]。CRISPR/Cas系统包括?CRISPR/Cas9、CRISPR/Cpf1、CRISPR/C2c1和CRISPR/C2c2等亚类型,其中应用最多的是CRISPR/Cas9[19]。然而在葫芦科作物中一直存在再生成苗率低、遗传转化困难等问题,所以一定程度上影响到该技术的利用。近几年,只在黄瓜和甜瓜中有CRISPR/Cas9技术应用的研究报道。Chandrasekaran等[20]通过改进CRISPR/Cas9技术制造出非转基因全雌性黄瓜。戚晶晶[21]利用CRISPR/Cas9技术创制出矮生黄瓜株系。王丹等[22]采用CRISPR/Cas9技术编辑了新疆甜瓜全缘叶基因PLL。王雪等[23]构建了甜瓜ACC合成酶基因CRISPR-Cas9表達载体。该研究以丝瓜为材料,构建了LcPPO1基因的CRISPR/Cas9基因编辑载体,填补了丝瓜在基因编辑研究方面的空缺,同时也为接下来的遗传转化及基因功能研究奠定了基础。
在CRISPR/Cas9基因编辑技术中,sgRNA的设计至关重要,既要考虑切割效率,又要考虑特异性。靶位点的选择与切割效率密切相关,应该尽量避免靶向基因的N端或C端以及靶向5′和3′非编码区。sgRNA序列的长度决定特异性,一般应为20?nt左右。有研究显示,小于20?nt的短sgRNA,可以在不牺牲靶基因组编辑效率的情况下,减少脱靶位点突变多达5?000倍或更多[24]。该研究按照sgRNA的设计原则,在LcPPO1基因编码区序列找到了2个合适的sgRNA序列,2个sgRNA序列均为20?nt,GC含量达40%,包含PAM标识位点,并成功构建了2个靶向LcPPO1的CRISPR/Cas9基因编辑载体,为丝瓜其他基因靶向的CRISPR/Cas9基因组编辑载体的构建提供了借鉴方法。下一步的工作是通过根癌农杆菌的介导将CRISPR/Cas9基因组编辑载体转入丝瓜,获得转基因植株,验证CRISPR/Cas9基因组编辑载体的有效性。
该研究所构建的2个重组载体均为单靶点CRISPR/Cas9基因编辑载体。通常情况下单个sgRNA只能靶向基因的1个位点,敲除率不稳定且偏低,而多个sgRNA靶向同一基因的不同位点,不仅能够提高基因突变的频率,还能造成较大片段的缺失突变。汪秉琨等[25]构建了Wx基因双靶点CRISPR/Cas9表达载体pGK03-Wx-gRNA,在T0、T1和T2代水稻株系中得到了多个位点突变的个体。胡春华等[26]利用一套改良的CRISPR/Cas9多靶点载体系统,构建了针对香蕉MaPDS的pYLCRISPR/Cas9-gRNA基因编辑载体,成功在香蕉体内实现了对内源MaPDS的定点敲除,获得了基因定点敲除的突变体株系。在后续的研究中如有必要可以对现有载体进行改进,考虑构建多靶点基因编辑载体。另外,课题组在前期的研究中已获得与丝瓜褐变相关的基因全长序列15条,包括11条PPO、PAL、POD、CAT和SOD家族基因和4条WRKY转录因子家族基因[11,27-34]。还可以利用CRISPR/Cas9技术进行多基因位点的同时编辑,从而进一步提高基因编辑的效率,获得更多的突变个体。
參考文献
[1]?李程斌,李恩,郑艳,等.丝瓜藤和叶营养成分分析[J].安徽师范大学学报(自然科学版),2009,32(1):69-71.
[2]?颜国纲,郑振佳,时新刚,等.丝瓜的营养价值及其综合利用研究进展[J].中国果菜,2011,31(7):35-36.
[3]?娄丽娜,刘哲,苏小俊.普通丝瓜耐褐变研究进展[J].长江蔬菜,2015(4):1-4.
[4]?王成,王辉,娄丽娜,等.普通丝瓜果肉褐变的鉴定方法[J].江苏农业科学,2012,40(11):137-138.
[5]?QUEIROZ?C,MENDES?LOPES?M?L,FIALHO?E,et?al.Polyphenol?oxidase:Characteristics?and?mechanisms?of?browning?control[J].Food?reviews?international,2008,24(4):361-375.
[6]?CONSTABEL?C?P,BARBEHENN?R.Defensive?roles?of?polyphenol?oxidase?in?plants[M]∥SCHALLER?A.Induced?plant?resistance?to?herbivory.Dordrecht:Springer?NVerlag,2008:253-270.
[7]?康娟,庄尹宏,林碧英,等.丝瓜多酚氧化酶及过氧化物酶酶学特性的研究[J].福建农业学报,2017,32(8):854-858.
[8]?吴海霞,曹雨舟.67.8?ku丝瓜多酚氧化酶酶学性质的研究[J].食品工业科技,2014,35(4):184-188.
[9]?苏群棋.不同瓜品种之多元酚氧化酶、多元酚含量与褐变间关系之探讨[D].台北:中国文化大学,1998.
[10]?吴佳真.圆筒丝瓜结果特性及果肉褐变之品种差异[D].台北:台湾大学,2004.
[11]?朱海生,康娟,刘建汀,等.丝瓜多酚氧化酶PPO基因家族的克隆与表达分析[J].核农学报,20l8,32(8):1502-1512.
[12]?暴会会,尹竹君,王少坤,等.CRISPR-Cas9系统在蔬菜育种上应用研究进展[J].江西农业学报,2019,31(7):38-44.
[13]?时欢,林玉玲,赖钟雄,等.CRISPR/Cas9介导的植物基因编辑技术研究进展[J].应用与环境生物学报,2018,24(3):640-650.
[14]?原文霞,王栩鸣,李冬月,等.利用CRISPR/Cas9技术靶向编辑水稻基因[J].浙江农业学报,2017,29(5):685-693.
[15]?JIANG?W?Z,ZHOU?H?B,BI?H?H,et?al.Demonstration?of?CRISPR/Cas9/sgRNAmediated?targeted?gene?modification?in?Arabidopsis,tobacco,sorghum?and?rice[J].Nucleic?acids?research,2013,41(20):188-200.
[16]?CHEN?K?L,GAO?C?X.Targeted?genome?modification?technologies?and?their?applications?in?crop?improvements[J].Plant?cell?reports,2014,33(4):575-583.
[17]?BROOKS?C,NEKRASOV?V,LIPPMAN?Z?B,et?al.Efficient?gene?editing?in?tomato?in?the?first?generation?using?the?clustered?regularly?interspaced?short?palindromic?repeats/CRISPRassociated9?system[J].Plant?physiology,2014,166(3):1292-1297.
[18]?LIANG?Z,ZHANG?K,CHEN?K?L,et?al.Targeted?mutagenesis?in?Zea?mays?using?TALENs?and?the?CRISPR/Cas?system[J].Journal?of?genetics?and?genomics,2014,41(2):63-68.
[19]?薛永国,刘鑫磊,唐晓飞,等.CRISPR-Cas9技术在作物中研究进展[J].黑龙江农业科学,2020(2):125-130.
[20]?CHANDRASEKARAN?J,BRUMIN?M,WOLF?D,et?al.Development?of?broad?virus?resistance?in?nontransgenic?cucumber?using?CRISPR/Cas9?technology[J].Molecular?plant?pathology,2016,17(7):1140-1153.
[21]?戚晶晶.利用CRISPR/Cas9技术创制矮生黄瓜株系[D].南京:南京农业大学,2017:10-20.
[22]?王丹,王旭辉,高兴旺,等.CRISPR/Cas9技术编辑新疆甜瓜全缘叶基因[J].新疆农业科学,2018,55(2):238-245.
[23]?王雪,李冠.CRISPR-Cas9系统敲除甜瓜ACC合成酶基因表达载体的构建[J].北方园艺,2017(12):114-118.
[24]?谢胜松,张懿,张利生,等.CRISPR/Cas9系统中sgRNA设计与脱靶效应评估[J].遗传,2015,37(11):1125-1136.
[25]?汪秉琨,张慧,洪汝科,等.CRISPR/Cas9系统编辑水稻Wx基因[J].中国水稻科学,2018,32(1):35-42.
[26]?胡春华,邓贵明,孙晓玄,等.香蕉CRISPR/Cas9基因编辑技术体系的建立[J].中国农业科学,2017,50(7):1294-1301.
[27]?朱海生,溫文旭,刘建汀,等.丝瓜苯丙氨酸解氨酶基因PAL克隆及表达分析[J].植物遗传资源学报,2018,19(2):268-276.
[28]?朱海生,刘建汀,王彬,等.丝瓜过氧化物酶基因的克隆及其在果实褐变中的表达分析[J].农业生物技术学报,2018,26(1):43-52.
[29]?温庆放,刘建汀,朱海生,等.丝瓜过氧化氢酶基因CAT1的克隆及表达分析[J].园艺学报,2016,43(10):2039-2048.
[30]?刘建汀,朱海生,温庆放,等.丝瓜过氧化氢酶CAT2基因的分离及表达分析[J].中国细胞生物学学报,2017,39(8):1076-1083.
[31]?朱海生,刘建汀,陈敏氡,等.丝瓜铜锌超氧化物歧化酶Cu/Zn-SOD基因家族的克隆与表达分析[J].中国农业科学,2017,50(17):3386-3399.
[32]?刘建汀,朱海生,温庆放,等.丝瓜LcWRKY21转录因子基因的克隆与表达分析[J].中国细胞生物学学报,2017,39(10):1268-1278.
[33]?刘建汀,朱海生,温庆放,等.丝瓜WRKY转录因子基因的分离与褐变分析[J].农业生物技术学报,2017,25(12):1950-1960.
[34]?ZHU?H?S,LIU?J?T,WEN?Q?F,et?al.De?novo?sequencing?and?analysis?of?the?transcriptome?during?the?browning?of?freshcut?Luffa?cylindrica?‘Fusi3?fruits[J].PLoS?One,2017,12(11):1-20.
- 浅谈人文关怀在大学思想政治教育中的实现途径
- 浅谈高等职业教育人才培养模式的构建
- 基于移动端的开放大学资产管理研究
- 西方商法学教学方法的发展趋势及对我国商法学本科教学的启示
- 思维导图在中职计算机教学中的应用
- 浅析桌面云在高职计算机实验环境中的应用
- MOOC资源创新推广策略研究
- 高校管理类课程改革实践
- 关于高校班级团支部建设的几点意见
- 关于高校开拓第二课堂的几点思考
- 职业院校语文教学中人文素养的培养
- 中职生就业心理不良表现与调适
- 基于MOOC的大学英语教学改革初探
- 探析健身气功竞赛功法的功能性训练策略
- 太极拳基本功训练内容引入健身气功训练的价值初探
- 《模拟电子技术》学习领域的开发与探索
- 生源多元化背景下高职学生管理工作有效途径实践
- 提高语文阅读教学效率的几点思考
- 对军校学员管理的思考
- 新形势下的军供站档案管理策略研究
- 军人过往招待档案管理信息化建设的思考
- 关于图书管理信息化建设存在的问题及对策的几点思考
- 民政社会救助档案管理的新思路探讨
- 档案室电子档案统计台账的建立与应用研究
- 高职院校图书馆为教科研提供文献资源服务
- preconsumed
- preconsumer
- preconsumers
- preconsumes
- preconsuming
- preconsumption
- preconsumptions
- precontain
- precontained
- precontaining
- precontains
- precontemplate
- remembrance
- remembrances
- rememorize
- rememorized
- rememorizing
- remend
- remended
- remending
- remends
- remention
- rementioned
- rementioning
- rementions
- 诗虎
- 诗行
- 诗衢
- 诗袋
- 诗要避俗,更要避熟
- 诗言志
- 诗言志,歌永言
- 诗论
- 诗评
- 诗词
- 诗词中描写景物的文字
- 诗词中的意境
- 诗词中读音响亮﹑形象鲜明的字眼
- 诗词作品
- 诗词例话
- 诗词唱和
- 诗词应和
- 诗词性标题
- 诗词文章的总称
- 诗词曲语辞例释
- 诗词曲语辞汇释
- 诗词歌赋
- 诗词气势奔放
- 诗词清爽新鲜
- 诗词的名声