樊青玲 周日宝 刘湘丹

摘要 [目的]建立忽地笑不同器官总RNA最佳提取方法。[方法]以忽地笑鳞茎、叶、花葶和花器官为材料,分别用普通试剂盒法、多糖多酚试剂盒法、Trizol法、SDS法和CTAB法进行不同器官总RNA提取方法比较。[结果]忽地笑不同器官最佳RNA提取方法不同,仅Trizol法能提取出鳞茎中RNA,普通试剂盒法和CTAB法均能提取出叶和花器官高质量RNA,多糖多酚试剂盒法和CTAB法能提取出花葶高质量RNA。[结论]普通试剂盒法是忽地笑叶和花的最快速、最简便的提取方法;多糖多酚试剂盒法是提取花葶的最佳提取方法;CTAB法能有效去除多糖、多酚,适合忽地笑叶、花葶和花中总RNA提取;试剂盒法和CTAB法均能提取高质量RNA,满足RT-PCR及后续试验的要求。
关键词 忽地笑;不同器官;RNA提取方法;RT-PCR
中图分类号 Q943 ?文献标识码 A
文章编号 0517-6611(2020)18-0169-04
Abstract [Objective]To establish the best extraction method of total RNA from different organs of Lycoris aurea. [Methods]The methods of extraction of total RNA from bulb,leaf,calyx and flower different organs were compared by means of common reagent box method, polysaccharide polyphenol reagent box method, Trizol method, SDS method and CTAB method. [Result]The best RNA extraction method for different organs was different. Only Trizol method can extract RNA from bulbs, and both normal reagent box method and CTAB method could extract highquality RNA from leaves and flower organs. Polysaccharide polyphenol reagent boxed method and CTAB method could extract highquality RNA from calyx. [Conclusion]The common reagent box method is the fastest and simplest method for extraction of Lycoris aurea leaves and flowers. The polysaccharide polyphenol reagent box method is the best method for extraction of calyx. The CTAB method can effectively remove polysaccharides and polyphenols, which is suitable for the extraction of total RNA in Lycoris aurea leaves, calyx and flowers. The reagent box method and CTAB method can extract highquality RNA to meet the requirements of RTPCR and subsequent tests.
Key words Lycoris aurea Herb;Different organs;Extraction method of RNA;RTPCR
忽地笑(Lycoris aurea Herb),又名黃花石蒜,为石蒜科(Amaryllidaceae)石蒜属(Lycoris)多年生草本植物[1]。忽地笑中富含生物碱、多糖和黄酮类化合物等[2],其生物碱加兰他敏是治疗阿尔茨海默氏病(AD)的首选药物之一。现阶段加兰他敏的生产来源主要是从石蒜类植物中提取得来,由于加兰他敏结构复杂,植物中加兰他敏的含量极低,同时人工合成步骤复杂且收率低,很难实现商业化生产[3-4],因此,运用先进的分子生物学手段,研究加兰他敏生物合成途径,探究克隆控制加兰他敏合成的关键酶(如儿茶酚氧位甲基转移酶COMT),是一条行之有效的方法。
目前,忽地笑分子生物方面的研究主要集中在忽地笑加兰他敏生物合成代谢途径中相关基因克隆方面[5-7]和用ISSR法对忽地笑进行分子鉴别[8],唐金凤等[9]对黄花石蒜花蕊和花葶中总RNA提取方法进行了研究,但未对不同器官不同方法进行详细研究。刘湘丹等[10]进行了人工栽培黄花石蒜不同器官中加兰他敏含量测定,结果显示加兰他敏含量从高到低依次为花、根、花葶、鳞茎。该研究用5种方法对忽地笑不同器官RNA提取方法进行比较,筛选出了提取鳞茎、叶、花葶和花中高质量RNA的方法,为克隆忽地笑中合成加兰他敏关键酶,并进行忽地笑不同器官中COMT酶的表达量与加兰他敏含量间相关性研究提供前期试验基础。
1 材料与方法
1.1 试验材料
1.1.1 试材。该试验材料原植株引种于衡山,现引种栽培在湖南中医药大学药用植物园,经周日宝教授鉴定为石蒜科石蒜属忽地笑。采摘不同器官于液氮冷却后,迅速置于-80 ℃冰箱保存备用。
1.1.2 试剂。
普通试剂盒(TIANGEN);多糖多酚植物总RNA提取试剂盒(BioFlus);Trizol提取液(Invitrogen公司);琼脂糖(上海生工);β-巯基乙醇;RNA酶清除剂(DEPC)(北京索莱宝科技有限公司); Revert Aid First Strand cDNA SynthesisKit逆转录试剂盒;DW2000 DNA Marker (康为世纪生物科技有限公司);6×superstain Loading Buffer(康为世纪生物科技有限公司);引物(上海生工);2×Taq PCR MasterMix (康为世纪生物科技有限公司)。其他试剂均为分析纯。
1.1.3 仪器。
美的微波炉(广东美的厨房电器制造有限公司);高速冷冻离心机(Thermo Fisher scientific公司);THA-3560C高压灭菌锅(造鑫企业有限公司);JY04-3C凝胶成像系统(北京君意东方电泳设备有限公司);JY系列水平电泳槽(北京君意东方电泳设备有限公司);Nano-200超微量核酸分析仪(杭州奥盛仪器有限公司);ME204E电子分析天平(托利多仪器有限公司);JY-96G PCR扩增仪(北京君意东方电泳设备有限公司);微量移液枪(德国eppendorf 公司)。
1.2 试验方法
1.2.1 总RNA提取方法。
1.2.1.1 普通试剂盒法。液氮研磨忽地笑不同器官样品粉末各约0.1 g,根据北京天根总RNA提取剂盒法说明书进行操作,所得RNA提取液50 μL,-80 ℃保存备用。
1.2.1.2 多糖多酚试剂盒法。取液氮研磨的样品粉末约0.1 g,根据Biospin多糖多酚植物总RNA提取试剂盒说明书进行操作,所得RNA提取液50 μL,-80 ℃保存备用。
1.2.1.3 Trizol提取法。取液氮研磨的样品粉末约0.1 g,按Trizol使用说明书进行操作,所得RNA提取液50 μL,-80 ℃保存备用。
1.2.1.4 SDS提取法。参照王暑辉等[11]的操作步骤提取RNA。具体操作步骤如下:取液氮研磨的样品粉末约0.1 g于加有600 μL SDS提取液[ 2% SDS、2% PVP、1.0 mol/L Tris-HCl,(pH=8.0)、0.25 mol/L EDTA]和40 μL β-巯基乙醇的1.5 mL离心管中,漩涡混匀;加入150 μL无水乙醇和150 μL 3 mol/L KAc,混匀; 12 000 r/min 4 ℃离心15 min;取上清液,加入250 μL水饱和酚和250 μL氯仿,混匀,冰上放置10 min;12 000 r/min 4 ℃离心15 min;取上清液,加入等体积氯仿,混匀,冰上放置10 min;12 000 r/min 4 ℃离心15 min;取上清液,加入等体积异丙醇,混匀,冰上放置10 min;12 000 r/min 4 ℃离心15 min;弃上清,加入1 ?mL 75%乙醇,温和洗涤沉淀;12 000 r/min 4 ℃离心15 min;弃上清,干燥,用50 μL DEPC水溶解RNA,-80 ℃保存备用。
1.2.1.5 CTAB提取法。参照陈欣等[12]的操作步骤提取RNA。具体操作步骤如下:取液氮研磨的样品粉末约0.1 g于加有600 μL CTAB提取液[ 2% CTAB、2%PVP、0.1 mol/L Tris-HCl(pH=8.0)、0.025 mol/L EDTA、2 mol/L NaCl] 和15 μL β-巯基乙醇的1.5 mL离心管中,漩涡混匀,65 ℃水浴10 min;加入等体积的氯仿/异戊醇(体积比24∶1),涡旋混匀,12 000 r/min 4 ℃离心10 min;取上清液至新的离心管中,加入1/3的8 mol/L LiCl,4 ℃过夜,12 000 r/min 4 ℃离心10 min;弃上清,加75%乙醇500 μL洗涤沉淀;加500 μL SSTE液[0.5%SDS、1 mol/L NaCl、0.01 mol/L Tris-HCl(pH=8.0)、0.001 mol/L EDTA]、等体积苯酚/氯仿/异戊醇(体积比25∶24∶1)和氯仿/异戊醇(体积比24∶1)各抽提一次;加2倍体积无水乙醇,-20 ℃放置2 h,12 000 r/min 4 ℃离心20 min;沉淀用75%乙醇洗涤2次,自然晾干,用50 μL DEPC水溶解RNA,-80 ℃保存备用。
1.2.2 总RNA质量检测。
1.2.2.1 纯度和浓度测定。
分别取各总RNA样品2 μL,用超微量核酸分析仪测定纯度和浓度。
1.2.2.2 完整性检测。
分别取5 μL RNA樣品,加1 μL 6×DNA Loading Buffer,用1.5%的琼脂糖凝胶150 V电泳30 min,电泳结果用凝胶成像系统观察并拍照记录。
1.2.2.3 RT-PCR检测。
为了进一步验证不同方法提取的不同器官总RNA样品纯度和完整性是否符合分子克隆要求,该研究进行了RT-PCR试验研究。
按Revert Aid First Strand cDNA SynthesisKit逆转录试剂盒说明书进行操作,将总RNA逆转录成第一链cDNA。从NCBI中搜索石蒜属植物COMT基因的EST序列(CN451800、CN452615、CN452616、CN452617、CN452618、CN452619、CN453880),根据以上序列用Primer 5.0软件设计RT-PCR简并引物(正向引物:5′-GACAGACGAGGAGTGCGAGCAGATA-3′;反向引物:5′-ATGGCAAACTCTTACATTGGATGGT-3′)。以第一链cDNA为模板,构建25 μL扩增体系:ddH2O 9.5 μL,2×Taq PCR MasterMix 12.5 μL,cDNA 1 μL,正向引物1 μL,反向引物1 μL。PCR扩增程序为:94 ℃ 预变性2 min;94 ?℃变性30 s,60 ℃复性30 s,72 ℃延伸1 min,循环34次;72 ℃延伸10 min;最后于4 ?℃保温。扩增产物在1.5%的非变性琼脂糖凝胶上150 V电泳30 min,检测目的条带。
2 结果与分析
2.1 总RNA纯度检测
忽地笑不同器官不同方法所提取的总RNA 纯度检测结果见表1。OD260/280用于评估蛋白质污染,宜在1.8~2.0,小于1.8,可能有蛋白质污染,大于2.0,RNA降解。OD260/230用于评估有机残留,宜大于2.0,若小于2.0,说明裂解液中有异硫氰酸胍和β-巯基乙醇残留。由纯度测定结果(表1)可知, 5种方法提取的鳞茎总RNA的OD260/230都小于2.0,除了Trizol法其他4种方法的OD260/280都小于1.8,说明有蛋白质污染,异硫氰酸胍和β-巯基乙醇残留;普通试剂盒法、多糖多酚试剂盒法和CTAB法提取的叶总RNA其OD260/230 和OD260/280基本符合要求;多糖多酚试剂盒法和CTAB法提取的花葶总RNA其OD260/230 大于2.0,OD260/280 在1.8~2.0;普通试剂盒法、多糖多酚试剂盒法和CTAB法提取花总RNA其OD260/230 和OD260/280基本符合要求。分析不同器官总RNA提取纯度发现,多糖多酚试剂盒法和CTAB法能很好地去除忽地笑叶、花葶和花中多糖、蛋白质,并且异硫氰酸胍和β-巯基乙醇基本上无残留。
2.2 完整性检测
不同器官不同方法提取的RNA在1.5%琼脂糖凝胶电泳检测结果见图1。高质量的RNA一般是28S和18S条带明亮、清晰,28S条带亮度为18S的1.5~2.0倍,并且无弥散、无降解。从图1可以看出,鳞茎样品仅Trizol法提取的RNA电泳结果有28S和18S条带,且2条带亮度差不多,说明RNA有一定的降解;叶样品普通试剂盒法和CTAB法提取的总RNA其28S条带亮度约为18S的2倍,但多糖多酚试剂盒法、Trizol法和SDS法提取的RNA均有明显的降解和DNA污染情况;花葶样品多糖多酚试剂盒法和CTAB法提取的总RNA其28S条带亮度为18S的约2倍,SDS法提取的总RNA有明显的降解和污染;花样品普通试剂盒法和CTAB法提取的总RNA其28S条带亮度为18S的1.5~2.0倍,多糖多酚试剂盒法提取的总RNA有明显的DNA污染,Trizol法和SDS法提取的总RNA有明显的降解。
2.3 RT-PCR检测
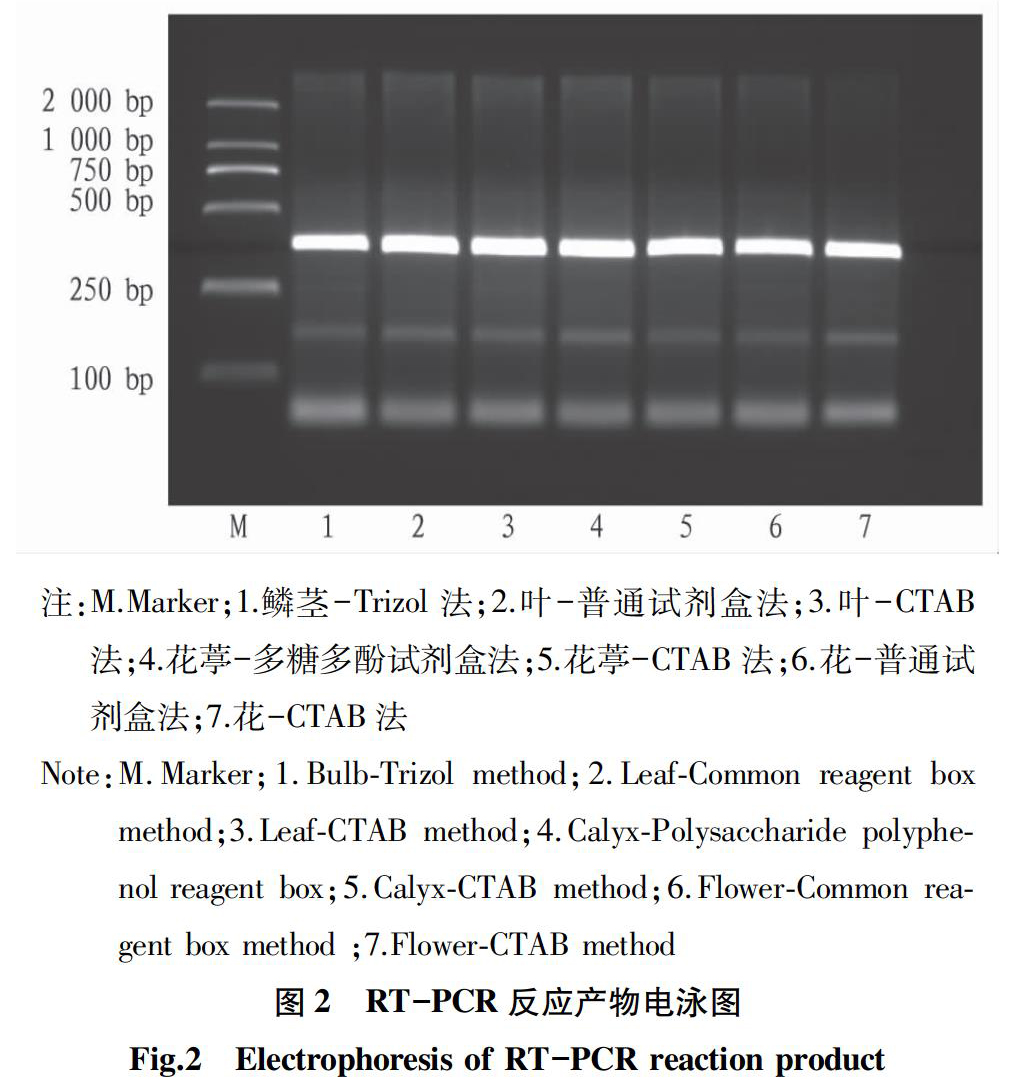
为了进一步验证用Trizol法提取鳞茎总RNA、普通试剂盒法和CTAB法分别提取叶总RNA、多糖多酚试剂盒法和CTAB法分别提取花葶总RNA、普通试剂盒法和CTAB法分别提取花总RNA能否满足后续试验,将以上方法提取的RNA逆转录,用简并引物进行RT-PCR验证,电泳结果见图2。电泳结果显示以上方法均能扩增出350 bp的目的条带。
3 结论与讨论
目前,植物中RNA提取的方法主要有CTAB法、SDS法、Trizol法[11,13]、试剂盒法[14] 、热酚法[15]、异硫氰酸胍法[12,16]等,对不同植物RNA提取方法研究较多,但不同植物不同器官有不同的最佳提取方法。笔者通过对忽地笑鳞茎、叶、花葶和花中总RNA不同提取方法比较研究,发现仅Trizol法能提取出鳞茎中RNA,普通试剂盒法和CTAB法均能提取出叶和花器官高质量RNA,多糖多酚试剂盒法和CTAB法能提取出花葶高质量RNA,均能满足后续试验,证实同一种植物不同器官RNA最适提取方法有所不同。
用5种方法提取忽地笑鳞茎总RNA的OD260/230 和OD260/280基本上都不在适宜的范围内,其可能是因鳞茎中含有大量多糖与RNA一起被沉淀有关[17-18],电泳显示仅Trizol法有条带, RT-PCR检测出目的条带,但获得鳞茎中高质量RNA的方法还需改进。叶和花较好的提取方法都为普通试剂盒法和CTAB法,2种方法相比,普通试剂盒法提取仅需1~2 h,且RNA质量较高,而CTAB法提取时间较长,提取期间避免不了对RNA的污染和影响,从电泳图可知有明显的蛋白质污染和DNA污染。花葶较好的提取方法为多糖多酚试剂盒法和CTAB法,由于CTAB法存在众多上述缺点,最佳提取方法为多糖多酚试剂盒法。
纵观忽地笑RNA提取方法,试剂盒法是提取忽地笑不同器官RNA的最快速、最简便的方法,且多糖多酚试剂盒法更能针对性地有效去除多糖和酚类化合物。Trizol法不能有效去除多糖和蛋白质,RNA存在明显的降解,不能提取完整的RNA,说明此方法对忽地笑不合适。SDS法提取不同器官时都存在RNA严重降解和污染问题,其可能与操作时间较长有关。CTAB法以CTAB为变性剂,同时加入PVP和β-巯基乙醇共同作用变性蛋白和抑止RNase的活性,使用无水乙醇和异丙醇沉淀杂蛋白和总核酸,能很好地去除多糖、多酚,分离出较好的RNA,但CTAB 法操作繁琐,需要多次沉淀RNA,操作时间较长,容易造成污染。所以,找到最佳RNA提取方法、提取高质量RNA是后续试验成败的关键。
参考文献
[1] 赵运林,喻勋林,傅晓华,等.湖南药用植物资源[M].长沙:湖南科学技术出版社,2009:941.
[2] 杨郁.黄花石蒜、鬼针草的化学成分和生理活性研究[D].北京:中国人民解放军军事医学科学院,2005.
[3] 陈士林,庞晓慧,姚辉,等.中药DNA条形码鉴定体系及研究方向[J].世界科学技术(中医药现代化),2011,13(5):747-754.
[4] 李亞仲.石蒜生物碱含量变化特征及红花石蒜P-香豆酰酯3-羟化酶基因的克隆与表达分析[D].南京:南京农业大学,2008.
[5] 唐金凤.黄花石蒜花蕊与花葶差异片段的克隆及其生物信息学分析[D].长沙:湖南中医药大学,2012.
[6] 伍美慧.忽地笑加兰他敏生物合成代谢途径中关键酶基因克隆及表达[D].长沙:湖南中医药大学,2015.
[7] 唐金凤,鲁耀邦,桂柳姿.mRNA差异显示法筛选黄花石蒜中加兰他敏合成相关基因[J].湖南中医药大学学报,2012,32(7):34-36.
[8] 田晓俊,符树根.石蒜和忽地笑ISSR分子鉴别及其遗传多样性研究[J].江西林业科技,2012(2):24-28.
[9] 唐金凤,鲁耀邦,桂柳姿.黄花石蒜花蕊和花葶组织中总RNA提取方法的比较[J].湖南中医药大学学报,2012,32(1):31-34.
[10] 刘湘丹,王姣,李凤娟,等.不同产地人工栽培黄花石蒜不同器官中加兰他敏含量测定[J].湖南中医药大学学报,2015,35(5):31-33.
[11] 王暑辉,徐倩,徐筱,等.富含多糖多酚的侧柏叶片总RNA提取方法[J].吉林农业大学学报,2012,34(1):76-80.
[12] 陈欣,祝传书,冯俊涛,等.雷公藤RNA提取方法选择与优化[J].西北林学院学报,2014,29(2):112-116.
[13] 尹慧,陈莉,李晓艳,等.百合叶片总RNA提取方法比较及优化[J].中国农业大学学报,2008,13(4):41-45.
[14] 杨晓燕,张波,黄方爱,等.适合转录组测序的葡萄叶片总RNA试剂盒提取法的改进[J].生物技术通报,2013(6):215-220.
[15] 王友华,卢孟柱,段留生.棉花幼苗根总RNA提取的改进热酚法[J].西北植物学报,2005,25(4):723-726.
[16] 曾凡锁,南楠,詹亚光.富含多糖和次生代谢产物的白桦成熟叶中总RNA的提取[J].植物生理学通讯,2007,43(5):913-916.
[17] ?刘小攀,田春莲,肖卓炳,等.忽地笑多糖分子量及单糖组成研究[J].天然产物研究与开发,2017,29(10):1648-1653.
[18] LEWINSOHN E,STEELE L C,CROTEAU R. Simple isolation of functional RNA from woody stems of gymnospenns [J]. Plant Mol Biol Rep,1994,12:20-25.
- 小学语文教学中的微课应用研究
- 基于核心素养下的小学数学单元整体教学设计和实践研究
- 关于幼儿园教学中游戏教学的重要性探索
- 小学音乐律动教学中的声势律动妙用探讨
- 阅读教学的方法创新与途径扩展
- 幼儿园体育活动教学中的问题与对策
- 七年级寄宿生小组合作式课外阅读策略研究
- 从美学角度浅谈培养学生的作文兴趣
- 关于高中数学核心素养培养的思考
- 浅谈信息化手段与语文阅读教学的融合研究
- 初中语文教学中传统文化的渗透措施探讨
- 小学课堂教学中对教师语言艺术的培养方式初探
- 立德树人背景下小学美术信息化教学探究
- 浅析如何构建小学数学教学高效课堂
- 如何在小学数学课堂教学中培养学生核心素养
- 智慧课堂背景下平板电脑的应用实践
- 如何应用网络培养高中政治核心素养
- 刍议乡土资源在小学语文教学中的应用
- 小学美术教学中动手能力的培养策略
- 浅谈小学班主任班级管理的创新及实践
- 地域文化融入幼儿园教学探究
- 李娜:小学高年级数学应用题解答能力的培养措施
- 浅析生活情境在初中数学教学中的运用策略
- 浅谈小学班主任班级管理的创新与实践
- 小学高年级数学应用题解答能力的培养措施
- boosters
- boosting
- boost morale/raise morale
- boosts
- boost sb's confidence
- boost sb's ego
- boost²
- boost¹
- boot
- bootability
- bootable
- boot camp
- boot camps
- booted
- booth
- booths
- booting
- bootleg
- bootlegged
- bootlegger
- bootleggers
- bootlegging
- bootlegs
- boot's
- boots
- 清雅的席位
- 清雅的文辞
- 清雅的玩物
- 清雅的癖好
- 清雅的谈论
- 清雅秀丽
- 清雅秀逸的姿容
- 清雅精当
- 清雅纯正
- 清雅美好
- 清雅美好的情思
- 清雅美妙
- 清雅脱俗
- 清雅至极
- 清雅豪爽
- 清雅闲逸
- 清雨
- 清雪
- 清零
- 清霁
- 清霄
- 清霜
- 清霜紫电
- 清露
- 清靓