摘 要 利用固相萃取-液相色谱-飞行时间质谱(SPE-LC-Q-TOF/MS)技术建立了谷物、 蔬菜和水果中25种杀菌剂农药残留的快速筛查和确证检测方法。样品经1%(V/V)乙酸-乙腈溶液提取,经Crabon/NH2柱净化,乙腈-甲苯(3∶1, V/V)洗脱,C18色谱柱分离,乙腈和0.1% 甲酸溶液(含5 mmol/L乙酸铵)梯度洗脱,采用LC-Q-TOF/MS检测,外标法定量。建立了25种杀菌剂的一级精确质量数据库和二级谱图库,通过化合物的精确质量数、 保留时间、 同位素峰分布、 同位素比例等信息对检测结果进行自动检索,在无对照标准品的情况下实现了25种农药的定性鉴定。结果表明,25种杀菌剂在0.02~200 μg/L范围内线性关系良好,相关系数R2≥0.9950, 加标回收率在71.8%~114.0%之间,相对标准偏差(RSD)为0.1%~21.3% (n=3)。25种杀菌剂检出限为0.01~5.00 μg/kg,定量限为0.02~20.00 μg/kg。本方法簡便、 快速、 可靠,可用于谷物、 蔬菜、 水果中25种杀菌剂的快速筛查。
关键词 杀菌剂; 固相萃取; 谷物; 果蔬; 液相色谱-飞行时间质谱
1 引 言
杀菌剂广泛用于农业生产,其销量占全球农药交易量的26%,销售额高达133亿美元[1]。杀菌剂的非正确使用会对食品安全、 生命健康和环境构成威胁,为此我国颁布了GB 2763-2016《食品中农药最大残留限量》,并于2017年6月执行。杀菌剂检测方法主要有气相色谱法(GC)[2]、 液相色谱法(LC)[3]、 气相色谱-质谱法(GC-MS)[4,5]、 液相色谱-质谱法(LC-MS)[6]、 气相色谱-串联质谱法(GC-MS/MS)[7]、 液相色谱-串联质谱法(LC-MS/MS)[8~10]等。液相色谱法因不必过分关注分析物的沸点而比气相色谱法应用更广; 基于低分辨率质谱的LC-MS 和LC-MS/MS法常因分辨率低而导致假阳性结果。基于高分辨质谱的液相色谱-飞行时间质谱法(LC-Q-TOF/MS)[11,12],既可以获得化合物的分子离子信息,又可以在碰撞碎裂后获得丰富的碎片离子信息,可有20个定性点[13],其高通量快速筛查和确证能力强,在杀菌剂残留检测方面具有较好的应用前景。谷物和果蔬中农药残留检测前通常要经过净化和除杂的前处理步骤,主要方法有固相萃取(SPE)[12,14]、 固相微萃取(SPME)[15]、 分散固相萃取(DSPE)[16,17]、 分散液-液微萃取(DLLME)[2,18,19]及QuEChERS[6,7,10,20,21]等。微萃取方法难以直接应用于复杂基质样品,QuEChERS方法的处理结果也常在回收率和抗干扰等方面弱于固相萃取方法。
甲氧基丙烯酸酯类与琥珀酸脱氢酶抑制剂是两类常用的杀菌剂, 本研究建立了快速筛查谷物和果蔬中这两类杀菌剂中的25种杀菌剂残留的SPE-LC-Q-TOF/MS法,本方法简便、 快速、 定性准确,可用于实际样品中杀菌剂的快速筛查。
2 实验部分
2.1 仪器与试剂
Agilent 1290-6550液相色谱-四极杆-飞行时间质谱仪(美国Agilent公司),配有Dual AJS ESI 源; KDC-40低速离心机(中国中佳公司); SR-2DS水平振荡器(日本TAITEC公司); MX-S涡旋搅拌器(美国Scilogex公司); N-EVAP 112氮吹浓缩仪(美国Organomation Associates 公司); 旋转蒸发仪(瑞士BUCHI公司)。
25种农药标准品: 纯度≥95%(德国Dr.Ehrenstorfer GmbH公司); 乙腈、 丙酮和乙酸乙酯均为色谱纯(Honeywell); 氯化钠、 无水Na2SO4和无水MgSO4 (北京化工厂); 甲酸和乙酸铵 (赛默飞世尔科技中国有限公司); Crabon/NH2固相萃取柱(美国Waters公司); Cleanert C18和Cleanert PC/PSA固相萃取柱(天津博纳艾杰尔科技有限公司)。
2.2 标准溶液配
各单标准储备液为1.0 mg/mL的甲醇溶液(嘧菌酯为二氯甲烷溶液)。标准溶液浓度为10 μg/mL的25种目标杀菌剂的混合溶液。
2.3 样品预处理
2.3.1 样品的制备 大米、 燕麦样品通过搅拌机粉碎,装入塑料小瓶,密封,标记,置于干燥处。苹果、 葡萄、 黄瓜和番茄样品通过搅拌机打碎,装入塑料小瓶,密封,标记,置于20℃条件下储存(使用前先解冻至室温)。
2.3.2 样品提取 称取10 g(精确至0.01 g)果蔬试样,置入50 mL离心管中(谷物试样称取5 g(精确至0.01 g),置入50 mL离心管中,加入10 mL超纯水,静置30 min),加入20 mL 1%(V/V)乙酸的乙腈提取,涡旋1 min,加入1 g NaCl,4 g无水MgSO4,摇匀后振荡6 min,以4200 r/min离心5 min,取10 mL上清液至150 mL鸡心瓶,40℃水浴旋转蒸发浓缩至2 mL。
2.3.3 样品净化 Crabon/NH2柱中填入约2 cm高的无水Na2SO4,用4 mL淋洗液乙腈-甲苯(3∶1,V/V)进行活化。过柱子,下接80 mL鸡心瓶待用,将浓缩液移至柱中,并使用2 mL乙腈-甲苯(3∶1,V/V)溶液洗涤鸡心瓶3次,待液面距离Na2SO4约0.4 cm时,在柱上加20 mL贮液器,加入20 mL乙腈-甲苯(3∶1,V/V)洗脱,待所有液体收集完毕之后,取出鸡心瓶。40℃水浴旋转蒸发浓缩至0.5 mL,氮吹至干,用1 mL乙腈-0.1%甲酸溶液(2∶8,V/V)复溶,超声溶解,过0.22 μm滤膜,供LC-Q-TOF/MS分析。
2.4 农药化合物的筛查与确证
2.4.1 TOF/MS数据库的建立 实验选择25种农药,配制成浓度为1.0 mg/L的标准溶液,在确定的色谱与质谱条件下对标准溶液进行测定,在仪器的定性软件Find by formula功能中输入目标化合物的分子式对数据进行检索。记录25种农药的保留时间、 精确分子量、 母离子以及离子化形式(+H,+NH4,+Na),母离子精确分子质量的采集标准为小于10 ppm。将化合物名称,分子式,保留时间,精确分子量输入CSV格式的文件中,作为TOF/MS数据库,此库用于初步筛查。
2.4.2 Q-TOF/MS数据库的建立 在建立TOF/MS数据库的基础上,采集Q-TOF/MS数据库信息,在Q-TOF Targeted MS/MS采集界面输入农药的母离子、 保留时间以及8个不同的碰撞能量,并设置碎片离子扫描范围(50~母离子质核比+10),进行碎片离子数据采集。在Targeted MS/MS功能中提取目标化合物不同碰撞能量下的碎片信息,选取碎片离子信息较丰富的4个碰撞能量下的质谱图导出为CEF格式的文件,然后将谱图导入PCDL软件中,与对应的农药信息相关联,从而建立了Q-TOF/MS数据库。25种型杀菌剂的分子式、 保留时间、 精确质量数、 母离子及碰撞能等信息见表1。
2.4.3 实际样品筛查与确证 在确定的色谱与质谱条件下对实际样品进行测定,采集数据在TOF/MS数据库中进行检索,给出初步筛查结果,筛查结果以得分作为依据,得分权重分别为精确分子量占100、 同位素峰分布占50和同位素比例占50。实测值与理论值进行比较,最终给出得分,TOF得分值≥60时,确定该化合物为目标化合物。依据初步筛查结果建立目标化合物的二级方法,二级方法即为在Targeted MS/MS采集模式下输入化合物母离子、 保留时间、 碰撞能量等信息,对实际样品进行再次检测,将检测谱图与Q-TOF/MS数据库中谱图,在镜像对比条件下匹配确证。其Q-TOF得分值≥60,即确认检出该目标化合物。
2.5 LC-Q-TOF/MS测定条件
2.5.1 色谱条件 液相色谱条件: ZORBAX SB-C18色谱柱(100 mm × 2.1 mm,3.5 μm); 流动相: A 为0.1% 甲酸溶液(含5 mmol /L乙酸铵),B為乙腈; 洗脱梯度: 0~3 min,1%~30% B; 3~6 min,30%~40% B; 6~9 min,40% B; 9~15 min,40%~60% B; 15~19 min,60%~99% B; 19~23 min99% B; 23~23.01 min 99%~1% B。后运行4 min,柱温: 40℃; 流速: 0.4 mL/min; 进样量: 10 μL。
2.5.2 质谱条件 离子源: 电喷雾电离(ESI)源,正离子模式( ESI + ); 干燥气温度: 225 ℃; 干燥气流速14 L/min,雾化气压力40 psi,鞘气温度325℃,鞘气流速10 L/min,毛细管电压: 4000 V,碎裂电压400 V,锥孔电压 65 V。全扫描质核比范围为m/z 100~1700,扫描速率为2 spectra/s,采用内标参比溶液对仪器质量精度进行实时校正,内标参比溶液包含嘌呤(离子精确质量数为121.050873)和HP-0921(离子精确质量数为922.009798)。
3 结果与讨论
3.1 固相萃取小柱的选择
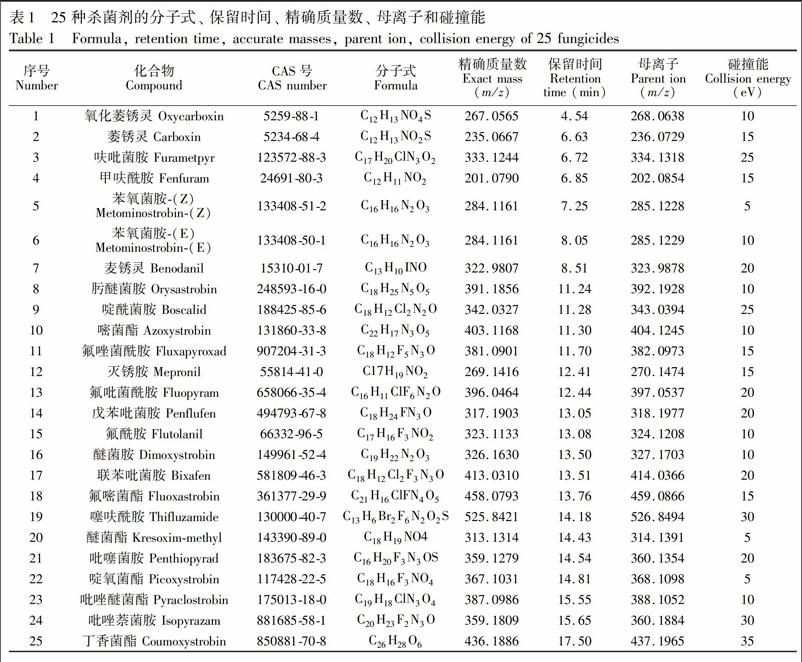
考察了Carbon-NH2、 Cleanert C18和Cleanert PC/PSA 3种固相萃取柱的净化效果。尽管Cleanert C18有很好的去非极性杂质效果,但有色样品经过Cleanert C18处理后,仍存较多色素,存在污染色谱柱的风险。 Carbon-NH2和Cleanert PC/PSA可有效去除样品中的色素。图1为经不同固相萃取小柱处理后谷物果蔬中25种杀菌剂的回收率。Carbon-NH2固相萃取柱的加标回收率更高一些,故在后续工作中选择Carbon-NH2为净化柱。
3.2 提取溶剂的选择
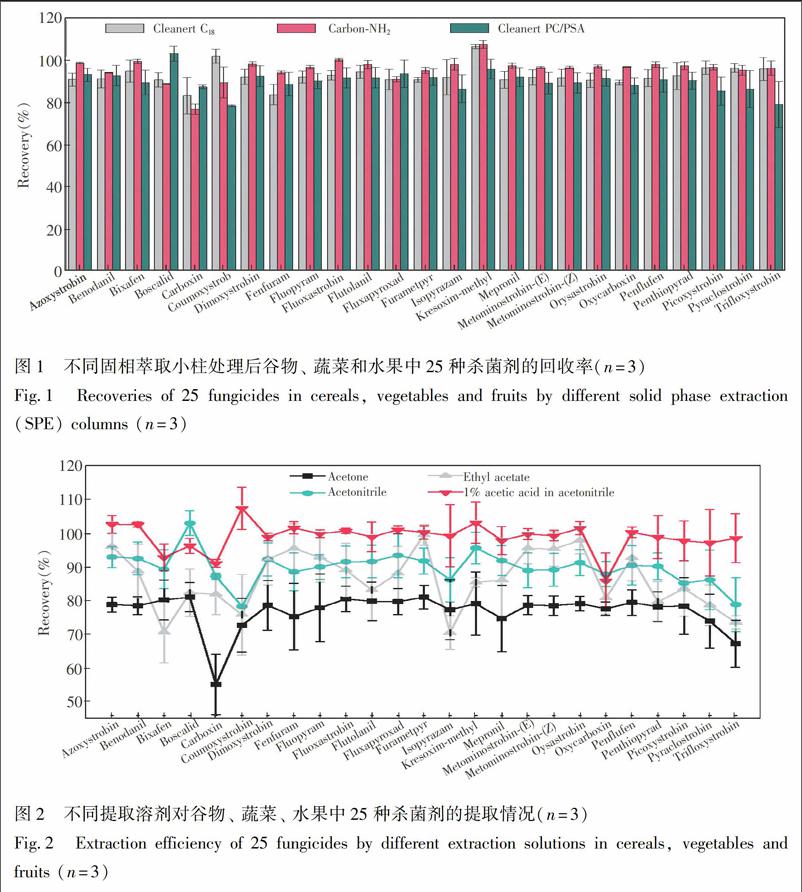
本研究对提取溶剂的种类进行了考察,根据25种化合物的理化性质,首先选择乙腈、 丙酮和乙酸乙酯作为提取剂。提取效率有明显的差别,丙酮的加标回收率个别的杀菌剂低于70%,多在70%~80%之间。乙酸乙酯的加标回收率在70%~90%之间,乙腈的加标回收率大多在80%~100%之间。在此基础上,本实验比较了1%(V/V)乙酸-乙腈与乙腈对实验结果的影响,结果表明,1%(V/V)乙酸-乙腈对25种化合物的提取效率更好(图2)。因此,本研究选择1%(V/V)乙酸-乙腈作为提取溶剂。
3.3 洗脱溶剂及洗脱体积的选择
本研究对洗脱溶剂及洗脱体积进行了考察,比较了乙腈、 乙腈-甲苯(10∶1,V/V)、 乙腈-甲苯(5∶1,V/V)、 乙腈-甲苯(3∶1,V/V)作为洗脱溶剂的洗脱效果。结果表明,4种洗脱溶剂对25种化合物的洗脱效果都能满足要求,乙腈-甲苯(3∶1,V/V)的洗脱能力最好,故选择乙腈-甲苯(3∶1,V/V)作为洗脱溶剂。
进一步对洗脱体积(10、 15、 20和25 mL)进行了优化,洗脱体积过大会造成浪费,若体积不足,则会造成洗脱效果不好,目标物回收率低。结果表明,洗脱体积为20 mL时,洗脱效果最好。
3.4 线性范围、 检出限和定量限
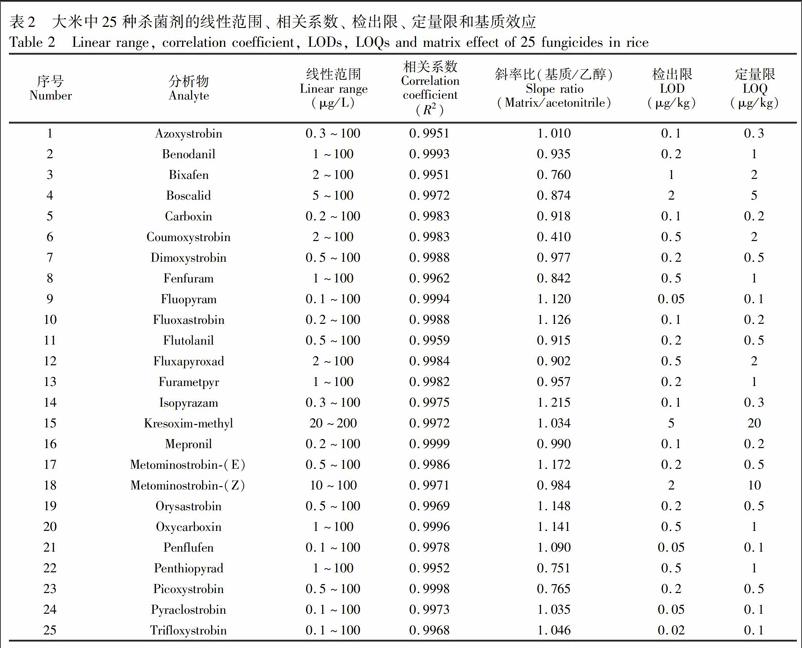
以空白样品制备系列浓度(0.02~200 μg/L)的基质标准,在确定的色谱和质谱条件下测定, 以峰面积为纵坐标,浓度为横坐标绘制标准曲线,标准曲线线性关系良好,6种基质中线性相关系数R2≥0.9950; 以3倍的信噪比计算检出限,以10倍的信噪比计算定量限,大米、 燕麦、 黄瓜、 番茄、 葡萄和苹果基质中农药的检出限分别为0.02~5 μg/kg、 0.02~5 μg/kg、 0.02~5 μg/kg、 0.01~5 μg/kg、 0.02~2 μg/kg和0.02~5 μg/kg,定量限分别为0.05~20 μg/kg、 0.05~10 μg/kg、 0.1~20 μg/kg、 0.02~20 μg/kg、 0.05~5 μg/kg和0.05~15 μg/kg。6种基质中25种杀菌剂的线性范围、 相关系数、 检出限和定量限见附表1。表2为大米中25种杀菌剂的线性范围、 相关系数、 检出限和定量限。
3.5 基质效应
基质效应主要是考虑基质中是否含有干扰待测组分定量检测的成分,这些影响可能由于在离子化过程中待测组分与样品中干扰成分的竞争产生的[22]。本研究中,将基质匹配标准品的线性校准曲线的斜率(A)与纯溶剂标准品得到的斜率(B)进行比较,评价由不同基质引起的基质诱导信号抑制或增强。若A/B的值在0.9~1.1之间,基质效应可以忽略。反之,基质效应不可忽略[20]。本研究中采用基质匹配标准溶液绘制校准曲线以消除基质效应,使定量更准确。6种基质的基质效应见附表1。
3.6 回收率和精密度
在大米、 燕麦、 番茄、 黄瓜、 葡萄、 苹果中各添加质量浓度为5、 20、 50 μg/kg的25种杀菌剂的混合标准溶液。应用2.3节方法进行样品前处理,测定回收率,每个添加水平重复测定3次。结果显示大米、 燕麦、 黄瓜、 番茄、 葡萄和苹果基质中25种杀菌剂的加标回收率范围分别为73.4%~111.7%、 72.2%~114%、 71.8%~107.7%、 75.7%~106%、 76.4%~102.2%和81.8%~113.2%。 RSD范围分别为0.5%~13.9%、 0.4%~21.3%、 0.1%~14.6%、 0.2%~9.5%、 0.2%~9.6%和0.6%~19.8%。(见附表2),表3为大米中25种杀菌剂的回收率和相对标准偏差。
3.7 实际样品分析
应用本方法对市售的68例样品(番茄、 黄瓜、 葡萄各14例,苹果18例,大米5例,燕麦3例)中25种杀菌剂进行测定。样品来自北京、 天津和石家庄各大超市及农贸市场。18例苹果样品中检出3种杀菌剂(嘧菌酯、 氟吡菌酰胺和吡唑醚菌酯),14例葡萄样品中检出4种杀菌剂(嘧菌酯、 氟吡菌酰胺、 吡唑醚菌酯和肟菌酯),14例番茄样品中检出5种杀菌剂(嘧菌酯、 氟吡菌酰胺、 吡唑醚菌酯、 氟唑菌酰胺和肟菌酯),14例黄瓜样品中检出4种杀菌剂(嘧菌酯、 啶酰菌胺、 氟吡菌酰胺和肟菌酯),5例大米样品中均未检出,3例燕麦样品中检出2种杀菌剂(氟吡菌酰胺和氟嘧菌酯)。68例样品检出杀菌剂、 TOF得分、 Q-TOF得分及定量结果见表4。
4 结 论
本研究采用固相萃取的方法对谷物、 蔬菜和水果样品进行前处理,并通过建立一级数据库与二级谱图库,应用LC-Q-TOF/MS数据库的检索功能,实现了无需标准品对照,对谷物和果蔬中25种杀菌剂的筛查与确证。25种杀菌剂在0.02~200 μg/L范围线性良好,回收率为71.8%~114.0%。本方法快速、简单、 净化效果好、 灵敏度高,可以用于谷物和果蔬中杀菌剂的快速筛查,为食品安全提供了保障。
References
1 SU Ke. Agrochemicals, 2013, 52(7): 469-475
孙 克. 农药, 2013, 52(7): 469-475
2 Xue J Y, Li H C, Liu F M, Jiang W Q, Chen X C. J. Sep. Sci., 2014, 37(7): 845-852
3 Liang P, Liu G J, Wang F, Wang W T. J. Chromatogr. B, 2013, 926: 62-67
4 Lagunas-Allué L, Sanz-Asensio J, Martínez-Soria M T. J. Chromatogr. A, 2012, 1270: 62-71
5 Paramasivam M, Selvi C, Deepa M, Jayaprakash S A, Chandrasekaran S. J. Sep. Sci., 2015, 38: 958-964
6 HUANG Chao-Qun, DING Hui-Ying, ZHU Xiao-Yu, CHEN Ling-Ling, LI Bo, LOU Cheng-Jie. Journal of Instrumental Analysis, 2011, 30(6): 656-660
黄超群, 丁慧瑛, 朱晓雨, 陈玲玲, 李 铂, 楼成杰. 分析測试学报, 2011, 30(6): 656-660
7 Zhang W W, Xu J, Dong F S, Liu X G, Zhang Y, Tao Y, Wu X H, Zheng Y Q. Anal. Methods, 2013, 5: 7102-7109
8 Campillo N, Iniesta M J, Vinas P, Córdoba M H. Food Addit Contam A, 2015, 32(12): 2039-2047
9 Raina-Fulton R. J. Agric. Food. Chem., 2015, 63(21): 5152-5162
10 Dong F S, Chen X, Liu X G, Xu J, Li Y B, Shan W L, Zheng Y Q. J. Chromatogr. A, 2012, 1262: 98-106
11 Schurek J, Vaclavik L, Hooijerink H D, Lacina O, Poustka J, Sharman M, Caldow M, Nielen M W F, Hajslova J. Anal. Chem., 2008, 80(24): 9567-9575
12 Fontana A R, Rodríguez I, Ramil M, Altamirano J C, Cela R. J. Chromatogr. A, 2011, 1218(16): 2165-2175
13 Hernndez F, Ibez M, Sancho J V, Pozo O J. Anal. Chem., 2004, 76(15) : 4349-4357
14 Carpinteiro I, Ramil M, Rodríguez I, Cela R. J. Chromatogr. A, 2010, 1217(48): 7484-7492
15 Vias P, Campillo N, Martínez-Castillo N, Hernndez-Córdoba M. J. Chromatogr. A, 2009, 1216(1): 140-146
16 Farha W, Rahman M M, Abd El-Aty A M, Jung D, Kabir M H, Kabir J H, Kim S W, Im S J, Lee Y J, Shin H C, Kwon C H, Son Y W, Lee K B, Shim J H. Biomed. Chromatogr., 2015, 29(12): 1932-1936
17 Wu Y L, Chen R X, Zhu Y, Zhao J, Yang T. J. Chromatogr. B, 2015, 989: 11-20
18 Chen B, Wu F Q, Wu W D, Jin B H, Xie L Q, Feng W, Ouyang G F. Microchem. J., 2016, 126: 415-422
19 Yang M Y, Xi X F, Wu X L, Lu R H, Zhou W F, Zhang S B. J. Chromatogr. A, 2015, 1381: 37-47
20 You X W, Peng W, Liu F M, Shi K W, Li Y Q. Intern. J. Environ. Anal. Chem., 2015, 95(11): 989-1000
21 YANG Huan, SUN Wei-Hua, CAO Zhao-Yun, MA You-Ning, CHAI Shuang-Shuang, QIN Mei-Ling, CHEN Ming-Xue. Chinese Journal of Chromatography, 2016, 34(11): 1070-1076
楊 欢, 孙伟华, 曹赵云, 马有宁, 柴爽爽, 秦美玲, 陈铭学. 色谱, 2016, 34(11): 1070-1076
22 Pay P, Anastassiades M, Mack D. Anal. Bioanal. Chem., 2007, 389: 1697-1714
- 浅谈自然拼读法与音标教学在初中英语教学中的分阶段运用
- 初中英语写作技巧及教学指导
- 初中英语口语教学中的情境创设
- 跨文化交际在初中英语教学中的渗透分析
- 创设综合实践活动 激活初中语文学习
- 初中语文古诗词的意境教学探究
- 九年级化学实验教学活动的研究与探索
- 基于核心素养的初中英语教学改革与实践探索
- 聚焦核心素养 优化初中英语教学策略
- 浅谈新课改下初中语文作文指导的策略
- 一题多解,胜似多解题
- 利用生本教法提高物理实验课效率的研究
- 初中生物教学中的情景教学研究
- 生活化初中语文教学方法的探讨
- 浅谈情景教学法在初中语文教学中的应用
- 初中语文教学中的传统文化教育
- 初中语文古诗词鉴赏教学策略
- 初中语文的文言文阅读教学有效策略分析
- 初中语文课堂教学中阅读向写作迁移的策略探讨
- 浅析初中语文教学中的多元化教学方法
- 新课程理念下初中化学教学策略研究
- 核心素养下自我效能感对初中化学教学的影响
- 核心素养背景下九年级化学课堂教学方法研究
- 试论新课程改革背景下初中数学教学生活化
- 情景教学对初中数学教学的积极影响
- altarless
- altars
- altarwise
- alter
- alterabilities
- alterable
- alterably
- alterate
- alteration
- alterations
- altercation
- altercations
- altered
- alterer
- alterers
- altering
- alternate
- alternate angle
- alternate angles
- alternated
- alternate days/weeks/years etc
- alternately
- alternateness
- alternatenesses
- alternates
- r2022090410005532
- r2022090410005534
- r2022090410005535
- r2022090410005536
- r2022090410005537
- r2022090410005538
- r2022090410005539
- r2022090410005541
- r2022090410005542
- r2022090410005543
- r2022090410005544
- r2022090410005546
- r2022090410005547
- r2022090410005548
- r2022090410005549
- r2022090410005551
- r2022090410005552
- r2022090410005553
- r2022090410005555
- r2022090410005556
- r2022090410005557
- r2022090410005558
- r2022090410005559
- r2022090410005560
- r2022090410005561