李俊香 洪霓 洪日新 刘茜 古勤生


摘? ? 要: 甜瓜(Cucumis melo L.)是我国重要的瓜类经济作物。2015年10月在我国广西武鸣甜瓜主要种植区进行病害调查时发现一种新的叶斑病。该病原菌疑似通常危害植物叶片引起叶斑病的多主棒孢菌。采用形态学观察,多基因鉴定和致病性试验的方法对引起该病的病原菌进行了鉴定。病原菌菌落中间墨绿色,边缘浅褐色,有明显的生长圈,气生菌丝茂密。分生孢子呈圆柱形或倒棍棒形,单生或串生,直立或稍微弯曲,具0~13个隔膜,大小为(3.1~6.4) μm × (14.0~138.9) μm。克隆测定该病原菌的4个保守序列ITS1,2、ITS4,5、ACT和TUB2。分离纯化的病原菌回接到甜瓜幼苗,表现出与田间相似的症状,符合柯赫氏法则,鉴定该病原菌为多主棒孢。该病原菌也可侵染西瓜(Citrullus vulgaris Schrad.)和黄瓜(Cucumis sativus L.)幼苗及离体叶片使其发病。
關键词: 甜瓜; 多主棒孢; 鉴定
Identification of Corynespora cassiicola infecting muskmelon (Cucumis melo L.) in China
LI Junxiang1,2, HONG Ni2, HONG Rixin3, LIU Xi1, GU Qinsheng1
(1. Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, Henan, China; 2. College of Plant Science & Technology, Huazhong Agricultural University, Wuhan 430070, Hubei, China; 3. Horticultural Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, Guangxi, China)
Abstract: Muskmelon (Cucumis melo L.) is one of the most economically important cucurbit crops grown commercially in China. A new leaf spot disease was observed on muskmelon in October 2015, in Wuming, Guangxi province, China. The disease exhibited symptoms of target spot.? Morphological characteristics, multiple-gene sequencing, and pathogenicity tests were used to identify the causal organism. The fungal isolate produced a colony with brownish or greenish concentric growth rings and abundant aerial mycelia. The conidia were solitary, hyaline, cylindrical, oval or obclavate, straight or curve, 0-13-septate and (3.1-6.4) μm × (14.0-138.9) μm. The isolate was sequenced using four genomic loci, from ribosomal DNA internal transcribed spacer sequences [ITS1, ITS2(ITS1,2), ITS4 and ITS5(ITS4,5)], and the actin (ACT), β-tubulin (TUB2) genes. The purified Guangxi isolate infected all tested genotypes of muskmelon, watermelon (Citrullus vulgaris Schrad.), and cucumber (Cucumis sativus L.), in seedlings and detached leaves, and was consistently reisolated from diseased leaves, satisfying Kochs postulates. Our results identified the pathogen as C. cassiicola.
Key words: Muskmelon; Corynespora cassiicola; Identification
多主棒孢[Corynespora cassiicola (Berk. & M. A. Curtis) C. T. Wei]可危害390种亚热带和热带植物[1],寄主范围广泛,属于重要植物病原菌[2]。该病原菌可侵染植物的各个部位,但主要危害植物叶部形成靶斑状病斑[3-4]。葫芦科作物甜瓜是我国重要的经济作物,栽培广泛。多主棒孢在甜瓜上曾经属于次要病害,直到2013年,海南三亚生长后期的甜瓜该病害严重发生,发病株率为30%~50%[5]。2015年10月,中国农业科学院郑州果树研究所西瓜甜瓜病虫害防控实验室在我国广西武鸣甜瓜种植区进行病害调查时发现一种新的叶斑病,典型症状为主要危害甜瓜叶片产生不规则或圆形靶状病斑,棕色或带有黄色晕圈呈轮纹状。将病样带回,进行分离鉴定、形态学观察及致病性分析。
1 材料与方法
1.1 材料
试验于2016年 4—8月在中国农业科学院郑州果树研究所病菌培养实验室进行。供试菌株为多主棒孢(Corynespora cassiicola)甜瓜分离物广西菌株Cc-GX,为本试验室分离鉴定并保存。马铃薯琼脂培养基(Potato Dextrose Agar,PDA):马铃薯去皮切薄片200 g,加水煮沸30 min,双层纱布过滤,加2%葡萄糖,1.5%琼脂,定容至1 L。1.2%水琼脂培养基(Water Agar, WA):琼脂12 g,蒸馏水定容至1 L。0.1 MPa压力下,121 ℃湿热灭菌20 min。
1.2 方法
1.2.1 甜瓜靶斑病的标本采集 2015年10月在我国广西武鸣甜瓜主要种植区进行病害调查时发现甜瓜靶斑病。采集具有典型病斑的甜瓜叶片,带回备用。
1.2.2 病原菌的分离及纯化 通过组织分离培养法,在病健交界处依次将病叶样本切成0.5 cm×0.5 cm近似大小的叶片组织块。再将叶片组织块放入0.5%的次氯酸钠溶液进行表面消毒2 min,随后置于无菌水中漂洗3次并于灭菌的干燥滤纸上晾干,最后接種于PDA平板上,27 ℃恒温箱黑暗培养。3 d后,用接种针挑取病斑组织边缘长出的菌丝,转接到新的PDA上进行纯化培养,并依次转接重复多次以获得纯菌株。然后进行显微形态鉴定,再将纯化菌株转接于PDA斜面,于4 ℃冰箱保存[6]。
1.2.3 病原菌菌落形态观察 将斜面上保存的菌落,转接于PDA平板中,于27 ℃黑暗活化培养5 d。然后,用灭菌的打孔器从菌落边缘打取直径为5 mm的菌饼,再依次将菌饼放置到新的PDA平板中央,每个平板接种1块菌饼。再将接种后的平板置于恒温培养箱中,于27 ℃黑暗培养3、5、7、9 d后观察记录菌落形态。
1.2.4 病原菌分生孢子形态观察 将斜面上保存的菌落,转接于PDA平板中,于27 ℃黑暗活化培养5 d。然后,用灭菌的打孔器从菌落边缘打取直径为5 mm的菌饼,再依次将菌饼放置到新的PDA平板中央,每个平板接种1块菌饼。再将接种后的平板置于恒温培养箱中,于27 ℃黑暗培养20 d使其自然产孢。然后,分别在各平板菌落上加10 mL无菌水,再用灭菌的毛笔扫落孢子,3层擦镜纸过滤获得孢子悬浮液。显微镜观察记录50个分生孢子的形状,测量孢子的大小并拍照。
1.2.5 甜瓜靶斑病菌的分子鉴定 提取甜瓜靶斑病菌菌丝DNA。按以下反应体系和程序进行PCR扩增,引物序列详见表1[7-11]。
ITS1,2的PCR反应体系为:10×PCR Buffer(含Mg2+)2.5 μL;2.5 mmol·L-1 dNTPs 2.0 μL;10 μmol·L-1的上下游引物各1.0 μL;5 U·μL-1的Taq DNA 聚合酶0.5 μL;20 ng·L-1的DNA模板2.0 μL;用ddH2O补齐至总体积25 μL。反应程序:94 ℃预变性 2 min;94 ℃变性1 min,65 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸5 min;4 ℃保温。
ITS4,5的PCR反应体系为:10×PCR Buffer(含Mg2+)4 μL;3.2 mmol·L-1 dNTPs 2.0 μL;10 μmol·L-1的上下游引物各2.0 μL;5 U·μL-1的Taq DNA 聚合酶0.4 μL;20 ng·L-1的DNA模板2.0 μL;用ddH2O补齐至总体积50 μL。反应程序:94 ℃预变性 3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min;4 ℃保温。
ACT的PCR反应为:10×PCR Buffer(含Mg2+)2.5 μL; 2.5 mmol·L-1 dNTPs 2.0 μL;10 μmol·L-1的上下游引物各1.0 μL;5 U·μL-1的Taq DNA 聚合酶0.5 μL;20 ng·L-1的DNA模板2.0 μL;用ddH2O补齐至总体积25 μL。反应程序:94 ℃预变性4 min;94 ℃变性1 min,62 ℃退火1 min,72 ℃延伸1 min,40个循环;72 ℃延伸10 min;4 ℃保温。
TUB2的PCR反应体系为:2×PCR Buffer(含Mg2+)25 μL;2.0 mmol·L-1 dNTPs 10.0 μL;10 μmol·L-1的上下游引物各1.0 μL;1 U·μL-1的KOD FX Neo聚合酶1 μL;20 ng·L-1的DNA模板2.0 μL;用ddH2O补齐至总体积50 μL。反应程序:94 ℃预变性2 min;98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸1 min,30个循环;68 ℃延伸7 min;4 ℃保温。
PCR产物经1%的低熔点琼脂糖凝胶电泳、EB染色后,在凝胶成像系统上观察、拍照。
1.2.6 甜瓜靶斑病菌的致病性鉴定 采用苗期喷施孢子悬浮液和离体叶片孢子接种2种方法,进行致病性测定。将斜面上保存的菌落,转接于PDA平板中,于27 ℃活化培养5 d。然后,用灭菌的打孔器从菌落边缘打取直径为5 mm的菌饼,再依次将菌饼放置到新的PDA平板中央,每个平板接种1块菌饼。再将接种后的平板置于恒温培养箱中,于27 ℃黑暗培养20 d使其自然产孢。然后,分别在各平板菌落上加10 mL无菌水,再用灭菌的毛笔扫落孢子,3层擦镜纸过滤获得孢子悬浮液。在显微镜下,采用血球计数板计数,并用无菌水将孢子浓度调至1×105孢子·mL-1。
苗期喷施孢子悬浮液接种。28 ℃温室播种甜瓜(‘好运8,购自广西农业科学院园艺研究所)、西瓜(‘红和平,购自浙江浙农种业有限公司)和黄瓜(‘黑优301,购自河南豫艺种业科技发展有限公司)种子,2周后进行接种。每个品种接种10株苗,3次重复,处理苗喷雾接种孢子悬浮液,对照喷雾接种无菌水。接种后于28 ℃温室先黑暗保湿培养48 h,然后再进行常规管理。接种2周后观察症状。如果接种叶片出现扩大的病斑则认为该病原菌有致病性,否则没有。
离体叶片接种孢子悬浮液致病性测定。于28 ℃温室播种甜瓜(‘好运8), 西瓜(‘红和平)和黄瓜(‘黑优301)种子,采集生长11~14 d的种苗真叶。离体叶片用0.5%的次氯酸钠溶液进行表面消毒2 min,随后置于无菌水中漂洗3次并于灭菌的干燥滤纸上晾干。晾干后的叶片置于1.2%的WA平板上,每个叶片于不同位置接种5滴孢子悬浮液(1×105 孢子·mL-1),每个位置接种1滴,每滴10 μL,对照接种无菌水,于恒温箱里28 ℃黑暗保湿培养。每个处理3次重复。3 d后观察症状,如果叶片接种位点出现病斑,则认为有致病性,否则没有致病性。
1.3 仪器设备
主要仪器设备:显微镜(Olympus BX51,东京,日本),血球计数板(XB-K-25,上海求精生化试剂仪器有限公司),光照培养箱(GXM-250BS,宁波市科技园区新江南仪器有限公司),洁净工作台(DL-CJ-2N,北京东联哈尔仪器制造有限公司)。
2 结果与分析
2.1 甜瓜靶斑病的田间症状
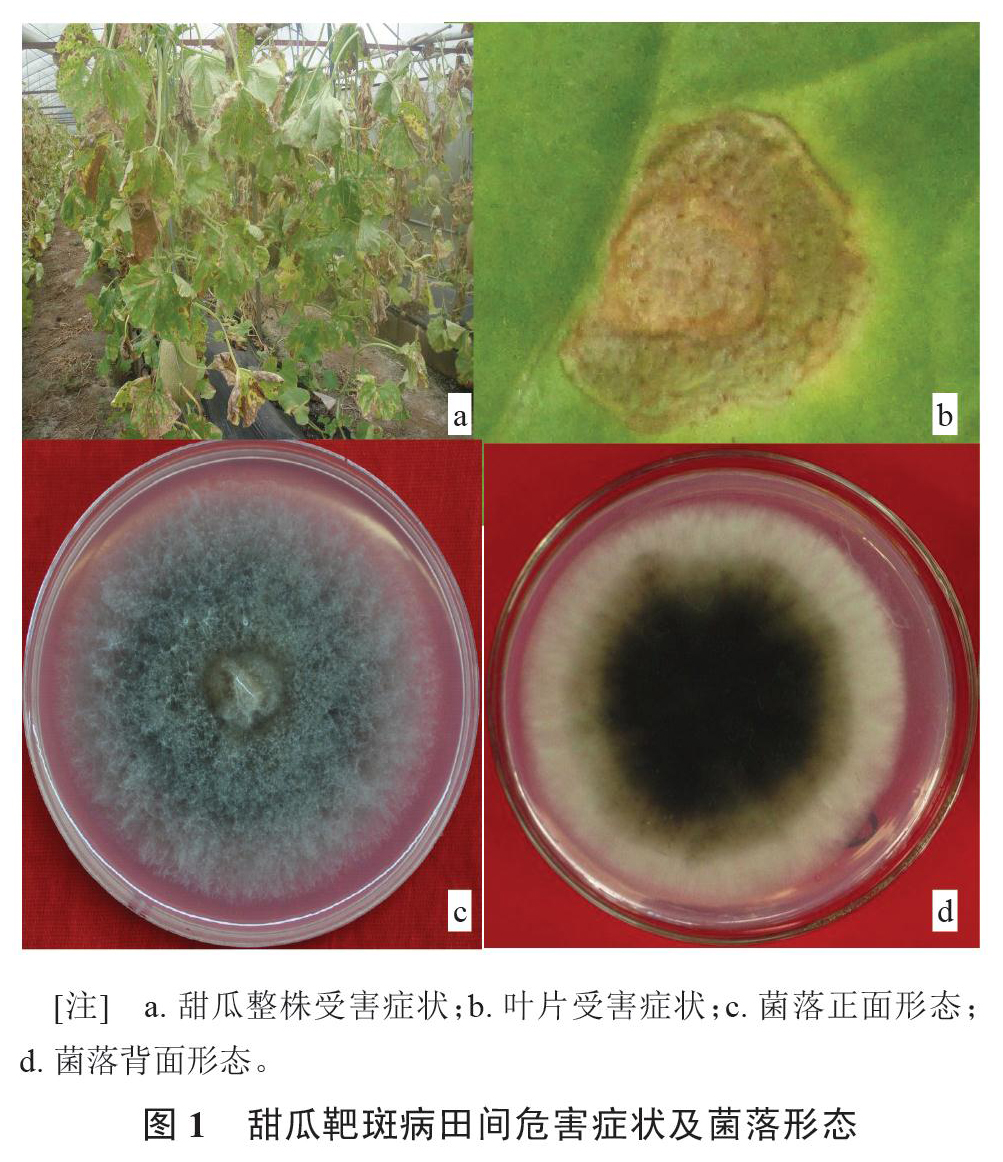
2015年10月在我国广西武鸣甜瓜主要种植区进行病害调查时发现甜瓜靶斑病,发病率100%(图1-a)。该病害典型症状表现为仅危害叶片,发病初期病斑为黄褐色或淡褐色小点。病斑扩展后,叶片正面病斑略微凹陷,病斑近圆形,病斑中部淡黄色,边缘颜色稍深,棕色或褐色,有时有黄色晕圈呈现明显轮纹状(图1-b)。后期,病斑扩大,受叶脉限制,呈现不规则形或圆形,病斑融合,严重时叶片大面积干枯死亡,造成提早拉秧。
2.2 甜瓜靶斑病菌菌落形态
甜瓜靶斑病病原菌,27 ℃黑暗条件下,在PDA上培养3 d后,菌落直径3 cm,菌丝白色,均匀地向四周扩散,菌落疏松。5 d后,菌落直径5 cm,中央0.1~0.2 cm范围内颜色变深,呈浅褐色,菌丝生长紧密,上面隆起,菌落边缘颜色稍浅,菌落表面覆有大量气生菌丝。7 d后,菌落颜色加深明显,中间墨绿色,边缘浅褐色,菌落圆形,生长均匀。9 d后,菌落直径约达到9 cm,基内菌丝产生深褐色色素,形成轮纹状的产孢区(图1-c与1-d)。
2.3 甜瓜靶斑病病原菌显微形态
甜瓜靶斑病病原菌在显微镜下菌丝呈半透明状,具有分枝和隔膜,细胞壁光滑。该病原菌的分生孢子梗是由成熟的菌丝衍化来的,颜色偏棕,单生,直立或弯曲,有分隔。分生孢子顶生,多呈圆柱形或倒棍棒形,少有纺锤形,偶见“Y”字形,单生或串生,直立或稍微弯曲,呈半透明或浅橄榄色,具有0~13个假隔膜。PDA培养基上,分生孢子大小多样化,为(3.1~6.4) μm × (14.0~138.9) μm(图2)。
2.4 甜瓜靶斑病菌分子鉴定
提取甜瓜靶斑病病原菌的全基因组DNA并纯化。以全基因组DNA为模板,分别使用4对特异引物对应扩增ITS1,2、ITS4,5、ACT和TUB2基因片段。扩增片段经1%的琼脂糖凝胶电泳检验,均完全符合目的片段的大小(图3)。扩增片段经纯化、序列测定后,在NCBI数据库进行序列比对。结果表明,病原菌为多主棒孢。
2.5 甜瓜靶斑病菌致病性测定
采用植物苗期喷施孢子悬浮液和离体叶片孢子接种两种方法,进行致病性测定。
孢子悬浮液喷雾接种2周大的甜瓜(‘好运8),西瓜(‘红和平)和黄瓜(‘黑优301)幼苗。接种后于28 ℃温室保湿黑暗培养2 d,然后28 ℃温室常规管理。接种2周后观察症状发现,甜瓜靶斑病菌广西分离株可侵染甜瓜、西瓜和黄瓜。不同作物发病初期,叶面病斑均表现为黄褐色或淡褐色小点。之后,甜瓜上病斑扩展,叶片正面病斑略微凹陷,病斑近圆形,病斑中部淡黄色,边缘颜色稍深,棕色或褐色,有时有黄色晕圈呈现明显轮纹状。西瓜上,病斑偏小,扩展有限。黄瓜上,病斑密集,病斑大小居中(图4)。
甜瓜(‘好运8),西瓜(‘红和平)和黄瓜(‘黑优301)28 ℃温室生长11~14 d的种苗真叶离体叶片接种孢子悬浮液滴致病性测定。接种后,于恒温箱里28 ℃黑暗保湿培养3 d。观察症状发现甜瓜、西瓜和黄瓜离体叶片在接种点处均有病斑出现,病斑呈黄褐色或淡褐色,并均可观察到少量菌丝。不同作物病害症状差别不大(图5)。
从孢子悬浮液喷雾接种的甜瓜幼苗上采集发病叶片,重新分离鉴定,发现病原菌是多主棒孢。且接种甜瓜幼苗表现出与病害调查时田间相似的症状,说明病害鉴定正确,符合柯赫氏法则。
3 讨 论
2015年10月在我国广西武鸣甜瓜主要种植区进行病害调查时发现一種新的叶斑病,受害叶片经分离鉴定确定其病原菌为多主棒孢。在PDA平板上,病原菌菌落圆形,中间墨绿色,边缘浅褐色,该广西分离株菌落颜色比报道的三亚分离株偏深,但同样有生长圈,分生孢子比其偏小,但隔膜范围更大[5]。更早的研究认为多主棒孢分生孢子大小具有更大程度的多样性,但隔膜偏多[12]。这种差异可能是不同地区,不同作物分离的不同菌株导致的。
多主棒孢传统的鉴定方法基于形态特征,但是这给相似近源种的区分增加了困难。如果仅仅通过形态学鉴定,可能会产生各种各样的偏差。本研究通过PCR扩增得到该病原菌的4个保守序列ITS1,2、ITS4,5、ACT和TUB2,序列比对结果进一步证明该病原菌属于多主棒孢。因为多主棒孢寄主范围广泛,可侵染番茄[13-14]、烟草[15]、黄瓜[9]、棉花[16]、大豆[17-18]、芝麻[19]、橡胶[20]等多种作物,采用多基因鉴定,结果更加准确。
致病性测定是病原菌鉴定的关键步骤之一,多主棒孢尤其如此,因为多主棒孢的有些菌株可侵染多种植物[21],而另外一些菌株则表现出寄主专一性[22-25]。笔者发现,多主棒孢甜瓜分离物广西菌株既可以侵染甜瓜,也可侵染西瓜和黄瓜,而这3种葫芦科作物是我国广泛种植的重要经济作物。目前有很多关于黄瓜上多主棒孢的研究,而甜瓜上鲜有报道。正确的诊断和鉴定病原菌是制定病害防控策略的先决条件,笔者在本研究中揭示了多主棒孢在甜瓜上的危害及流行风险(该病害很有可能从次要病害上升为主要病害),以期为病害防治提供依据。
參考文献
[1] FARR D F,ROSSMAN A Y.Fungal Databases,Systematic mycology and microbiology Laboratory,ARS,USDA [DB].[2016-08-31].http://nt.ars-grin.gov/fungaldatabases/index.cfm.2016.
[2] WEI C T.Notes on Corynespora [J].Mycological Papers,1950,34:1-9.
[3] SILVA W P K,MULTANI D S,DEVERALL B J,et al.RFLP and RAPD analyses in the identification and differentiation of isolates of the leaf spot fungus Corynespora cassiicola [J].Australian Journal of Botany,1995,43(6):609-618.
[4] SILVA W P K,WIJESUNDERA R L C,KARUNANAYAKE E H,et al.New hosts of Corynespora cassiicola in Sri Lanka [J].Plant Disease,2000,84(2):202-202.
[5] 王爽,黄贵修,李博勋,等.甜瓜棒孢叶斑病病原菌鉴定及其生物学特性研究[J].热带作物学报,2013,34(12):2446-2452.
[6] 方中达.植病研究方法[M].北京:中国农业出版社,1988:64-124.
[7] QI Y X,ZHANG X,PU J J,et al.Nested PCR assay for detection of Corynespora leaf fall disease caused by Corynespora cassiicola[J].Australasian Plant Pathology,2009,38(2):141-148.
[8] WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].London:Academic,1990,18(1):315-322.
[9] 陈璐,石延霞,谢学文,等.黄瓜棒孢叶斑病菌PCR检测方法的建立[J].园艺学报,2014,41(3):585-592.
[10] O'DONNELL K,CIGELNIK E.Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous[J].Molecular Phylogenetics and Evolution,1997,7(1):103-116.
[11] GLASS N L,DONALDSON G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J].Applied and Environmental Microbiology,1995,61(4):1323-1330.
[12] QI Y X,ZHANG X,PU J J,et al.Morphological and molecular analysis of genetic variability within isolates of Corynespora cassiicola from different hosts[J].European Journal of Plant Pathology,2011,130(1):83-95.
[13] BLAZQUEZ C H.Target spot of tomato [J].Plant Disease Reporter 1972,56(3):243-245.
[14] MOHANTY N N,MOHANTY N W.Target spot of tomatoes[J].Science and Culture,1955,21(6):330-332.
[15] FAJOLA A O,ALASOADURA S O.Corynespora leaf spot,a new disease of tobacco (Nicotiana tabacum) [J].Plant Disease Reporter,1973,57(4):375-378.
[16] JONES J P.A leaf spot of cotton caused by Corynespora cassiicola[J].Phytopathology,1961,51(5):305-308.
[17] SEAMAN W L,SHOEMAKER R A.Corynespora cassiicola on soybean in Ontario [J].Plant Disease Reporter,1964,48(1):69.
[18] OLIVE L S,BAIN D C,LEFEBVRE C L.A leaf spot of cowpea and soybean caused by an undescribed species of Helminthosporium [J].Phytopathology,1945,35(10):822-831.
- 校园招聘切忌“走马观花”
- 浅谈精细化管理在中小学教育管理中的应用
- 浅谈精细化管理在高校教学管理中的运用
- 高校成人教育管理中人本管理的渗透与体现
- 法治理念下大学生教育管理创新研究
- 大学生参与高校管理的模式构建
- 刍议中国特色现代大学制度的建设思路
- 工业统计在企业经济管理中的作用分析
- 浅谈大数据背景下经济统计的机遇与挑战
- 城市环:卫规划现状及其改善探讨
- 纯电动汽车的维护与保养
- 论如何提高汽车驾驶员预防事故的能力
- 浅谈纯电动汽车在我国的发展及推广
- 发展全域旅游,推动山区县“绿富关”发展
- 社区基地建设与特色读本开发双向整合
- 高校思想政治理论课教师的责任意识研究
- 浅谈信息化教学大赛对职校教师信息素养的提升
- 浅谈西藏地区中职教师面临的机遇与挑战
- 名师工作室促进教师专业成长的实践研究
- 中职学校专业课教师教学能力提升的策略研究
- 浅谈教师远程培训与校本研修相辅相成
- 谈如何提高入职教师的教学质量
- 利用微信公众平台创新教师培训模式
- 刍议如何提高中职班主任工作的有效性
- 浅谈技工院校班主任德育教育工作
- all over
- all over again
- all over the place
- all over the world
- all-over-with
- allow
- allowable
- allowableness
- allowablenesses
- allowables
- allowably
- allowance
- allowanced
- allowances
- allowancing
- allowed
- allow/enable
- allower
- allow for
- allow-for
- allow for sb/sth
- allow for sth
- allowing
- allows
- allow sb to do sth/let sb do sth
- 双高田
- 双鬟
- 双鱼
- 双鱼尺素
- 双鱼座
- 双鲤
- 双鲤鱼
- 双鸟在林,不如一鸟在手
- 双鸠关关
- 双鸦
- 双鸳
- 双鹄冲霄
- 双鹅
- 双鹅飞
- 双鹅飞洛
- 双鹰国
- 双黄
- 双黄蛋
- 双黄蛋——一身二心
- 双黄鸡蛋——两个心
- 双龙
- 双龙出海
- 双龙洞
- 反
- 反三角函数