熊大维 顾斌涛 刘兰 黄筱萍


摘要?从采摘后贮存自然发病的赣南脐橙中分离出4种病原真菌,根据菌株形态学观察和rDNA-ITS序列分析进行鉴定,这4种病原真菌分别为意大利青霉(Penicillium?italicum)、指状青霉(Penicillium?digitatum)、柑橘链格孢(Alternaria?citri)和芽枝状枝孢(Cladosporium?cladosporioides)。生物保鲜剂2-苯乙醇(2-PE)可有效地抑制这4种病原真菌的孢子萌发和菌丝生长,但对不同致腐菌抑菌效果差异显著(P<0.05)。2-PE对芽枝状枝孢霉、指状青霉菌、柑橘链格孢和意大利青霉菌菌丝生长的最小抑菌浓度分别为1.4、1.8、2.2和2.4?g/L。
关键词?脐橙病原菌;形态学观察;分子鉴定;2-苯乙醇;抑菌
中图分类号?TS255.3文献标识码?A文章编号?0517-6611(2020)07-0186-04
doi:10.3969/j.issn.0517-6611.2020.07.053
Isolation?and?Identification?of?Citrus?Pathogens?from?Navel?Orange?in?Southern?Jiangxi?Province?and?Sensitivity?Analysis?to?2Phenylethanol?Alcohol
XIONG?Dawei,?GU?Bintao,?LIU?Lan?et?al
(Institution?of?Microbiology,?Jiangxi?Academy?of?Sciences,?Nanchang,?Jiangxi?330096)
Abstract?Four?citrus?pathogens?were?isolated?from?rotten?orange?of?Southern?Jiangxi?Province?after?harvesting.?According?to?the?observation?of?the?morphological?characteristics?of?fungi?and?the?analysis?of?rDNAITS?sequence,?the?four?citrus?pathogens?were?identified?as?Penicillium?italicum,?Penicillium?digitatum,?Alternaria?citri?and?Cladosporium?cladosporioides.?The?biopreservative?2phenylethyl?alcohol?can?effectively?inhibit?the?spore?germination?and?hyphae?growth?of?the?four?citrus?pathogens,?but?the?antibacterial?effects?of?different?saprophytic?fungi?were?significantly?different?(P<0.05).?The?minimum?inhibitory?concentrations?for?the?hyphae?growth?of?C.?cladosporioides,?P.?digitatum,?A.?citri?and?P.?italicum?were?1.4,?1.8,?2.2?and?2.4?g/L,?respectively.
Key?words?Citrus?pathogens;Morphological?observation;Molecular?identification;2Phenylethanol?alcohol;Antibacterial
基金项目?江西省重点研发项目(S2018ZPYFE1016);江西省科學院重大研究专项(2018-YZD1-03)。
作者简介?熊大维(1975—),男,江西靖安人,助理研究员,从事微生物学研究。通信作者,研究员,硕士,从事生物工程及生物活性产物的制备和应用研究。
收稿日期?2019-10-09;修回日期?2019-10-28
近年来,我国柑橘产业发展迅猛,年产量超过2?900万t,由于成熟度相对集中,其贮藏加工业的发展远远滞后于种植业,每年鲜果在采摘后贮藏、运输和销售环节的损失巨大,果品腐烂率为10%~40%[1-2],造成重大的经济损失。引起柑橘腐烂的病害有20多种,其中约90%的柑橘采后腐烂是由意大利青霉引起的青霉病,指状青霉引起的绿霉病和链格孢霉引起的黑腐病[3-7]。目前主要采用化学防腐剂进行防腐保鲜,由于存在病原菌对化学制剂易产生抗药性,且对人体健康具有一定危害和造成环境污染,已被陆续禁止使用[8-9]。
2-苯乙醇(2-PE)是一种具有玫瑰气味的芳香醇,广泛存在于自然界中,具有广泛的抗菌活性,可抑制大肠杆菌等G-菌和枯草芽孢、金黄色酿脓葡萄球菌等G+菌的生长,对酵母菌、青霉菌等真菌亦具有显著的抑制作用[10-12]。其在食品防腐保鲜上的研究也已经开展,刘普[13]研究表明生防菌柠檬形克勒克酵母菌对柑橘采后青、绿霉菌具有很好的防治效果,分离获得对抑制真菌的有效成分为该菌产生的2-PE。方静凡[14]发现2-PE对导致水果(如柑橘、苹果、葡萄等)腐败的许多真菌具有良好的防治效果,并对其最低抑菌浓度和抑菌机理进行了初步研究;采用产2-PE的酵母菌液涂抹,在果品上形成菌膜以达到生防效果。陈利军等[15]发现2-PE对植物病原真菌如草莓灰霉病菌、白菜黑斑病菌等具有显著的抑菌效果。
该研究从自然腐烂的脐橙中分离获得4种致腐真菌,通过形态学观察和分子学鉴定,确定了其种、属。针对这些致腐真菌,采用生物法转化合成的2-PE进行了抑菌试验,确定了2-PE对不同真菌的孢子萌发最小抑菌浓度(MIC)和菌丝生长最小抑菌浓度。由于2-PE具有较好的水溶性和稳定性,安全无毒,对真菌有较好的抑制作用,可开发为一种新型的生物防腐剂用于果蔬、食品的保鲜,为今后的植物病原菌的抑菌试验和抑菌机制研究提供基础。
1?材料与方法
1.1?材料与仪器
脐橙摘自赣州(信丰县和安远县)不同果园,置通风处保存。2-PE粗提液,是由本实验室生物转化液经乙醇抽提浓缩而成的质量分数为80%~90%粗制品[16];马铃薯葡萄糖琼脂(potato?dextrose?agar,PDA)培养基,北京奥博星生物技术有限责任公司。
BX53型显微镜(日本Olympus公司);Prachfum?224-1CN分析天平(德国Sartorius公司);L204电子天平(梅特勒-托利多仪器(上海)股份有限公司);MJX-250B-Z霉菌培养箱(上海博迅医疗生物仪器有限公司);CD-AX数显式游标卡尺(世达工具(中国)有限公司);SW-CJ-ID型双人净化工作台(苏州净化设备有限公司);LDZX-50KBS手轮型立式蒸汽灭菌锅(上海申安仪表有限公司)。
1.2?方法
1.2.1?菌种分离纯化与鉴定。选择具有典型发病症状的脐橙,用75%乙醇清洗患处表面,再用无菌刀片切取病患交界处5?mm×5?mm的组织,用2%NaClO溶液表面消毒,无菌水冲洗3次,接入PDA平板培养基上,于(28±0.5)℃倒置培养,待菌丝长出后,用无菌接种针挑取前缘菌丝植入另一培养基内培养,重复上述操作3次即可获得纯化菌株。
1.2.2?真菌种属鉴定。
1.2.2.1?病原真菌形态学鉴定。通过观察病原体菌落特征和培养特佂,包括菌落大小、颜色、边缘、渗出物等,在显微镜下观察菌丝生长情况、孢子形态、产孢结构及有无横隔的特征,进而进行显微形态分类鉴定。参照真菌鉴定手册进行病原菌的初步鉴定[17]。
1.2.2.2?病原真菌的rDNA-ITS序列分析。
采用rDNA-ITS分子鉴定法对病原菌株进行分析。以不同病原菌的DNA作为模板,用通用引物扩增出约550?bp的rDNA-ITS序列,PCR反应条件:预变性94?℃?3?min;变性95?℃?1?min,退火54?℃?40?s,延伸72?℃?40?s,35个循环;终延伸72?℃?10?min,保温4?℃?60?min。PCR产物经琼脂糖凝胶电泳,于上海生物工程有限公司完成测序。将测序获得rDNA-ITS序列在GenBank核酸数据库中进行Blast搜索比对。
1.2.3?2-PE对病原真菌孢子萌发率的影响。将4种病原菌株分别于PDA斜面培养基中28?℃培养6?d,分别加入10?mL无菌水,用玻璃棒洗下孢子,菌液再分别倒入20?mL注射器中,经4层无菌纱布过滤,收集孢子液,于4?℃冰箱贮存备用。用血球计数器计数孢子浓度,稀释孢子液为10-4和10-5,涂布于含2-PE分别为0.2、0.4、0.6、0.8、1.0、1.2?g/L的培养基中,以不加2-PE的平皿为对照,每个梯度涂布3皿,于28?℃培养3~6?d,计算孢子萌发率。
孢子萌发率(%)=处理平皿中菌落数对照平皿中菌落数×100(1)
1.2.4?菌丝生长抑制率的测定(采用菌丝生长速率测定法)。将4种病原菌孢子液分别涂布于PDA平皿中,于28?℃培养6~7?d,用打孔器在培养基上打孔,取生长一致的菌苔,备用。配制含2-PE浓度为0.4、0.8、1.2、1.4、1.6、1.8、2.0、2.2、2.4?g/L的培养基,用量杯量取等量体积倒入平皿中,用¢5?mm打孔器切取生长一致的病原菌菌块,移植于含药剂的平皿中,每块平皿植入3块菌苔做平行试验,另设加无菌水的PDA培养基平板作为对照。置于28?℃生化培养箱中培养,用游标卡尺测量菌落直径,取?120?h的菌落平均值計算菌丝生长抑制率,测定2-PE对病原菌的抑菌率[18]。
菌丝生长抑制率(%)=对照菌落直径-处理菌落直径对照菌落直径-菌饼直径×100(2)
2?结果与分析
2.1?病原真菌的形态学鉴定
在真菌识别中,有形态学识别,如菌落形态、颜色、在不同时间的生长状态、菌丝及孢子的形态及大小等。从自然腐烂的脐橙中分离出4种真菌,分别编号为FZ-1、FZ-2、FZ-3和FZ-4,菌落形态及孢子生长描述如下。
2.1.1?FZ-1菌株。菌株在PDA培养基培养2?d后,菌落表面平整呈白色,少许菌落中间略微凸起并附有青绿色孢子,菌落稀疏蓬松;培养3?d后,菌落表面仍平整,表面呈青绿色,边缘呈白色,表面附有青绿色孢子,菌落稀疏蓬松。菌丝体由分枝的、分隔的、光滑的、透明至半透明的菌丝构成,菌丝2.7~6.0?μm宽。分生孢子梗与菌丝异形或同形,单菌丝构成,透明至半透明,光滑,薄壁,有分隔,分枝或不分枝,圆柱形,3.3~9.0?μm宽。产孢细胞单点芽植型产孢,(14.0~26.0)?μm×(3.0~4.2)μm,轮生,每轮2~4个倒棒状或近圆柱形的产孢细胞,顶部变细,中间略膨大,基部平截,透明,顶生或侧生,光滑。分生孢子全壁芽植型,单生,孢子呈链状向上生长,质地干,未成熟时透明,成熟后半透明至淡灰黑褐色,光滑,壁薄,基部平截,顶部圆滑,无隔膜,部分近球形至球形,椭球形或倒卵形(5.0~12.5)μm×(4.2~10.1)μm(=7.8?μm×6.0?μm,n=45);部分近圆柱形(8.4~24.0)?μm×?(2.8~5.5)μm(=15.0?μm×4.3?μm,n=35);分生孢子裂解式脱落。还有一部分非常小的分生孢子,近球形或椭球形至球形(3.2~6.0)μm×(2.8~4.3)μm(=?4.2?μm×3.3?μm,n=45)。图1为FZ-1的菌落形态及菌丝和孢子生长状态。
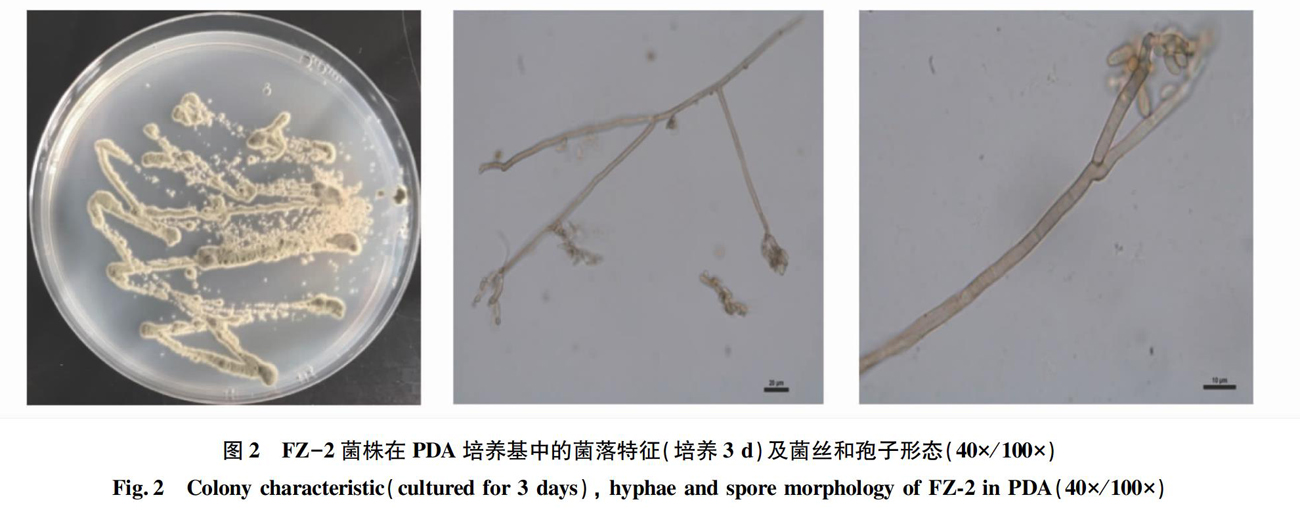
2.1.2?FZ-2菌株。菌株在PDA培养基上培养2?d后,菌落表面凸起呈灰色,边缘菌丝呈白色,表面附有灰色的孢子,菌落浓密紧凑;培养3?d后,菌落表面仍凸起且颜色加深,边缘菌丝呈白色,表面附着大量的孢子,菌落浓密紧凑。菌丝体由分枝的、分隔的、光滑的、透明至淡灰褐色的菌丝构成,菌丝2~4?μm宽。分生孢子梗与菌丝异形或同形,单菌丝构成,半透明或浅褐色至中褐色,光滑,薄壁,有分隔,分枝或不分枝,圆柱形至近杯状,3~4?μm宽。产孢细胞多点芽植型产孢,半透明至浅褐色,与分生孢子梗整合,光滑,(9.0~28.0)?μm×(2.5~5.0)μm(=?12.7?μm×?3.7?μm,n=20),内部有细小油滴。分生孢子全壁芽植型,多生,孢子呈链状向上生长,质地干,透明至浅褐色,近球形至球形,椭球状到近纺锤形或倒卵形,部分近圆柱形,基部和顶部平截,最顶端孢子基部平截,顶部圆滑,0-1(-2)隔,光滑,壁薄,(3.8~11.0)×(2.6~4.5)μm(=?6.8?μm×3.4?μm,n=50);分生孢子裂解式脱落(图2)。
2.1.3?FZ-3菌株。菌株在PDA培养基上培养2?d后,菌落浓密不紧凑,表面灰白色至浅褐色,表面菌丝清晰可见,菌丝较分散,菌落中央无凸起,边缘菌丝呈白色;培养3?d后,菌落浓密不紧凑,颜色呈灰白色至深褐色,培养基反面深褐色至黑色。菌丝体堆在一起褐色;菌丝分枝,具隔膜,半透明至深褐色,表面光滑,壁薄,宽2.5~6.4?μm(3.8?μm,n=40)。分生孢子梗宽2.2~5.3?μm(3.9?μm,n=25),顶端产孢,表面光滑,褐色至中褐色。产孢细胞圆柱形,浅褐色至褐色,在分生孢子梗的顶端。分生孢子单生,顶生,(15.0~36.0)?μm×(8.0~15.2)μm(23.6?μm×11.3?μm,n=40),基部平截2.4~4.5?μm(3.5?μm,n=40),隔膜网格状,具横隔膜和纵隔膜,横膈膜较多1~6个隔膜,纵隔膜一般1个,分孢子呈卵形、纺锤形,棍棒状、球形至椭球形,浅褐色至中褐色,表面光滑,壁薄(图3)。
2.1.4
FZ-4?菌株。菌株在PDA培养基上培养2?d后,菌落浓密紧凑,表面灰白色,菌落中央凸起呈灰白色,边缘菌丝呈白色;培养3?d后,菌落表面呈灰白色至浅青色,菌落浓密,表面可见灰白色孢子,培养基反面棕黄色。菌丝分枝,具隔膜,透明至浅色,表面光滑,壁薄。分生孢子梗宽2.6~4.5?μm(3.5?μm,n=20),表面光滑,透明至浅色,产孢细胞顶端集中呈扫帚状。产孢细胞顶生,烧瓶形瓶梗,(8.0~25.0)μm×(2.0~3.0)μm(16.1?μm×?2.6?μm,n=20),透明,壁薄,基部寬顶部窄。分生孢子顶生,数量非常多,散射状,(2.8~7.6)μm×(2.05~4.8)μm(4.55?μm×?2.88?μm,n=70),无隔膜,球形、椭球形至长椭球形,浅褐色至透明,表面光滑,壁薄(图4)。
2.2?病原真菌的分子学鉴定
利用18S和28S的上下游引物序列,得到以上4种病原菌菌株的序列结果(表1),与NCBI?Blast?上的已知序列进行比对,以确定病原真菌种或亚种。
由表1可知,利用rDNA-ITS鉴定4种脐橙病原真菌分别如下:FZ-1为指状青霉(Penicillium?digitatum),FZ-2为芽枝状枝孢霉(Cladosporium?cladosporioides),FZ-3为柑橘链格孢(Alternaria?citri),FZ-4为意大利青霉(Penicillium?italicum),与各自源物种的同源性均达100%。
2.3?不同质量浓度的2-PE对4种病原真菌孢子萌发率的影响
2-PE对细胞具有一定的毒性,其抑菌作用主要是通过增加细胞膜的通透性而扰乱跨膜质子电势,以及作为大分子合成的抑制剂抑制细胞内蛋白质和RNA的合成。不同的微生物对2-PE的耐受性不同,通常质量浓度为0~2?g/L的2-PE可抑制大部分微生物生长,当质量浓度达4?g/L可完全抑制酵母菌生长[19]。由表2可知,2-PE对4种病原菌孢子萌发均有显著(P<0.05)的抑制效果,在浓度为0.6?g/L时可全部抑制柑橘链格孢和芽枝状枝孢霉的孢子萌发,对指状青霉和意大利青霉的最低孢子萌发抑制浓度分别为0.8和1.2?g/L,2-PE对意大利青霉的孢子萌发率抑制效果较弱。
2.4?不同质量浓度的2-PE对4种病原真菌的抑菌效果
2-PE对柑橘致腐菌均有很好的抑菌作用(表3)。在一定质量浓度下,2-PE对芽枝状枝孢霉的抑制效果最好,其次为指状青霉和柑橘链格孢,对意大利青霉的抑制效果相对较弱。其最小抑菌浓度(MIC)分别为1.4、1.8、2.2、2.4?g/L,即2-PE浓度达2.4?g/L时,可完全抑制4种病原菌菌丝的生长。方静凡[14]采用2-PE对多种果实病原真菌的抑菌谱进行检测,2-PE浓度为0.2%~0.4%(V/V)时可完全抑制柑橘绿霉菌、黑腐菌、炭疽菌,苹果青霉菌和灰霉菌等多种致腐真菌的生长,对意大利青霉菌B3的最小抑菌浓度MIC为0.25%(V/V)。
3?结论
从不同地区自然腐烂的脐橙中分离纯化出4种病原真菌,通过观察菌落形态,菌丝生长,分生孢子形状、大小及分生孢子梗形态等对其进行鉴定,由于真菌生长条件改变,菌丝的生长形态会有改变、厚垣孢子难形成和观察,分生孢子在形态学上差异小,对菌丝、孢子的描述困难,较难区分多种菌株之间的差异。随着分子生物学技术的发展,rDNA-ITS被广泛应用于果蔬类采后病原菌的分离和鉴定[20-22]。通过18S?rDNA测序以及在GenBank核酸数据库中进行Blast比对,结果表明这4种柑橘致腐菌分别为意大利青霉、指状青霉、柑橘链格孢和芽枝状枝孢霉。其中意大利青霉、指状青霉和柑橘连格孢为引起柑橘采后腐烂的主要病原真菌。利用分子学技术进行辅助鉴定,可以鉴定出亲缘关系较近的种、属。
2-苯乙醇对柑橘致腐菌的孢子萌发和菌丝生长均有较强的抑制效果,2-PE可在较低的质量浓度下完全抑制真菌孢子萌发,相较于酵母菌和真菌菌丝,真菌孢子对2-PE具有更高的敏感性,可能是孢子在萌发过程中蛋白质和RNA的合成更易受到2-PE的抑制。在相同的质量浓度下,2-PE抑制4种病原真菌孢子萌发的强弱顺序依次为芽枝状枝孢、柑橘链格孢、指状青霉、意大利青霉,浓度为1.2?g/L时可完全抑制病原菌孢子的萌发。而在相同的质量浓度下,2-PE对芽枝状枝孢霉菌生长的抑菌效果最强,其次为指状青霉、柑橘链格孢,对意大利青霉抑菌较弱,在浓度为2.4?g/L时可完全抑制4种病原真菌的生长。该研究从采后腐烂的赣南脐橙中分离出主要的致腐真菌,并采用生物转化的2-PE进行了抑菌效果评价,为进一步开发新型果蔬保鲜生物保鲜剂2-PE奠定了基础。
参考文献
[1]?LADANIYA?M?S.2Commercial?fresh?citrus?cultivars?and?producing?countries:Citrus?fruit[M].2rd?ed.San?Diego:Academic?Press,2008:13-65.
[2]?刘浩强,李鸿筠,向可海,等.保鲜剂对柑橘贮藏病菌的敏感性及贮藏保鲜效果[J].食品科学,2014,35(4):210-214.
[3]?TALIBI?I,BOUBAKER?H,BOUDYACH?E?H,et?al.Alternative?methods?for?the?control?of?postharvest?citrus?disease[J].Journal?of?applied?microbiology,2014,117(1):1-17.
[4]?万春鹏,陈楚英,陈明,等.肉桂提取物对赣南脐橙的保鲜效果[J].食品工业科技,2015,36(17):317-321.
[5]?楊文侠,邓利珍,周亮,等.植物提取液对脐橙致腐青霉菌的抑菌研究[J].食品科技,2013,38(12):238-241.
[6]?张兰,李节法,陈东奎,等.柑桔采后病害新型生物防控保鲜剂研究进展[J].广西农学报,2016,31(5):59-63.
[7]?张良,刘媛洁,肖勇生,等.响应面法优化柑橘复合生物保鲜剂配方[J].食品工业科技,2016,37(16):340-345,356.
[8]?熊亚波,闫晓俊,颜静,等.新型柑橘贮藏保鲜剂的研究进展[J].食品科学,2015,36(9):284-288.
[9]?邓雨艳,曾凯芳.柑橘果实采后侵染性病害防治技术研究进展[J].食品科技,2008,33(4):211-214.
[10]?苗潇潇.玫瑰花露香气成分分析及其抑菌作用的初探[D].太原:山西大学,2017:39-48.
[11]?王军喜,赵文红,韩珍,等.玫瑰露抑菌效果研究[J].广东农业科学,2012(3):79-80,90.
[12]?邓雨艳,曾凯芳.柑橘果实采后侵染性病害防治技术研究进展[J].食品科技,2008,33(4):211-214.
[13]?刘普.柑橘采后生防菌柠檬形克勒克酵母(34-9)产生的活性物质及其他抑菌机制的研究[D].武汉:华中农业大学,2011:43-52.
[14]?方靜凡.苯乙醇对柑橘青霉及生防菌34-9的作用研究[D].武汉:华中农业大学,2013:21-25.
[15]?陈利军,王国君,田雪亮,等.产香真菌ZY-2菌株鉴定及其挥发性物质抑菌活性测定与组分分析[J].南方农业学报,2013,44(11):1818-1822.
[16]?黄筱萍,刘兰,熊大维,等.酵母静息细胞耦合原位分离技术连续转化2-苯乙醇?[J].食品与发酵工业,2018,44(10):20-24.
[17]?魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[18]?刘浩强,李鸿筠,向可海,等.保鲜剂对柑橘贮藏病菌的敏感性及贮藏保鲜效果[J].食品科学,2014,35(4):210-214.
[19]?梅建凤.利用酶母细胞生物转化法合成天然2-苯乙醇的研究[D].杭州:浙江大学,2009:15-39.
[20]?YANG?L?Z,ZHOU?L,YU?H,et?al.Isolation?and?identification?and?antifungal?activity?of?a?Penicillum[J].Acta?agriculture?boreali?occidentalis?sinica,2009,18(4):98-102.
[21]?YU?T,LI?H?Y,ZHENG?X?D.Synergistic?effect?of?chitosan?and?Cryptococcus?laurentii?on?inhibition?of?Penicillus?expansum?infections[J].International?journal?of?food?microbiology,2007,114(3):261-266.
[22]?张翠香,李娜,李倩,等.柑橘青霉菌的分离鉴定与特性分析[J].华中师范大学学报(自然科学版),2014,48(1):86-90.
- 浅析初中语文教学中学生表达能力的提升措施
- 初中语文现代文阅读理解能力养成浅析
- 初中生物真学课堂的研究与实践
- 基于核心素养下初中生物高效教学培养策略研究
- 初中数学课堂教学有效性的提高策略
- 怎样提升初中数学教学的课堂效率
- 浅谈农村初中如何提高历史课堂效率
- 基于云平台的初中历史高效课堂实践探讨
- 趣味教学,打造高效历史课堂
- 初中道德与法治课堂有效教学策略探究
- 初探核心素养下初中道德与法治高效课堂的构建
- 巧用课前演讲助力初中英语课堂“多姿多彩”
- 谈如何巧用信息技术打造初中英语阅读高效课堂
- 浅论如何建立初中英语高效课堂
- 生活化教学在初中道德与法治课程中的应用探究
- 中学篮球教学中的常见问题与对策研究
- 信息技术环境下初中数学学科课堂教学模式的几点思考
- 浅谈对微课教学的认识
- 初中语文课堂常见问题的诊断
- 打造激励式课堂
- 新课改模式下初中英语高效课堂的和谐构建
- 新课改背景下初中语文有效课堂教学探讨
- 导学案在初中信息技术教学中的运用
- 浅谈初中体育排球“先练后教”体验式教学途径及方法尝试
- 体育游戏法在初中篮球教学中的应用新探
- marzipan
- marzipanned
- marzipanning
- marzipans
- mas
- ma's
- masc
- mascara
- mascaraed
- mascaraing
- mascaras
- mascot
- mascotry
- mascot's
- observation
- observational
- observationally
- observations
- observatories
- observatory
- observe
- observed
- observedly
- observe-on
- observer
- 玉宸
- 玉容
- 玉尊
- 玉尖
- 玉尘
- 玉尺
- 玉尺量才
- 玉尺量材
- 玉局
- 玉局仙
- 玉局观
- 玉局观提举
- 玉屏
- 玉屑
- 玉屑饭
- 玉山
- 玉山不倒
- 玉山低趄
- 玉山倒
- 玉山倾
- 玉山倾倒
- 玉山倾醉山颓倒
- 玉山倾颓
- 玉山先生
- 玉山将倒