成玉梁 李恒超 谢云飞 于航 郭亚辉 姚卫蓉 陈英 钱和

摘要?[目的]基于氯霉素对大豆蛋白金纳米簇(SP-AuNCs)的荧光猝灭现象,建立一种荧光检测传感器。[方法]采用改良后的SP-AuNCs的合成,以及加入氯霉素后荧光检测及优化表征。[结果]氯霉素和SP-AuNCs反应的最佳反应时长为9?min,线性检测浓度为0~300?μmol/L,检测限为22.86?μmol/L,同时有很好的选择性,最终取得的回收率是87.80%~98.45%。[结论]该试验为氯霉素的快速、可视化检测拓宽了思路,提供了新的方法参考。
关键词?荧光检测;大豆蛋白金纳米簇;氯霉素;猪肉
中图分类号?S851.34+7文献标识码?A
文章编号?0517-6611(2020)07-0213-06
doi:10.3969/j.issn.0517-6611.2020.07.061
Study?on?Rapid?Detection?of?Chloramphenicol?in?Pork?by?Fluorescent?Gold?Nanoclusters
CHENG?Yuliang,LI?Hengchao,XIE?Yunfei?et?al
(School?of?Food?Science?and?Technology,Jiangnan?University,Wuxi,Jiangsu?214122)
Abstract?[Objective]?Based?on?the?fluorescence?quenching?of?soybean?protein?gold?nanoclusters?(SPAuNCs)?by?chloramphenicol,a?fluorescence?detection?sensor?was?established.[Methods]?An?improved?SPAuNCs?was?synthesized,and?fluorescence?detection?and?optimized?characterization?were?performed?after?the?addition?of?chloramphenicol.[Result]The?optimal?reaction?time?of?chloramphenicol?and?SPAuNCs?was?9?min,the?linear?detection?concentration?ranged?from?0?to?300?μmol/L,and?the?detection?limit?was?22.86?μmol/L.At?the?same?time,it?had?good?selectivity,and?the?final?recovery?range?was?87.80%?-98.45%.[Conclusion]This?experiment?broadens?the?idea?of?rapid?and?visual?detection?of?chloramphenicol,and?provides?a?new?method?for?reference.
Key?words?Fluorescence?detection;Soybean?protein?gold?nanoclusters;Chloramphenicol;Pork
作者簡介?成玉梁(1980—),男,江苏盐城人,研究员,博士,从事食品安全研究;李恒超(1996—),男,安徽滁州人,硕士研究生,研究方向:食品检测。成玉梁和李恒超是共同第一作者。通信作者,研究员级高级工程师,硕士,从事食品、食品相关产品的检测工作。
收稿日期?2019-10-02
氯霉素(chloramphenicol,CAP)是一类廉价、高效的广谱抗生素。氯霉素通过抑制细菌合成蛋白质而起作用。适量的抗生素添加到饲料中可以起到杀死病原微生物的作用,这种方法不仅阻碍了肠道有害微生物的增殖,也节省了大量的本会被微生物消耗掉的营养物质,从而增加动物的营养,实现其平稳增长的目标。氯霉素价格低廉、抗菌性能好、药物稳定性好,在农牧业和细菌性治疗用药中得到广泛应用[1]。然而,随着氯霉素的广泛应用,人们逐渐发现氯霉素有极大的毒、副作用[2]。动物源性食品中的氯霉素残留可以通过食物链进入人体,抑制人体的骨髓造血功能,可能引起粒细胞缺乏症,血小板减少性紫癜、再生障碍性贫血等恶性血液病[3],也可能引起消化系统疾病,如食欲不振、腹胀、腹泻和口腔炎症等,给人们的健康带来危害。任何一种药物的成功使用,都受到其首次使用时就可能产生的对该化合物的耐受性和耐药性的影响[4],氯霉素也不例外。长期、微量地摄入氯霉素会使沙门氏菌和大肠杆菌产生耐药性,引起人体内部正常菌群失调,使人易患各种疾病。细菌在体内外对氯霉素均可产生耐药性,大肠杆菌、沙门菌和其他革兰氏阴性杆菌可因耐药因子(R因子)的传递而获得耐药性,现已证明具有R因子的大肠杆菌可产生乙酰转移酶,使氯霉素发生乙酰化而失效;耐氯霉素的金黄色葡萄球菌可产生某种诱导酶,在乙酰辅酶A的参与下,使氯霉素乙酰化。氯霉素残留物不仅会通过进入食物链危害人体健康,还会导致耐药细菌的传播,从而导致二次环境污染。粪便的循环污染就为耐药微生物的传播提供了可能。若动物排泄的粪便中含有氯霉素残留,这些粪便会污染其他未经处理的动物饲料;蔬菜也可能受到粪便的污染,尤其是在通常用粪便作肥料的国家[5]。
动物源性食品中的氯霉素残留已被公认为会对人体健康和社会环境造成潜在危害。我国农业部在2002年发布的《农业部235号公告》中明确规定氯霉素及其盐、酯禁用于所有食品动物、所有可食组织[6]。为了研究植物材料中天然存在的低水平氯霉素是否会引起可食动物组织中氯霉素残留物,Rejtharov等[7]用鸡进行了饲养研究,结果表明,当检测到氯霉素残留时,很可能是通过非法使用。由于氯霉素抗菌效果好、价格低廉,所以仍然有人在生产动物源性食品中违规使用。在现有的针对氯霉素的检测方法中,我国国家标准中检测氯霉素的方法包括基于表面增强拉曼光谱(SERS)传感器的混合分子印迹聚合物(MIP)检测牛奶中氯霉素的方法[8]、气相色谱-质谱法[9-13]、液相色谱-质谱/质谱法[14-18]和酶联免疫法[19-21]。因此,迫切需要建立一种快速、有效的方法来检测动物源食品中的氯霉素残留,以便更好地监督管理食品安全环境。
贵金属纳米簇(NMNCs)是指由几个到几十个贵金属原子(如Au、Ag?或Pt)构成,表面的配体(如硫醇类小分子、核酸、生物大分子或聚合物分子)进行稳定和保护、经能量激发后能发射荧光的一种纳米颗粒,它们的大小接近费米波长[22-23]。贵金属纳米团簇具有荧光强度高、催化活性高、生物相容性好、低毒、易溶于水等优点,其制备方法相对简单,常被用于构建荧光纳米传感器或被用作荧光标记物,在污染物监测、生物化学分析、生物传感器和成像等方面有广泛的应用[24-35]。
贵金属纳米簇构建的荧光纳米传感器在对食品和环境中污染物的检测中具有被广泛应用的前景。铜(Cu2+)在调节许多生物过程中起着重要的作用,但过高浓度的Cu2+对肾脏、大脑等重要的生物器官是有害的;而且,游离的Cu2+会对细胞产生毒性,因为它们会产生羟基自由基,导致细胞凋亡。研究发现,Cu2+对蛋白质和组氨酸存在很强的亲和力,Cu2+与配体蛋白表面结合后,主要通过增强激发态电子的系间穿越(ISC)非辐射弛豫行为来抑制金纳米簇的荧光[36]。Cheng等[37]利用大豆蛋白,成功开发了一种可视化检测湖水中Cu2+的方法,且其最低检测限为10?μmol/L。贵金属纳米簇构建的荧光传感器在分析和检测生物小分子、药物分子和功能蛋白质方面也具有很大的发展前景。Hemmateenejad等[38]建立了一种基于牛血清白蛋白修饰金纳米团簇对叶酸(FA)有荧光猝灭响应的新测定方法,其最低检出限为18.3?ng/mL,并且该方法在测定片剂中叶酸含量时可行。贵金属纳米簇是进行细胞或体内成像研究时最理想的荧光标记物之一,因为它具有高荧光稳定性、强抗光漂白能力、低毒性、高生物相容性、体积相对较小等优点。此外,其荧光发射波长覆盖在可见光和近红外区域。Chen等[39]采用绿色的合成方法,制备了牛血清白蛋白金纳米簇,为了提高该金纳米簇对高叶酸受体(FR)表达肿瘤的选择性亲和力,将叶酸(FA)固定在其表面,成功制备了一种极具肿瘤成像和靶向治疗潜力的、经配体修饰的金纳米簇。该研究使用了一种廉价、稳定、环境友好的金簇,发展了检测方法。该研究首先合成SP-AuNCs,并表征其荧光强度,随后观察SP-AuNCs对氯霉素的荧光响应;其次还对SP-AuNCs检测氯霉素的检测条件进行了优化;同时,另外选择2种抗生素(罗红霉素和链霉素)进行氯霉素荧光检测方法的选择性评价,建立荧光检测传感器对实际猪肉样品进行加标回收试验。
1?材料与方法
1.1?试验材料
1.1.1?试验试剂。四氯金酸三水合物(HAuCl4·3H2O,≥99.0%),萨恩化学技术上海有限公司;低温脱脂豆粕,山东禹王实业有限公司;氢氧化钠(NaOH,≥96.0%),国药集团化学试剂有限公司;乙酸乙酯(C4H8O2,≥99.5%),国药集团化学试剂有限公司;屈臣氏蒸馏水,广州屈臣氏食品饮料有限公司;氯霉素、链霉素、罗红霉素,百灵威科技有限公司;25%~28%氢氧化铵、无水硫酸鈉、正己烷,国药集团化学试剂有限公司。
1.1.2?试验仪器。
F-7000荧光光谱仪,日本国立公司;WH-2微型漩涡混合仪,上海沪西分析仪器厂有限公司;SCIENTZ-10ND冷冻干燥机,宁波新芝生物科技股份有限公司;可调式移液器,德国Eppendorf公司;IKA?Lab?Dancer旋涡振荡器,德国IKA公司;PB602-N电子天平,梅特勒-托利多仪器上海有限公司;
EL204电子天平,梅特勒-托利多仪器上海有限公司;RJ-LD-50G低速大容量离心机,无锡市瑞江分析仪器有限公司;IKA?T10?basic?ULTRA-TURRAX匀浆机,德国IKA公司;KQ-600KDB型高功率数控超声波清洗器,昆山市超声仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SHB-III循环水式多用真空泵,郑州长城科工贸有限公司。
1.2?试验方法
1.2.1?SP-AuNCs的制备[23]。将规格为1?g的四氯金酸倒入棕色细口瓶,加入99?g水混合,制备成四氯金酸储备液,放入冰箱保藏;取17?mL质量浓度为1%的四氯金酸储备液,与33?mL水混合,制备成10?mmol/L的四氯金酸溶液。在装有20?mL水的烧杯中放入搅拌子,称取1?g大豆蛋白粉,缓慢倒入烧杯溶解,制备成50?mg/mL的大豆蛋白溶液。称取12.5?g氢氧化钠,用250?mL容量瓶定容,制备成1?mol/L氢氧化钠溶液后备用。用移液枪准确移取0.5?mL浓度为50?mg/mL的大豆蛋白溶液于2?mL离心管中,再移取0.5?mL浓度为10?mmol/L的四氯金酸溶液逐滴加入离心管中,漩涡振荡2?min,再移取0.1?mL浓度为1?mol/L氢氧化钠溶液逐滴加入离心管中,在加入的同时进行漩涡振荡;共配制35管。将上述配制完的反应溶液于60?℃下继续进行7?h的搅拌反应;反应结束后,可以观察到反应液由亮黄色变为浅棕色,将离心管放置于365?nm波长的紫外灯下可看到溶液有粉红色荧光;合并最终得到的反应液,将其装入分子截留值为3.5?kD的透析袋中后,置于装有3?000?mL蒸馏水的大烧杯中透析。透析过程中每隔4?h换一次水,共换2次。透析完成后,将透析液倒入撑开的自封袋中,先放入-80?℃冰箱冷冻过夜,再放入冷冻干燥机中冻干3?d。冻干结束后,将自封袋放置到干燥器中。
1.2.2?表征SP-AuNCs荧光性能。
对透析前后的反应液进行留样,将冻干后的SP-AuNCs制备成50?mg/mL溶液。分别对透析前、透析后和冻干后制备的金纳米簇溶液用荧光分光光度计进行检测。寻找、确定浓度为50?mg/mL的SP-AuNCs溶液的最佳激发波长,比较透析前、透析后和冻干后制备的金纳米簇溶液的最高荧光强度。
1.2.3?氯霉素荧光检测反应条件优化。
1.2.3.1?反应时间的优化。用移液枪分别移取200?μL?pH为8、浓度为20?mmol/L的磷酸缓冲液和100?μL浓度为100?μmol/L的氯霉素溶液于1.5?mL离心管中,再在离心管中加入50?μL浓度为1?mg/mL的SP-AuNCs溶液,盖紧离心管管盖,置于漩涡振荡器上快速振荡后,用移液枪移取300?μL反应液于微量石英比色皿中,测定随着各反应时间时的荧光强度。检测的参数设置中,模式为时间检测,激发波长为270?nm,狭缝均为10?nm,间隔1?s,共1?800?s。
1.2.3.2?磷酸缓冲液浓度的优化。固定缓冲液的pH为7.5,配制浓度分别为5、10、20、30、40?mmol/L的磷酸缓冲液。用移液枪分别移取200?μL?pH为7.5、不同浓度的磷酸缓冲液和100?μL浓度为100?μmol/L的氯霉素溶液于1.5?mL离心管中,再在离心管中加入50?μL浓度为1?mg/mL的SP-AuNCs溶液,盖紧离心管管盖,置于漩涡振荡器上均匀振荡后,保持反应时长一致。再用移液枪移取300?μL反应液于微量石英比色皿中,测定样品的荧光强度。检测的参数设置中,模式为荧光检测,激发波长为270?nm,狭缝均为10?nm,扫描频率为2?400?Hz,电压为700?V。空白组和不同浓度的缓冲液组均需做3个平行。
1.2.3.3?磷酸缓冲液pH的优化。固定缓冲液的浓度为20?mmol/L,配制pH分别为6.0、6.5、7.0、7.5、8.0的磷酸缓冲液。用移液枪分别移取200?μL浓度为20?mmol/L、不同pH的磷酸缓冲液和100?μL浓度为300?μmol/L的氯霉素溶液于1.5?mL离心管中,再在离心管中加入50?μL浓度为1?mg/mL的SP-AuNCs溶液,盖紧离心管管盖,置于漩涡振荡器上均匀振荡后,保持反应时长一致;再用移液枪移取300?μL反应液于微量石英比色皿中,测定样品的荧光强度。检测的参数设置中,模式为荧光检测,激发波长为270?nm,狭缝均為10?nm,扫描频率为2?400?Hz,电压为700?V。空白组和不同浓度的缓冲液组均需做3个平行。
1.2.4?氯霉素荧光检测方法。
用移液枪分别移取200?μL浓度为20?mmol/L、pH为8的磷酸缓冲液和100?μL不同浓度的氯霉素溶液于1.5?mL离心管中,再在离心管中加入50?μL浓度为1?mg/mL的SP-AuNCs溶液,盖紧离心管管盖,置于漩涡振荡器上均匀振荡后,保持反应时长一致;再用移液枪移取300?μL反应液于微量石英比色皿中,测定样品的荧光强度。检测的参数设置中,模式为荧光检测,激发波长为270?nm,狭缝均为10?nm,扫描频率为2?400?Hz,电压为700?V。空白组中,用移液枪分别移取300?μL浓度为20?mmol/L、pH为8的磷酸缓冲液和50?μL浓度为1?mg/mL的SP-AuNCs溶液,盖紧离心管管盖,置于漩涡振荡器上均匀振荡后,再用移液枪移取300?μL反应液于微量石英比色皿中,测定空白样品的荧光强度。空白组和不同浓度的缓冲液组均需做3个平行。
1.2.5?氯霉素荧光检测方法选择性评价。
为了评价该SP-AuNCs检测氯霉素方法的选择性,另外购买了大环内酯类的罗红霉素和氨基糖苷类的链霉素这2种常见兽药抗生素,均制备成浓度为400?μmol/L的溶液。按照“1.2.4”中的检测方法,分别测定400?μmol/L的罗红霉素、链霉素和氯霉素对SP-AuNCs的荧光响应。此外,需做空白试验。考察和比较在相同浓度时,每组样品对SP-AuNCs的荧光响应情况。测定完毕后,回收样品,将反应完成后的4支离心管置于紫外灯下观察比较每个样品的荧光亮度变化。
1.2.6?实际样品中氯霉素测定。
参考国家标准进行样品前处理,首先配制质量浓度为25%~28%的氢氧化铵溶液。购买纯精猪肉,用肉类组织捣碎机绞碎,装入干净的自封袋中作为试样。做好标记之后,于-18?℃冰箱保藏。称取5?g样品,精确至0.01?g,置于50?mL离心管中,加入氯霉素内标溶液后,再依次加入15?mL乙酸乙酯、0.45?mL氢氧化铵和5?g无水硫酸钠,匀质提取30?s后,以4?000?r/min离心5?min,将上清液移至50?mL比色管中。另取一支50?mL离心管,加入15?mL乙酸乙酯、0.45?mL氢氧化铵,洗涤匀质刀头10?s后,洗涤液再次移入首支离心管中,用玻璃棒搅匀后,漩涡振荡1?min,再超声提取5?min,以4?000?r/min离心5?min。将上清液合并至50?mL比色管中,残渣再加入15?mL乙酸乙酯,重复上述操作,所有上清液全部合并至比色管中后,用乙酸乙酯定容至50?mL。摇匀后提取10?mL乙酸乙酯提取液于25?mL鸡心瓶中,在45?℃下水浴旋转浓缩至干。用3?mL缓冲液溶解残渣后超声5?min,加入3?mL正己烷漩涡振荡30?s,待静置分层后丢弃上层的正己烷,再加入3?mL正己烷漩涡振荡30?s,待静置分层后,用移液枪准确移取1?mL水相于1.5?mL离心管中,以13?000?r/min离心5?min,过0.2?μm滤膜。取300?μL于微量石英比色皿中,测定样品的荧光强度。计算、比较相对标准偏差(RSD)和回收率。选择的氯霉素加标溶液在测定时的理论浓度分别为100、200和300?μmol/L,须制备空白样品。
2?结果与分析
2.1?SP-AuNCs荧光性能的表征
通过荧光光谱仪分别对透析前、透析后和冻干后制备的SP-AuNCs溶液进行检测,确定各自对应的最佳激发波长和荧光强度。由图1可知,在不同制备阶段的SP-AuNCs存在差异。透析前溶液的激发光谱的最佳发射波长是650?nm,荧光发射光谱的最佳激发光波长在362?nm,对应的荧光强度为65?650.7;透析后溶液的激发光谱的最佳发射波长是648?nm,荧光发射光谱的最佳激发光波长在307?nm,对应的荧光强度为320?090.5;而最终合成得到的SP-AuNCs溶液的荧光激发光谱的最佳发射波长是650?nm,发射光谱的最佳激发光波长在368?nm处,对应的荧光强度为397?015.1。这与合成SP-AuNCs的参考文献[23]相类似。以上结果证明,该试验成功合成了SP-AuNCs荧光体系。
2.2?反应条件的选择优化
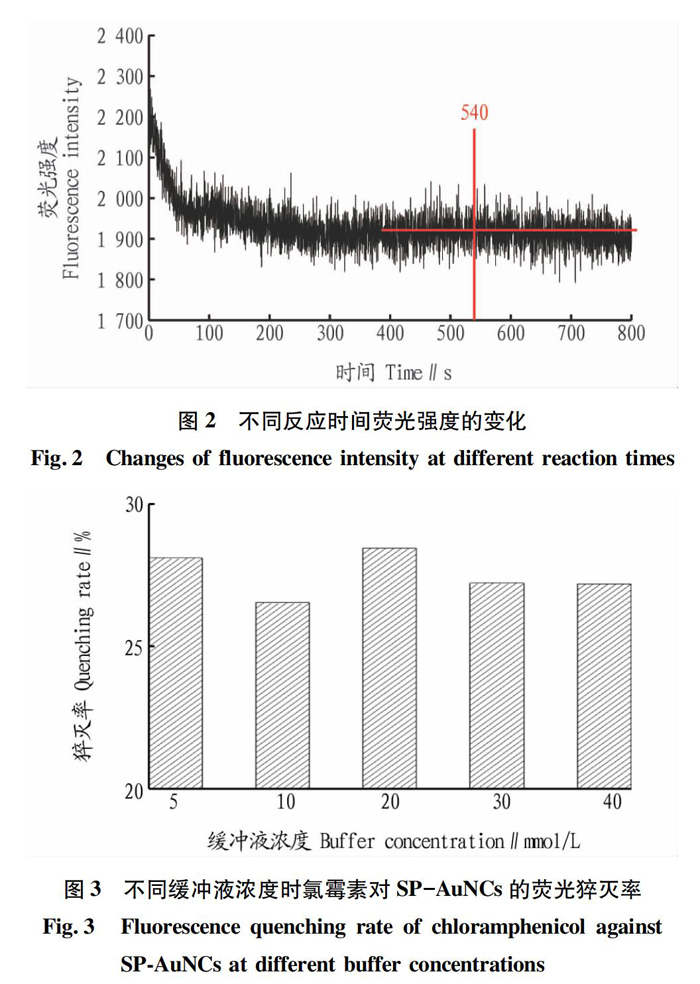
由图2可知,在含有氯霉素的缓冲体系中加入SP-AuNCs溶液后,立即发生快速反应,在200?s后趋于平稳,约540?s反应最佳。因此,该缓冲体系下的最佳反应时长为9?min。
由图3可知,当缓冲液pH和反应时长等反应条件固定时,缓冲液浓度对氯霉素荧光检测的影响不是非常明显。在浓度分别为5、10、20、30和40?mmol/L的缓冲液中,缓冲液浓度为20?mmol/L时,氯霉素对SP-AuNCs的荧光猝灭率最高。因此,选择磷酸缓冲液浓度为20?mmol/L作为SP-AuNCs检测氯霉素时反应的最佳缓冲液浓度。
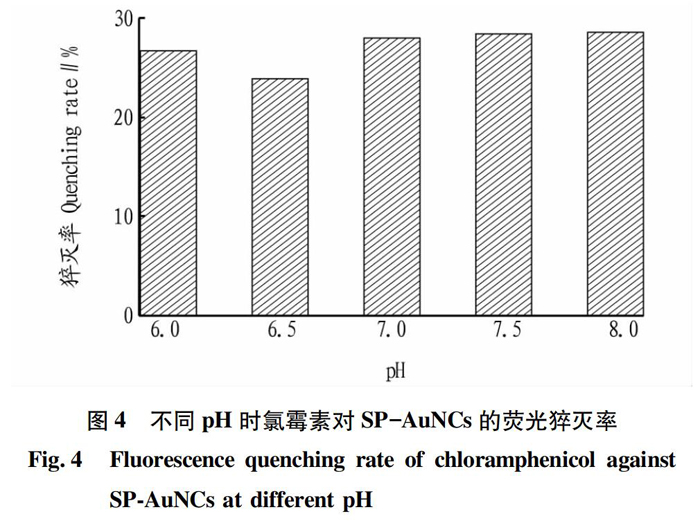
由图4可知,当缓冲液浓度和反应时长等反应条件固定时,在pH分别为6.0、6.5、7.0、7.5和8.0的缓冲体系中,pH为6.5时氯霉素对SP-AuNCs的荧光猝灭率最低,pH为8.0时氯霉素对SP-AuNCs的荧光猝灭率最高。因此,SP-AuNCs检测氯霉素反应中磷酸缓冲体系的最佳pH为8.0。
2.3?SP-AuNCs对氯霉素的荧光响应?由图5可知,氯霉素溶液对SP-AuNCs有荧光猝灭作用,且随着氯霉素浓度的增大,SP-AuNCs的荧光强度逐渐减弱。当氯霉素溶液浓度达到2?000?μmol/L时,SP-AuNCs几乎完全被荧光猝灭。
從SP-AuNCs的荧光猝灭率与所添加氯霉素浓度的关系(图6)可以看出,随着添加的氯霉素浓度的增大,SP-AuNCs的荧光猝灭率逐渐提高。当氯霉素浓度增加至2?000?μmol/L时,SP-GNCs的荧光猝灭率达到96.307%。图5~6表明氯霉素对SP-AuNCs有荧光猝灭效应,可以以此构建针对氯霉素的荧光检测传感器。
2.4?SP-AuNCs对氯霉素的荧光猝灭线性关系
对SP-AuNCs的荧光猝灭率与氯霉素溶液浓度进行线性回归,从SP-AuNCs的荧光猝灭率与氯霉素溶液浓度的线性关系(图7)可以看出,氯霉素溶液在0~300?μmol/L时,该方法呈现良好的线性关系,其线性回归方程为y=0.002x+0.039(R2=0.984?5)。根据3σ准则,得出该方法的最低检测限为22.86?μmol/L。
2.5?方法的选择性评价
选择与氯霉素种类不同的另外2种抗生素(罗红霉素和链霉素)进行了氯霉素荧光检测方法的选择性评价。图8表明,反应条件相同的情况下,仅添加氯霉素溶液的反应液的荧光猝灭效果明显,添加罗红霉素或链霉素溶液的反应液的荧光响应非常不明显。这说明该试验设计和构建的SP-AuNCs荧光检测传感器对氯霉素具有优良的选择性。
2.6?氯霉素对SP-AuNCs的可能作用机理
分析氯霉素的化学分子式,其中含有1个-NO2和2个Cl-,它们均属于强吸电子基团(图9)。当在SP-AuNCs溶液体系中引入氯霉素时,氯霉素和SP-AuNCs结合,-NO2和Cl-可能通过强吸电子作用打断配体-Au的电子转移过程(LMCT)[11],进而猝灭SP-AuNCs的荧光。
2.7?实际样品中氯霉素的加标回收率
进一步将所构建的SP-AuNCs传感器应用于实际猪肉样品中氯霉素的检测。从氯霉素的加标试验的检测结果(表1)可以看出,采用该方法检测实际猪肉样品中氯霉素的加标回收率为87.80%~98.45%,在合理范围之内,说明该方法对猪肉样品中氯霉素的实际检测具有较高的可靠性和参考价值。
3?结论
该研究基于氯霉素对大豆蛋白金纳米簇的荧光淬灭效应,构建了SP-AuNCs荧光传感器检测猪肉中氯霉素的检测分析方法,具体结论如下:氯霉素中的-NO2和Cl-可能通过
强吸电子作用打断配体-Au的电子转移过程(LMCT),进而猝灭SP-AuNCs的荧光。当氯霉素溶液浓度为2?000?μmol/L时,SP-AuNCs的荧光猝灭率高达96.31%;优化了SP-AuNCs检测氯霉素的检测条件,确定最佳反应条件是缓冲体系pH为8.0,浓度为20?mmol/L,反应时长9?min。氯霉素在0~300?μmol/L与SP-AuNCs的荧光猝灭率呈现良好的线性关系,最低检测限为22.86?μmol/L;通过考察和比较2种常见的抗生素(链霉素、罗红霉素)对SP-AuNCs的荧光响应情况,发现此次试验构建的SP-AuNCs荧光检测传感器对氯霉素具有高度选择性;应用所构建的SP-AuNCs荧光检测传感器对实际猪肉样品进行氯霉素的加标回收试验,计算得到的加标回收率为87.80%~98.45%,属于合理范围,说明该方法具有较高的可靠性。
此次試验研究也存在不足之处,大豆蛋白金纳米簇检测氯霉素的其他检测条件有待进一步优化;可以进行不同种缓冲液之间的比较,选择最有利于反应的缓冲液;反应体系的配比可以进一步完善;在做方法的选择性评价时,作为比较的抗生素种类和个数可以更多、更丰富一些;可以探究参考国标进行的前处理步骤能否进一步简化;未对氯霉素对大豆蛋白金纳米簇造成的荧光猝灭的机制进行深入的探究,该猝灭属于动态还是静态猝灭有待进一步探究。
综上所述,贵金属纳米簇对兽药残留的检测仍有许多需要探索和研究的空间。相信随着时间的推移、技术的发展和社会的进步,以荧光金纳米簇为传感器对氯霉素等兽药的检测分析方法将逐步得到改进和完善,开发出更加高效、快速、绿色的检测方法,为保证食品质量安全、保障人民身体健康、维护社会环境作出更大的贡献。
参考文献
[1]?陈鹏,罗晓琴.氯霉素残留状况及检测方法[J].动物保健,2006(10):41-42.
[2]?吴晓丰,杨鹭花.氯霉素残留的危害及其检测方法[J].动物医学进展,2004,25(3):41-43.
[3]?吕顺,钱鑫萍,范远景,等.氯霉素细胞毒性研究[J].安徽农业科学,2008,36(20):8472-8474.
[4]?DAVIES?J,DAVIES?D.Origins?and?evolution?of?antibiotic?resistance[J].Microbiology?and?molecular?biology?reviews,2010,74(3):417-433.
[5]?BACANLI?M,BASARAN?N.Importance?of?antibiotic?residues?in?animal?food[J].Food?and?chemical?toxicology,2019,125:462-466.
[6]?中华人民共和国农业部.第235号公告-动物性食品中兽药最高残留限量(附录4)[R].北京:农业部,2002.
[7]?REJTHAROV?M,REJTHAR?L,CˇACˇKOV?K,et?al.Observation?of?residues?in?tissues?of?chickens?exposed?to?low?dietary?concentrations?of?chloramphenicol[J].Food?additives?&?contaminants:Part?A,2017,34:542-546.
[8]?XIE?Y?F,ZHAO?M?Y,HU?Q,et?al.Selective?detection?of?chloramphenicol?in?milk?based?on?a?molecularly?imprinted?polymersurfaceenhanced?Raman?spectroscopic?nanosensor[J].Journal?of?raman?spectroscopy,2017,48(2):204-210.
[9]?JACOBSON?W?C,ALLEN?E?H,WISEMAN?H?G.Determination?of?chloramphenicol?in?liver,kideny,muscle,and?whole?blood[C]//Prensent?at?88th?Annual?Meeting?of?AOAC.[s.l.]:AOAC,1974:14-17.
[10]?LI?P,QIU?Y?M,CAI?H?X,et?al.Simultaneous?determination?of?chloramphenicol,thiamphenicol,and?florfenicol?residues?in?animal?tissues?by?gas?chromatography/mass?spectrometry[J].Chinese?journal?of?chromatography,2006,24(1):14-18.
[11]?HAMMACK?W,CARSON?M?C,NEUHAUS?B?K,et?al.Multilaboratory?validation?of?a?method?to?confirm?chloramphenicol?in?shrimp?and?crabmeat?by?liquid?chromatographytandem?mass?spectrometry[J].J?AOAC?Int,2003,86(6):1135-1143.
[12]?VESNA?C?F.Performance?characteristics?of?an?analytical?procedure?for?determining?chloramphenicol?residues?in?muscle?tissue?by?gas?chromatographyelectron?capture?detection[J].Biomedical?chromatography,2006,20(10):985-992.
[13]?邱月明,林黎明,李鵬,等.动物源性食品中氯霉素类药物残留量测定:GB/T?22338—2008[S].北京:中国标准出版社,2008.
[14]?BONONI?M,TATEO?F.Liquid?chromatography/tandem?mass?spectrometry?analysis?of?chloramphenicol?in?propolis?extracts?available?on?the?Italian?market[J].Journal?of?food?composition?and?analysis,2008,21(1):84-89.
[15]?尹丽珠,张学忠,冯雷,等.超高效液相色谱-串联质谱法检测禽畜肉中的氯霉素残留[J].云南大学学报(自然科学版),2011,33(3):336-339.
[16]?黄小龙,胡书玉,徐少华,等.高效液相色谱串联质谱法测定猪尿中的氯霉素[J].广东化工,2018,45(10):222-224.
[17]?万宇平.快速检测技术在食品安全监管中的应用及发展新方向[J].北京工商大学学报(自然科学版),2011,29(4):1-5.
[18]?庞国芳,林海丹,林峰,等.可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定?液相色谱-串联质谱法:GB/T?20756—2006[S].北京:中国标准出版社,2006.
[19]?范素菊,杨兴东,高润.氯霉素单克隆抗体的制备及ELISA检测方法的建立[J].中国畜牧兽医,2018,45(9):2566-2574.
[20]?TAO?X?Q,JIANG?H?Y,ZHU?J?H,et?al.An?ultrasensitive?chemiluminescent?ELISA?for?determination?of?chloramphenicol?in?milk,milk?powder,honey,eggs?and?chicken?muscle[J].Food?and?agricultural?immunology,2014,25(1):137-148.
[21]?宋永青,赵榕,梁高道,等.肉与肉制品?氯霉素含量的测定:GB/T?9695.32—2009[S].北京:中国标准出版社,2009.
[22]?LU?Y?Z,CHEN?W.Sub?nanometre?sized?metal?clu?sters:From?synthetic?challenges?to?the?unique?property?discoveries[J].Chemical?society?reviews,2012,43(31):3594-3623.
[23]?YU?P,WEN?X?M,TOH?Y?R,et?al.Fluorescent?metallic?nanoclusters:Electron?dynamics,structure,and?applications[J].Particle?&?particle?systems?characterization,2015,32(2):142-163.
[24]?ZHENG?J,ZHANG?C?W,DICKSON?R?M.Highly?fluorescent,water?soluble,size?tunable?gold?quantum?dots[J].Physical?review?letters,2004,93(7):1-4.
[25]?FORWARD?J?M,BOHMANN?D,FACKLER?J?P,Jr,et?al.Luminescence?studies?of?gold(I)?thiolate?complexes[J].Inorganic?chemistry,1995,34(25):6330-6336.
[26]?XIE?J?P,ZHENG?Y?G,YING?J?Y.Proteindirected?synthesis?of?highly?fluorescent?gold?nanoclusters[J].Journal?of?the?American?chemical?society,2009,131(3):888-889.
[27]?DEVADAS?M?S,KIM?J,SINN?E,et?al.Unique?ultrafast?visible?luminescence?in?monolayer-protected?Au25?clusters[J].Jphyschemc,2010,114(51):22417-22423.
[28]?WU?Z?K,JIN?R?C.On?the?ligands?role?in?the?fluorescence?of?gold?nanoclusters[J].Nano?letters,2010,10(7):2568-2573.
[29]?KAWASAKI?H,HAMAGUCHI?K,OSAKA?I,et?al.pHdependent?synthesis?of?pepsinmediated?gold?nanoclusters?with?blue?green?and?red?fluorescent?emission[J].Advanced?functional?materials,2011,21(18):3508-3515.
[30]?SHANG?L,BRANDHOLT?S,STOCKMAR?F,et?al.Effect?of?protein?adsorption?on?the?fluorescence?of?ultrasmall?gold?nanoclusters[J].Small,2012,8(5):661-665.
[31]?DEZ?I,KANYUK?M?I,DEMCHENKO?A?P,et?al.Blue,green?and?red?emissive?silver?nanoclusters?formed?in?organic?solvents[J].Nanoscale,2012,4(15):4434-4437.
[32]?DING?W?C,LIU?Y,LI?Y?J,et?al.Water?soluble?gold?nanoclusters?with?pH?dependent?fluorescence?and?high?colloidal?stability?over?a?wide?pH?range?via?co?reduction?of?glutathione?and?citrate[J].RSC?Advances,2014,4(43):22651-22659.
[33]?COX?D?M,BRICKMAN?R,CREEGAN?K,et?al.Gold?clusters?reactions?and?deuterium?uptake[J].Zeitschrift?fur?physik?d?atoms?molecules?and?clusters,1991,19(14):353-355.
[34]?VALDEN?M,LAI?X,GOODMAN?D?W.Onset?of?catalytic?activity?of?gold?clusters?on?titania?with?the?appearance?of?nonmetallic?properties?[J].Science,1998,281(5383):1647-1650.
[35]?LI?J,ZHOU?Z?J,LI?Z?M,et?al.Biomimetic?onepot?synthesis?of?gold?nanoclusters/nanoparticles?for?targeted?tumor?cellular?dualmodality?imaging?[J].Nanoscale?research?letters,2013,8(1):1-7.
[36]?DU?RGADAS?C?V,SHARMA?C?P,SREENIVASAN?K.Fluorescent?gold?clusters?as?nanosensors?for?copper?ions?in?live?cells[J].Analyst,2011,136(5):933-940.
[37]?CHENG?Y?L,KANG?W?H,GUO?Y?H,et?al.Visual?detection?of?Cu2+?based?on?fluorescence?quenching?of?greensynthesized?gold?nanoclusters?using?soy?protein?as?template[J].Food?and?agricultural?immunology,2017,28(5):848-858.
[38]?HEMMATEENEJAD?B,SHAKERIZADEHSHIRAZI?F,SAMARI?F.BSAmodified?gold?nanoclusters?for?sensing?of?folic?acid[J].Sensors?and?aactuators?B,2014,199:42-46.
[39]?CHEN?H?Y,LI?S?L,LI?B?W,et?al.Folate?modified?gold?nanoclusters?as?near?infrared?fluorescent?probes?for?tumor?imaging?and?therapy[J].Nanoscale,2012,4(19):6050-6064.
- 浅议房屋建筑屋面防水
- 油水井井下落物打捞配套技术研究
- 铁路路基注浆加固施工技术
- 海拉尔盆地贝尔凹陷基底岩石类型及分布研究
- 合阳中东深煤层对比方法研究
- 何庄矿高效快速封堵突水点技术应用
- 浅析某销售型企业人力资源管理现状及对策
- 对施工企业加强外部劳务管理方法的探讨
- 某炼钢厂清炉钢渣崩溅伤亡事故分析
- 精益生产方式及生产流程再造在中小企业中的应用研究
- 制造型企业中那些容易被忽略的成本因素
- 管理人才选用培养过程的探讨
- 民营中小企业系统风险预警机制分析
- 基于RFM模型的卷烟品牌聚类细分研究
- 企业人力资源管理的几项重点工作
- 安全管理在煤矿企业管理中的地位与作用
- “摩托罗拉”中国化经营对中国企业“走出去”的启示
- 企业员工培训风险管理研究
- 企业经营管理人才管理模式研究
- 我国中小企业融资问题管窥
- 上市公司IPO定价的结构性变化
- 中小企业管理会计应对经济转型作用机制研究
- 浅谈对税务会计师的认识与作用
- 商业银行发展低碳金融的SWOT分析及路径研究
- 关于加强大企业税务风险管理的思考
- see sth as
- see sth coming
- see sth in
- see that/see to it that
- seethe
- see the back of
- seethed
- see the funny side of
- seether
- seethes
- see the sights
- see the world
- seething
- seethingly
- seethings
- see things in black and white
- see through
- remilitarizing
- remind
- reminded
- reminder
- reminders
- reminding
- remind/make sb remember
- remindof
- 先后继承
- 先后脚儿
- 先后连续任职
- 先后都一样
- 先君
- 先君先公
- 先君子
- 先君子后小人
- 先听听音
- 先吾着鞭
- 先吾著鞭
- 先周密考虑后再行动
- 先和后
- 先哲
- 先啬
- 先嗇
- 先嗣
- 先国后己
- 先圣
- 先圣先师
- 先垄
- 先域
- 先墓
- 先声
- 先声后实