高晓月 范维 陈淑敏 李莹莹 王守伟 郭文萍


摘 要:以微生物显色为原理,建立一种对畜禽肉中单一或配伍使用的抗生素进行联合初筛的高通量方法,并用色谱法对阳性样品进行验证。以大肠埃希氏菌(Escherichia coli,CICC 23657)作为指示菌,选取适当的抗生素残留提取方法,并通过单因素试验优化检测液配方及检测体系组成,最终实现对不同类别抗生素的联合检测。结果表明:选取柠檬酸-丙酮缓冲液进行提取,提取效率达到86%~88%,相对标准偏差为3.9%~4.3%;蛋白胨添加量为1.0 g/100 mL、溴甲酚紫指示剂添加量为2.0 mg/100 mL、pH值为7.2时,检测液显色效果较好;菌悬液初始吸光度(A600 nm)为0.4,检测液、菌液、样品提取液体积为150 μL∶50 μL∶100 μL时,检测效果最佳,对畜禽肉中喹诺酮类抗生素的检出限为60~180 μg/kg,氨基糖苷类检出限为60~140 μg/kg,喹诺酮类与氨基糖苷类配伍使用时的检出限为40~180 μg/kg;进一步用色谱法对50 份样品的初筛结果进行验证,无假阴性样品存在,说明该方法可用于畜禽肉中抗生素残留的初筛。
关键词:微生物显色法;畜禽肉;抗生素残留;高通量
Abstract: A new microbial chromogenic assay was developed for high throughput screening for single and compatible combinations of antibiotic residues in livestock and poultry meat, and it was validated by liquid chromatography (LC). Escherichia coli was used as the indicator strain to detect a variety of antibiotics simultaneously. The optimal extraction conditions were determined and the reaction system and conditions were optimized by one-factor-at-a-time method. The results showed that citric acid-acetone mixture was the solvent of choice for the extraction procedure, giving an extraction efficiency of 86%–88% with a relative standard deviation ranging from 3.9% to 4.3%. Addition of 1.0 g/100 mL of peptone and?2.0 mg/100 mL of bromocresol purple and pH adjustment to 7.2 were found to be the optimal conditions for chromogenic reaction. The optimal detection conditions were as follows: initial absorbance value (A600 nm) of bacterial suspension 0.4, and ratio of reaction system to bacterial suspension to sample extract 150:50:100 (V/V). The limit of detection of the proposed method was 60–180, 60–140 and 40–180 μg/kg for quinolones, aminoglycosides and their combinations in livestock and poultry meat, respectively. For 50 positive samples with antibiotic residue determined by the microbial chromogenic assay, no false negative results were obtained.? Thus this assay can be used in screening for antibiotic residues in livestock and poultry meat.
Keywords: microbial chromogenic assay; livestock and poultry meat; antibiotic residues; high-throughput
DOI:10.7506/rlyj1001-8123-20190222-032
中圖分类号:TS251.1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文献标志码:A 文章编号:1001-8123(2019)04-0036-06
喹诺酮类抗生素是一类广谱抗生素,在畜禽兽药中得到广泛应用[1-3],用于预防和治疗动物疾病或微生物污染以及作为膳食补充剂[4-6]。相关研究[7-8]表明,畜禽肉中喹诺酮类和氨基糖苷类抗生素的残留率较高,这主要是因为国内养殖业为了缩短疗程,降低药物毒副作用,减少致病菌耐药情况发生,常常把氨基糖苷类等抗生素与其配伍使用,这无形中加大了抗生素残留检测的难度,寻求高通量检测方法将成为未来发展的主要方向[9-11]。抗生素残留的检测方法包括微生物检测法、免疫分析法和色谱法[12-14]。在这3 类方法中,色谱法和免疫分析法具有灵敏性强、准确度高等特点,但是均存在检测具有单一性、实验室设备投入大和对技术人员要求高等问题[15-17],不能满足高通量、快速检测的发展需要。相较于以上2 种方法,微生物检测法在应用中具有操作便捷、成本较低、有广泛筛查性的特点[18-20],可作为一种高通量初筛方法用于畜禽肉中抗生素残留的检测,在中小型禽畜肉养殖加工企业中具有良好的推广前景。
目前,在我国微生物显色法主要采用嗜热脂肪芽孢杆菌[21-23]、蜡样芽孢杆菌[24]等作为指示菌对原料乳中残留的青霉素类抗生素进行检测,在畜禽肉中应用较少[25-27],主要原因有两点:一是由于畜禽肉的体系较复杂,抗生素提取存在困难;二是由于现有指示菌对禽畜肉中常见的喹诺酮类抗生素不敏感。因此,本研究针对以上技术难题选择大肠埃希氏菌为指示菌[28-29],开发适合畜禽肉中抗生素残留检测的提取方法,并优化检测液配方及检测体系组成,建立一种可同时对畜禽肉中喹诺酮类及常与其配伍使用的氨基糖苷类抗生素进行联合初筛的高通量方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与样品
大肠埃希氏菌(Escherichia coli)由中国工业微生物菌种保藏管理中心提供、菌号为CICC 23657的标准菌株;禽畜肉购自农贸市场。
1.1.2 试剂
喹诺酮类:恩诺沙星、环丙沙星、司帕沙星、麻保沙星、达氟沙星、氟甲喹、二氟沙星;氨基糖苷类:庆大霉素、链霉素、新霉素、安普霉素、丁胺卡那霉素标准品 美国Sigma公司;蛋白胨、牛肉浸膏、葡萄糖、溴甲酚紫指示剂、营养琼脂、营养肉汤、结晶紫中性红胆盐琼脂(violt red bile agar,VRBA) 北京陆桥技术有限责任公司;其他试剂为分析纯或色谱纯。
1.2 仪器与设备
ESJ120-4电子天平 龙腾仪器有限公司;PHSJ-4A实验室pH计 上海仪电科学仪器股份有限公司;UltiMate 3000高效液相色谱-质谱联用仪(配备电喷雾离子源)、1510-07269C酶标仪 美国Thermo公司;BPC-150F培养箱 上海一恒科技有限公司;KDC-140HR离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 樣品处理
1.3.1.1 溶液配制
标准工作液的配制:准确量取各抗生素标准储备液,用去离子水稀释成适当浓度的标准工作液。
混合标准工作液的配制:准确量取各抗生素标准储备液,两两等体积混合,用去离子水稀释成适当浓度的混合标准工作液。
柠檬酸-丙酮缓冲溶液的配制:将0.2 mol/L柠檬酸溶液和0.5 mol/L氢氧化钾溶液等体积混合,向35 mL混合液中加入35 mL丙酮和30 mL蒸馏水,充分混匀。
柠檬酸-乙醇缓冲溶液的配制:将0.2 mol/L柠檬酸溶液和0.5 mol/L氢氧化钾溶液等体积混合,向35 mL混合液中加入35 mL乙醇和30 mL蒸馏水,充分混匀。
柠檬酸-磷酸氢二钠缓冲溶液的配制:将0.2 mol/L磷酸氢二钠16.47 mL、0.1 mol/L柠檬酸3.53 mL充分混匀。
1.3.1.2 样液提取
取3 个50 mL离心管,分别加入10 g均质好的肌肉组织样品,再向各管中分别加入20 mL柠檬酸-丙酮缓冲溶液、20 mL柠檬酸-乙醇缓冲溶液和20 mL柠檬酸-磷酸氢二钠缓冲溶液,用漩涡振荡器振荡3 min,充分振荡后于70~75 ℃水浴20 min,10 000 r/min离心5 min,取上清液作为样液。
1.3.1.3 提取液的选择
对3 种提取液(柠檬酸-丙酮缓冲溶液、柠檬酸-乙醇缓冲溶液和柠檬酸-磷酸氢二钠缓冲溶液)的蛋白沉淀效果进行比较,并将各上清液进行色谱法测定,确定不同提取液中各类抗生素的提取效率,最终选取适宜的抗生素提取液。
1.3.2 检测液配方优化
检测液配制方法为:蛋白胨0.5~2.0 g、溴甲酚紫指示剂2.0~8.0 mg、葡萄糖1.0 g、NaCl 0.5 g、牛肉浸膏0.3 g、加水定容至100 mL,pH值调至6.8~7.4,加热煮沸至完全溶解,121 ℃高压灭菌15 min。
1.3.2.1 反应变色时间及指示菌菌落总数的确定
按检测液∶菌悬液∶生理盐水体积比3∶1∶2的比例进行混合后,于36 ℃恒温培养,确定变色(检测液由紫红色变黄色)时间。之后取1 mL进行梯度稀释,选择适宜的稀释度,倾注于平皿中,倒入VRBA液体培养基,充分混匀,待琼脂凝固后,再加入3~4 mL VRBA覆盖平皿表层,翻转平板,置于36 ℃培养24 h后计数,确定指示菌生长情况。
1.3.2.2 蛋白胨添加量的确定
在100 mL检测液中分别加入0.5、1.0、1.5、2.0 g的蛋白胨,灭菌冷却后按照1.3.2.1节的方法进行变色时间和菌落总数测定,选取蛋白胨的最佳加入量。
1.3.2.3 溴甲酚紫添加量的确定
分别取2.0、4.0、6.0、8.0 mg溴甲酚紫指示剂添加到100 mL检测液中,按照1.3.2.1节的方法进行实验,选取指示剂的最佳加入量。
1.3.2.4 检测液初始pH值的确定
将检测液初始pH值分别调为6.8、7.0、7.2、7.4,按照1.3.2.1节的方法进行变色时间和菌落总数测定,从而选取最适的检测液初始pH值。
1.3.3 菌悬液初始吸光度测定和检测体系组成的确定
无菌状态下,挑取已培养好的指示菌菌落接入营养肉汤培养基中,配制成不同初始吸光度(A600 nm)的菌悬液,其吸光度分别为0.1、0.4、0.6、0.8、1.0,加入到以下3 组体系中,体系比例如表1所示,于36 ℃恒温培养,确定各组检测液的变色时间。选择变色时间较短的检测体系组成,将体系中的生理盐水换成等体积的0.1 μg/mL环丙沙星标准溶液或环丙沙星与链霉素混合标准溶液,于同一温度下恒温培养,进行抗生素敏感性验证实验,观察变色情况,选出检测液仍呈紫色组,最终确定最适的菌悬液初始吸光度及检测体系组成。
1.3.4 微生物显色法检测
按样品数取出所需数量的微孔板,将样品和对照组对应微孔按序编号,每个样品和对照做2 孔平行。按照1.3.3节优化的比例,向各微孔中依次加入检测液和菌悬液,再按照编号向各微孔中加入阳性对照(不同抗生素标准液)、阴性对照(无抗生素残留的肉提取液)、空白对照(生理盐水)及样液,于36 ℃恒温培养,观察变色情况。当阴性对照孔变成黄色时,观察其他样品孔颜色变化。
1.3.5 抗生素检出限的确定
1.3.5.1 单标检出限确定
用去离子水对12 种标准储备液进行梯度稀释,稀释成10 个梯度。按上述微生物法进行检测,确定各种抗生素的检出限。
1.3.5.2 联用检出限确定
对常配伍使用的喹诺酮类和氨基糖苷类抗生素进行混合,使2 种抗生素在混合体系中的终质量浓度均为0.01、0.02、0.04、0.06、0.08、0.10 μg/mL,具体如表2所示。按上述微生物法进行检测,确定各种联用抗生素检出限。
1.3.6 样品的测定
将50 份样品按照1~50进行编号,为保证一定的阳性检出比例,部分样品采用人工添加的方式。用微生物显色法进行测试,结果用色谱法进行验证。
1.4 数据处理
实验数据和绘图均采用Origin 8.0数据分析软件。
2 结果与分析
2.1 抗生素提取液的确定
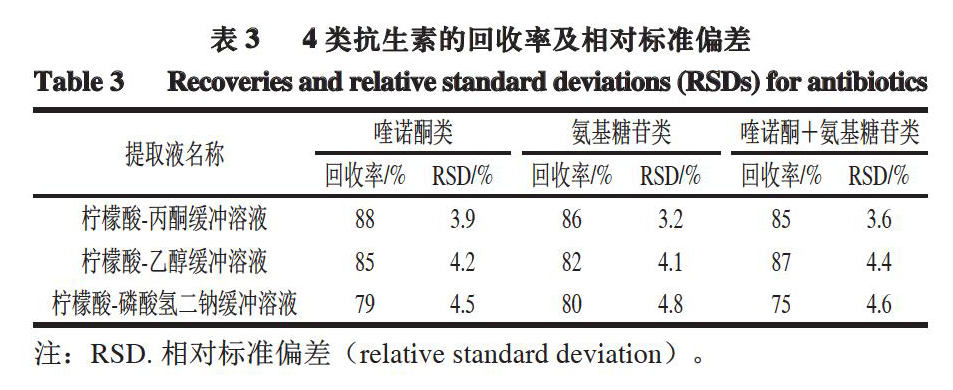
通过观察3 种提取液的蛋白沉淀效果发现,柠檬酸-丙酮缓冲溶液沉淀蛋白效果较好,上清液呈无色澄清状,其他2 种提取液处理的样品上清液呈微红色,并有少许残渣存在。取上清液进行色谱法检测,由表3可知,柠檬酸-丙酮缓冲溶液的提取率及稳定性均较高,因此,选择柠檬酸-丙酮缓冲溶液作为提取液。
2.2 检测液配方优化结果
2.2.1 蛋白胨添加量的确定结果
由图1可知,随着蛋白胨添加量的增加,菌落总数呈先升高后下降的趋势,这与刘冬梅等[30]的研究结果相似。当蛋白胨添加量为1.0 g/100 mL时,菌落总数对数值最高,达7.81 (lg(CFU/mL)),之后随着蛋白胨添加量的提高,培养基的pH值降低,从而影响了菌种的生长繁殖。从反应时间上看,菌落总数越高,检测液变色时间相对越短,这主要是由于较高浓度的指示菌产酸较多,使指示剂变色较快。因此选择蛋白胨添加量为1.0 g/100 mL。
2.2.2 溴甲酚紫添加量的确定结果
由图2可知:当溴甲酚紫指示剂的添加量为2.0、4.0 mg/100 mL时,检测液的初始颜色呈紫色,反应终点颜色变成黄色,区分度明显[31],且反应时间可控制在4 h内;随着溴甲酚紫指示剂添加量的提高,检测液初始颜色呈紫黑色,终点显色不明显,且变色时间较长,因此选择溴甲酚紫添加量为2.0 mg/100 mL。
2.2.3 检测液初始pH值的确定结果
溴甲酚紫指示剂的变色范围是pH值5.2~6.8,为了保证指示剂正常变色,将检测液初始pH值设定为高于6.8。由图3可知,当检测液初始pH值为7.2时,菌落总数对数值达到最高,说明该pH值是指示菌生长的最适pH值。并且从反应时间可知,随着检测液初始pH值的升高,反应时间随之延长,当pH值小于7.2时,反应时间可以控制在4 h内。由于抗生素对微生物的抑制作用需要一定的反应时间[32],为防止由于检测液初始pH值设定过低,导致药效没产生之前指示菌的产酸量就使其变色,失去检测意义,因此选择最适检测液初始pH值为7.2。
2.3 菌悬液初始吸光度和检测体系组成的确定结果
用生理盐水作为样品提取液,确定菌悬液初始吸光度和检测体系组成对检测液变色时间的影响。由表4可知,当菌悬液初始吸光度不小于0.4时,B、C组均能在4 h内变色。因此,用B、C 组检测体系组成进行实验时,反应时间较短。
由表5可知,对于抗生素敏感性来说,菌悬液初始吸光度大于0.4或加入体积为80 μL时,反应终点检测液变为黄色,抗生素对菌的抑制效果不明显,达不到检测目的。因此选择菌悬液初始吸光度为0.4,检测液∶菌液∶样品提取液为150 μL∶50 μL∶100 μL时,检测效果最佳。
2.4 抗生素的检出限
按照1.3.5节的方法进行检测,确定各抗生素的最小检测浓度(颜色未发生变化時的抗生素标准液浓度)。由表6~7可知,本方法选择的大肠埃希氏菌对喹诺酮类和氨基糖苷类抗生素均有较好抑制作用,其中喹诺酮类检出限为60~180 μg/kg、氨基糖苷类检出限为40~140 μg/kg,均低于我国农业部规定的动物性食品中兽药最高残留限量[33],因此该法可以满足喹诺酮类及氨基糖苷类抗生素初筛检测的要求。
2.5 样品测定结果
将50 份样品用微生物显色法进行测定,结果用色谱法进行验证。由表8可知,采用微生物法测定时,共有15 个样品检出结果呈阳性,其中12 个阳性样品人为添加了抗生素,其余3 个样品经过与色谱方法比对,发现是假阳性样品。用色谱法对35 个呈阴性样品进行验证,没有测出以上药物残留,说明该微生物显色法无假阴性结果存在,结果较可靠。
3 结 论
以大肠埃希氏菌作为指示菌,选取柠檬酸-丙酮缓冲液作为提取液,通过单因素试验优化检测液配方及检测体系组成,选择菌悬液初始吸光度为0.4,检测液(蛋白胨含量1.0 g/100 mL、溴甲酚紫指示剂含量2.0 mg/100 mL、pH 7.2)∶菌液∶样品提取液为150 μL∶50 μL∶100 μL进行实验,之后用色谱法对阳性样品进行验证。优化后的检测方法可在3~4 h内使指示剂变色(检测液由紫变黄),颜色变化明显,易用肉眼区分。该方法适用于畜禽肉中喹诺酮类、氨基糖苷类单独或二者配伍使用时抗生素残留的检测,其检出限均低于我国农业部规定的动物性食品中兽药最高残留限量,满足初筛要求。用色谱法对微生物法测定结果呈阴性的35 个样品进行复测,以上抗生素均未检出,说明该方法测定准确性较高,没有假阴性结果存在。本方法使用微孔板作为反应器,微孔可根据样品数量自由独立拆分,可同时对多个样品进行检测,不受样品数量限制,便于操作者使用。此外,该方法所用试剂均以微升计,较传统微生物法省时、省力,且重复性较好,无需大型仪器[34],大大降低了检测成本。因此,本研究建立的微生物显色法可在中小型禽畜肉养殖加工企业中推广,并可应用在农产品安全监管环节中。
参考文献:
[1] 李磊, 周贻兵, 张权, 等. QuEChERS净化超高效液相色谱-串联质谱法快速测定鸡蛋中13 种喹诺酮类抗生素[J]. 现代预防医学, 2018, 45(24): 4482-4486; 4490.
[2] TONG Changlun, ZHUO Xiajun, GUO Yun. Occurrence and risk assessment of four typical fluoroquinolone antibiotics in raw and treated sewage and in receiving waters in Hangzhou, China[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7303-7309. DOI:10.1021/jf2013937.
[3] 姚倩钰, 贺德春, 龚道新, 等. 高效液相色谱-串联质谱法测定废水中5 种喹诺酮类抗生素[J]. 中国环境监测, 2017, 33(3): 139-146. DOI:10.19316/j.issn.1002-6002.2017.03.21.
[4] BOXALL A B A. The environmental side effects of medication[J]. EMBO Reports, 2004, 5(2): 1110-1116. DOI:10.1038/sj.embor.7400307.
[5] 王秀茹. 大环内酯类药物的性质、特点及应用[J]. 兽医导刊, 2018(19): 54-55.
[6] 杜业刚, 阳洪波, 古丽君, 等. UPLC-MS/MS法同时测定动物源性食品中8 种多肽类抗生素[J]. 食品工业科技, 2016, 37(8): 85-91. DOI:10.13386/j.issn.1002-0306.2016.08.009.
[7] 刘少颖, 黄希汇, 胡柯君, 等. 杭州市动物性食品中喹诺酮类抗生素残留水平及安全性评价[J]. 中国卫生检验杂志, 2018, 28(18): 2280-2282; 2285.
[8] 刘晓冬, 林洪, 江洁. 动物源性食品中氨基糖苷类抗生素检测技术的研究进展[J]. 安徽农业科学, 2010, 38(8): 4128-4132. DOI:10.13989/j.cnki.0517-6611.2010.08.132.
[9] 朱虹. 动物源性食品中抗生素残留的危害和检测方法[J]. 产业与科技论坛, 2016, 15(14): 64-65.
[10] KARAGEORGOU E, CHRISTOFORIDOU S, IOANNIDOU M, et al. Detection of β-lactams and chloramphenicol residues in raw milk-development and application of an HPLC-DAD method in comparison with microbial inhibition assays[J]. Foods, 2018, 7(6): E82. DOI:10.3390/foods7060082.
[11] 张亚莉, 哈婧, 赵静, 等. 动物组织中抗生素残留研究进展[J].?河北科技大学学报, 2013, 34(6): 517-525. DOI:10.7535/hbkd.2013yx06004.
[12] 卢坤, 童群义. 动物源性食品中抗生素残留检测技术研究发展[J]. 广州化工, 2015, 43(12): 13-14.
[13] 李小会, 李海星, 段亚军, 等. 免疫分析技术在乳及乳制品抗生素类兽药残留检测中的应用[J]. 食品安全质量检测学报, 2018, 9(4): 776-780. DOI:10.3969/j.issn.2095-0381.2018.04.016.
[14] 羅瑞香, 朱静, 王海滨. 2011—2014年屎肠球菌和粪肠球菌临床分布特点及耐药性分析[J]. 感染、炎症、修复, 2016, 17(2): 95-97. DOI:10.3969/j.issn.1672-8521.2016.02.009.
[15] LINK N, WEBER W, FUSSENEGGER M. A novel generic dipstick-based technology for rapid and precise detection of tetracycline, streptogramin and macrolide antibiotics in food samples[J]. Journal of Biotechnology, 2007, 128(3): 668-680. DOI:10.1016/j.jbiotec.2006.1 1.011.
[16] 张志超, 程和发. 环境介质中喹诺酮类抗生素的前处理与检测方法研究进展[J]. 环境化学, 2019, 38(1): 1-22. DOI:10.7524/j.issn.0254-6108.2018020203.
[17] NOEMI D G, ALEXANDRA J, ALBERTO Z G, et al. Simultaneous determination of quinolone and β-lactam residues in raw cow milk samples using ultrasound-assisted extraction and dispersive-SPE prior to UHPLC-MS /MS analysis[J]. Food Control, 2016, 60: 382-393. DOI:10.1016/j.foodcont.2015.08.008.
[18] PARK Y K, FOX L K, HANCOCK D D, et al. Prevalence and antibiotic resistance of mastitis pathogens isolated from dairy herds transitioning to organic management[J]. Journal of Veterinary Science, 2012, 13(1): 103-105. DOI:10.4142/jvs.2012.13.1.103.
[19] 黄晓蓉, 郑晶, 吴谦, 等. 食品中多种抗生素残留的微生物筛检方法研究[J]. 食品科学, 2007, 28(8): 418-421. DOI:10.3321/j.issn:1002-6630.2007.08.102.
[20] 朱建恩. 牛奶中抗生素残留的微生物检测方法应用分析[J]. 食品安全导刊, 2018(21): 66-67. DOI:10.16043/j.cnki.cfs.2018.21.054.
[21] 福建省疾病预防控制中心. 食品卫生微生物学检验 鲜乳中抗生素残留检验: GB/T 4789.27—2008[S]. 北京: 中国标准出版社, 2008.
[22] 中华人民共和国上海出入境检验检疫局. 动物源食品中大环内酯类抗生素残留检测方法 第3部分: 微生物抑制法:?SN/T 1777.3—2008[S]. 北京: 中国标准出版社, 2008.
[23] 王媛媛, 王攀, 刘晓辉, 等. 不同抗生素检测方法检测乳清粉样品结果差异性分析[J]. 中国乳业, 2015(1): 60-63. DOI:10.3969/j.issn.1671-4393.2015.01.016.
[24] 农业部畜禽产品质量监督检验测试中心. 猪组织中四环素族抗生素残留量检测方法 微生物学检测方法: GB/T 20444—2006[S].?北京: 中国标准出版社, 2006.
[25] SLAVKO M, NIKOLETA N. Influence of preservative concentration, pH value and fat content in raw mlk at detection limit of microbial Inhibitor tests (Delvotest? Accelerator) for amoxicillin and oxytet-racycline[J]. Food Analytical Methods, 2016, 9(10): 2864-2871. DOI:10.1007/s12161-016-0476-8.
[26] 任皓威, 马明, 刘宁, 等. 原料乳及乳制品中抗生素残留微生物检测及风险评估技术初探[J]. 饲料博览, 2017(1): 11-13. DOI:10.3969/j.issn.1001-0084.2017.01.003.
[27] 劉兴泉, 冯震, 姚蕾, 等. 采用高通量微生物法和HPLC法检测猪肉中四环素和磺胺类抗生素残留[J]. 食品与发酵工业, 2011, 37(4): 194-197. DOI:10.13995/j.cnki.11-1802/ts.2011.04.006.
[28] OKERMAN L, NOPPE H, CORNET V, et al. Microbiological detection of 10 quinolone antibiotic residues and its application to artificially contaminated poultry samples[J]. Food Additives and Contaminants, 2007, 24(3): 252-257. DOI:10.1080/02652030600988020.
[29] 张盼, 沈振华, 张燕华, 等. 8 株产NDM-1肠杆菌科细菌的耐药特点和流行性分析[J]. 检验医学, 2018, 33(7): 616-621. DOI:10.3969/j.issn.1673-8640.2018.07.009.
[30] 刘冬梅, 郭均, 梁洁英, 等. 牛奶中β-内酰胺类抗生素残留检测试剂盒的研制[J]. 现代食品科技, 2014, 30(10): 251-256. DOI:10.13982/j.mfst.1673-9078.2014.10.042.
[31] 刘雪杰. 牛奶中抗生素残留检测指示菌的筛选鉴定及检测试剂盒研发[D]. 福州: 福州大学, 2013: 50-53.
[32] 王超逸, 马凯, 王勇军. 微生物法检测乳粉中抗生素残留的构建[J]. 浙江农业科学, 2013(3): 309-311. DOI:10.16178/j.issn.0528-9017.2013.03.037.
[33] 农业部兽医局. 中华人民共和国农业部公告第235号[EB/OL]. (2008-03-04) [2019-02-20]. http://jiuban.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm.
[34] 谢莉, 程华, 董超, 等. 牛奶中抗生素残留检测试剂盒的研制及应用[J].?食品工业科技, 2010, 31(2): 321-323. DOI:10.13386/j .issn1002-0306.2010.02.070.
- 皱皮木瓜与光皮木瓜的临床鉴别运用
- 沙利度胺在中晚期宫颈癌患者中的研究进展
- 中医药治疗胃癌前病变的研究进展
- 中药熏洗法在骨科中的运用研究进展
- 关于糖尿病诊断治疗的研究
- 无创呼吸机辅助呼吸治疗新冠肺炎患者的护理
- 探讨急诊快速型心房颤动的中医综合护理措施
- 脑卒中后鼻饲患者发生SAP的护理因素讨论
- 老年高血压患者社区护理干预的效果观察
- 呼吸内科护理中重症患者的临床护理效果及探究
- 中医护理技术在面瘫病中的运用效果探究
- 探讨妇产科常见的感染因素和相应的护理措施
- 健康教育联合心理护理干预对妊娠期糖尿病患者妊娠结局的影响
- 小儿头皮静脉输液的综合护理干预及效果探究
- 综合护理促进乳腺癌改良根治术后患肢功能康复的效果评价
- 探讨老年糖尿病患者夜间低血糖的预防及护理对策
- 探讨连续性床旁血液净化在多器官功能衰竭中的应用及护理意义
- 上消化道出血患者在内科护理中效果观察
- 人性化护理对妊娠高血压综合征患者妊娠结局的影响
- 人性化护理在内科中的实施及其效果分析
- 观察糖尿病患者护理中饮食指导的应用效果
- 优质护理在妇产科护理中的应用效果
- 护理团队在急诊科护理质量管理中的应用
- 专科护理管理在糖尿病高危人群中的应用效果
- 循证护理对慢性胃炎患者护理质量及生存质量的影响评价
- working life
- workinglife
- workingly
- working order
- working out
- workingpaper
- working paper
- workingpartner
- working partner
- working party
- workingparty
- workings
- working time directive
- workingtimedirective
- workingweek
- working week
- work in/into
- work in progress
- workinprogress
- work it/things
- worklifebalance
- work-life balance
- workload
- workloads
- workman
- 一口不能插两匙
- 一口不能着两匙。
- 一口不能著两匙
- 一口两匙
- 一口两舌
- 一口井
- 一口价
- 一口传一舌
- 一口口儿
- 一口吃下去
- 一口吃下扁担
- 一口吃不成个胖和尚
- 一口吃不成个胖子
- 一口吃不成胖子
- 一口吃个胖子
- 一口吃个鞋帮——心里有底
- 一口吃个鞋帮——心里有底儿
- 一口吃了九个馒头
- 一口吃十二个包子
- 一口吃成胖子
- 一口吃条绳子
- 一口同声
- 一口同音
- 一口吞
- 一口吞不下一个馒头