宋文欣 陈清华 杨惠贞 蒙姣荣 李界秋
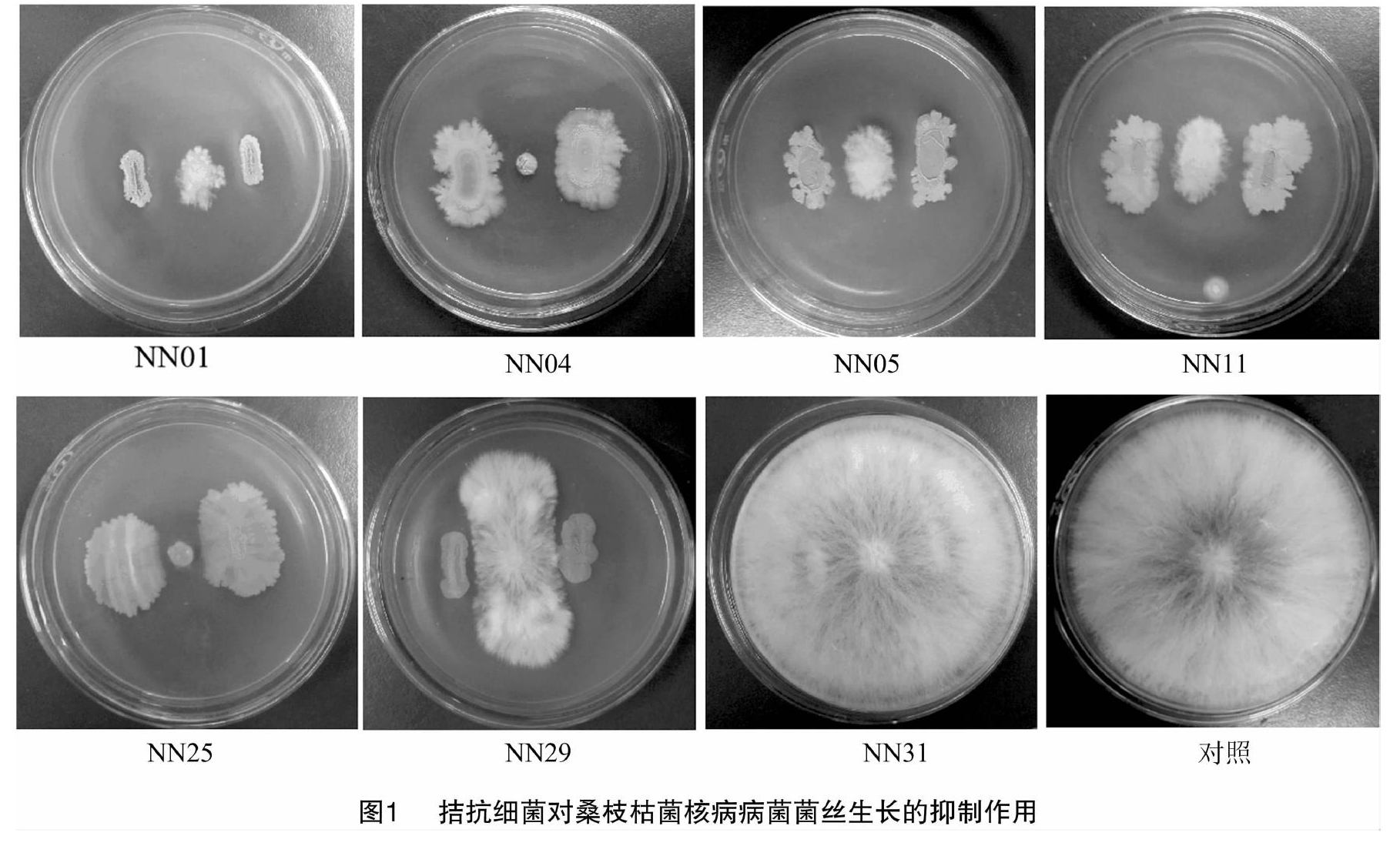

摘要:为获得有效防治桑枝枯菌核病的生防菌,通过对峙培养法筛选对桑枝枯菌核病病菌具有抑制作用的拮抗菌株,獲得6株抑制作用较强的芽孢杆菌,其菌丝抑制率在65.41%~91.41%之间。叶片离体试验结果显示,6个菌株均能较好地抑制病斑的发展,其防治效果在50.00%~85.71%之间,均高于化学药剂对照40%嘧霉胺可湿性粉剂的防治效果(47.62%),其中以NN05菌株的防治效果最好,达85.71%。胞外酶活性检测结果显示,6个拮抗菌株均能产生胞外蛋白酶,均不能产生几丁质酶;除了NN05菌株外,其他5个菌株均具有溶磷作用;还有3株菌株(NN01、NN04和NN05)可以产生β-1,3-葡聚糖酶,3株菌株(NN05、NN11和NN29)可以产生纤维素酶。经16SrDNA序列和gyrB基因序列分析,将NN01、NN04、NN05菌株鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis),NN11、NN25、NN29菌株鉴定为枯草芽孢杆菌(Bacillussubtilis)。本研究结果可以为桑枝枯菌核病的生物防治提供菌种资源。
关键词:桑枝枯菌核病;生物防治;胞外酶活性;贝莱斯芽孢杆菌;枯草芽孢杆菌;拮抗菌
中图分类号:S888.71+3文献标志码:A
文章编号:1002-1302(2020)22-0106-05
作者简介:宋文欣(1995—),女,山东莒县人,硕士研究生,主要从事植物病理学研究。E-mail:1093441288@qq.com。
通信作者:李界秋,硕士,高级实验师,主要从事植物病害防治研究。E-mail:ljq@geu.edu.cn。
桑枝枯菌核病是春季桑园中常见的桑树真菌性病害,该病主要危害春季新萌发的桑芽及枝梢,在芽基部形成褐色病斑,皮层组织严重腐烂,导致桑枝折断,造成桑芽、新梢枯萎,严重发生时全田倒伏,春梢枯死[1-2],遇上3月天气异常(特别偏冷或偏暖)年份,桑枝枯菌核病常常大面积暴发,造成桑叶年产量减少,严重影响桑蚕生产[2]。目前,对于桑枝枯菌核病的防治,主要强调种植抗病品种、清洁田园、及时清除病残枝,并加强桑园田间管理以培育健壮植株,必要的时候要进行化学防治[2-3]。然而,化学防治会对环境造成污染,且易造成家蚕中毒[2]。生物防治对环境污染小,能发挥持续的控制作用,具有安全、成本低的特点,是当前植物病害绿色防控的主要措施之一。芽孢杆菌(Bacillusspp.)是主要的植物病害生防菌种类[4],针对桑树病害病原菌的芽孢杆菌类拮抗菌的筛选与鉴定已有一些相关的报道。王若琳等从健康桑树茎中分离获得内生贝莱斯芽孢杆菌(B.velezensis)NPJ13菌株,对桑断枝烂叶病菌(Boeremiaexigua)具显著的拮抗作用[5]。方翔等也从桑树健康植株中分离获得对肥大性桑葚菌核病菌(Solerotiniasclerotiorum)具有较强抑制作用的贝莱斯芽孢杆菌菌株[6-7]。谢洁等从桑树中分离到枯草芽孢杆菌(Bacillussubtilis)菌株7PJ-16,对桑葚缩小性菌核病菌(S.shiraiana)有明显的抑制作用[8-9]。除此之外,国内外尚未有专门针对桑枝枯菌核病生物防治研究的相关报道。蛋白酶、几丁质酶、纤维素酶和β-1,3-葡聚糖酶等由拮抗菌分泌的胞外酶均与生防菌的防病及促生效果直接相关[4,10]。了解拮抗菌产生胞外酶的种类,可以对其抑菌机制及应用潜力作出初步的评价。
前期研究中,蒙朋从桑园土壤、桑根和桑枝上获得一批对桑树细菌性枯萎病病菌有抑制作用的芽孢杆菌菌株[11],为探明这些菌株是否同时对桑枝枯菌核病病菌具有抑制作用,本研究选择其中10个菌株,采用对峙培养法测定其对桑枝枯菌核病病菌菌丝的抑制作用,同时进行离体接种初步评估其防治效果,用透明平板法对其产生胞外酶的种类进行初步检测,以期筛选出桑枝枯菌核病潜在的生防菌株,为桑枝枯菌核病的生物防治提供菌种资源,同时为研究拮抗菌的抑菌机制奠定基础。
1材料与方法
1.1试验材料
供试病原菌:桑枝枯菌核病病菌(S.sclerotiorum),由亚热带农业生物资源保护与利用国家重点实验室(广西大学)分离并鉴定。
候选拮抗芽孢杆菌菌株来源:10株候选拮抗菌株为笔者所在实验室前期研究获得,其中NN04、NN05、NN25从桑根分离得到,NN01、NN09、NN12从桑茎分离得到,NN11、NN29、NN31、NN82从桑园土壤中分离得到[11]。试验用马铃薯葡萄糖(PDA)培养基、LB(Luria-Bertani)培养基、牛肉膏蛋白胨(NA)培养基及其培养液均按照常规方法配制。
40%嘧霉胺可湿性粉剂和枯草芽孢杆菌可湿性粉剂(1000亿个/g),均由中国农业科学院植物保护所廊坊农药中试厂生产。胶回收试剂盒购自OMEGA公司,2×ESTaqMasterMix购自康为世纪,引物由北京三博远志生物技术有限责任公司合成。
本试验于2015—2019年间在广西大学农学院及亚热带农业生物资源保护与利用国家重点实验室(广西大学)完成。
1.2试验方法
1.2.1桑枝枯菌核病病菌拮抗细菌的筛选
参照文献采用平板对峙培养法[12]进行拮抗细菌的筛选,稍有改动。桑枝枯菌核病病菌在PDA平板上28℃条件下培养3~5d,用内径6mm的打孔器在平板上取菌饼,并倒置于牛肉膏蛋白胨培养基中央,在距离病原菌菌片约2.0cm处接种拮抗细菌,划成长度约1cm的接种带,每种拮抗菌3次重复,以只接病原菌不接拮抗菌的平皿为对照,重复2次。在28℃恒温条件下培养,对照平皿上病原菌菌丝长满整个培养皿后,测量菌丝带的宽度及对照的菌落直径,按如下公式计算菌丝生长抑制率:菌丝生长抑制率=(1-处理菌落净生长量/对照菌落净生长量)×100%;净生长量=菌落直径-菌饼直径。
1.2.2离体叶片接种病斑抑制效果的测定
拮抗菌用LB培养基培养3d,离心(10000r/min,離心10min)取上清发酵液喷雾健康桑叶正面和背面各3次,即整张叶片全部湿润、晾干、再喷雾,重复3次,晾干后接种直径为0.6cm生长一致的桑枝枯菌核病病菌菌丝圆片,每张叶片2个接种点,每个拮抗菌株处理2张叶片,在28℃条件下保湿,4d后采用十字交叉法型测量病斑直径。以同样的方法喷雾40%嘧霉胺可湿性粉剂(稀释1500倍)和枯草芽孢杆菌可湿性粉剂(1000亿个/g,稀释1000倍)分别作为化学防治及生物防治药剂的对照,以接种病原菌而不喷拮抗菌的健康桑叶为空白对照,并按如下公式计算防治效果:防治效果=(1-处理病斑直径/对照病斑直径)×100%。采用SPSS18.0软件对菌丝生长抑制率和防治效果等试验数据进行统计分析,并进行差异显著性检验。
1.2.3拮抗菌胞外酶活性的测定
蛋白酶检测培养基、纤维素酶检测培养基、β-1,3-葡聚糖酶检测培养基和几丁质酶检测培养基参照王芳等的方法[10]进行配制及检测各酶的活性,用来检测无机磷溶解能力的改良PVK培养基参照李海云等的方法[13]进行配制及测定。
1.2.4拮抗芽孢杆菌的分子鉴定
参照文献[14]中的方法提取拮抗芽孢杆菌菌株的总DNA。以总DNA作为模板,引物fD2/rP1扩增16SrDNA序列,引物UP1/UP2扩增gyrB基因部分序列[11]。反应体系总体积为50μL,其中2×TSINGKEMasterMix25μL、总DNA(10~20ng/μL)2μL、上下游引物各2μL、ddH2O19μL;反应程序为95℃预变性30s;94℃变性30s,55℃(16SrDNA)或者57℃(gyrB基因)退火30s,72℃延伸45s,30个循环;72℃延伸5min。[JP3]上述反应获得的PCR产物经过1.0%琼脂糖凝胶电泳检测进行胶回收纯化,克隆至pEASY-T1载体,转化大肠杆菌(Escherichiacoli)DH5α感受态细胞,在含50mg/L氨苄青霉素的LA平板上挑取单菌落,进行菌落PCR鉴定,提取阳性克隆质粒,测序。序列结果在NCBI数据库进行BLASTn(http://blast.ncbi.nlm.nih.gov)比对,下载相似性较高的标准菌株核苷酸序列,使用MegaX软件进行序列的多重比对,并采用邻接法构建系统发育树。
2结果与分析
2.1拮抗菌的筛选
以桑枝枯菌核病病菌作为靶标,用室内平板对峙生长法测定前期研究获得的10个芽孢杆菌菌株的抑菌效果,结果显示,NN01、NN04、NN05、NN11、NN25和NN29等6个菌株对桑枝枯菌核病病菌的菌丝生长具有明显的抑制作用,抑菌率在65.41%~91.41%之间;其他4个菌株(NN31等)没有明显的抑菌作用(图1)。进行第2次重复筛选,除了NN29菌株外,其他菌株的菌丝抑菌率均高于45.00%。
2.2拮抗菌的离体防治效果
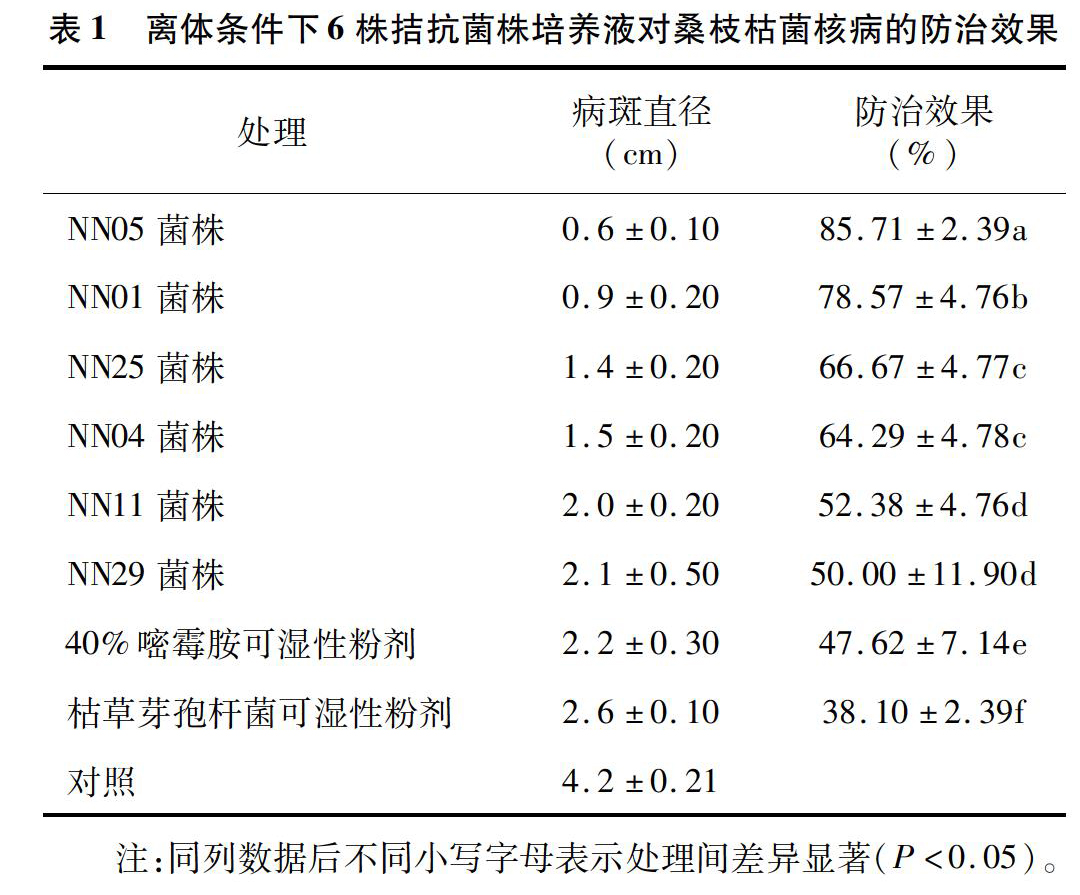
叶片离体接种结果显示,在桑叶上6个拮抗菌菌株的发酵液均能有效抑制病斑的扩展。温度为28℃条件下,接种4d后,对照桑叶的病斑直径达到(4.2±0.21)cm,而拮抗菌处理的桑叶病斑直径均在(2.1±0.50)cm以下,防治效果在50.0%~85.71%之间,其中以NN05菌株的防治效果最好,NN01菌株的次之,其防治效果分别为85.71%、78.57%,再次是菌株NN25、菌株NN04,其防治效果分别为66.67%、64.29%,均显著高于化学防治对照40%嘧霉胺可湿性粉剂的防治效果(47.62%);NN11、NN29菌株的防治效果较低,分别为52.38%、50.00%,与40%嘧霉胺可湿性粉剂的防治效果相当(表1)。
2.3拮抗菌株的胞外酶活性
胞外酶活性检测结果(表2)显示,6个拮抗菌株在蛋白酶培养基上都可以产生透明酶解圈,在几丁质酶检测培养基上都不产生透明酶解圈,表明所有拮抗菌株均能产生胞外蛋白酶,均不能产生几丁质酶;除了NN05菌株外,其他5个菌株在改良PVK培养基上均能产生透明圈,显示其具有解磷作用;菌株NN11、NN05、NN29在纤维素酶培养基上可以产生透明圈,表明可以产生纤维素酶;菌株NN01、NN04、NN05在β-1,3-葡聚糖酶培养基上可以产生透明圈,说明可以产生β-1,3-葡聚糖酶。以NN05产生的物质种类较多,可以同时产生蛋白质酶、纤维素酶和β-1,3-葡聚糖。
2.4拮抗芽孢杆菌的分子鉴定
提取拮抗菌株总DNA作为模板,以引物fD2/rP1进行PCR扩增得到一个大小为1500bp左右的特异性条带,测序结果显示,所有菌株的目标16SrDNA序列长度为1513bp,不同菌株间16SrDNA序列相似性在99.3%~99.9%之间(登录号为MT114568,MT114570~MT114574)。BLASTn比对结果显示,这些菌株的16SrDNA序列与枯草芽孢杆菌复合群内种类的相似性均超过93.3%,其中NN05、NN01、NN04菌株与贝莱斯芽孢杆菌(B.velezensis)和解淀粉芽孢杆菌(B.amyloliquefaciens)的相似性最高,分别为99.8%、99.7%;NN25、NN29、NN11菌株与枯草芽孢杆菌枯草亚种(B.subtilissubsp.subtilis)的相似性最高,达99.8%。
同样,以6个菌株的基因组DNA为模板扩增gyrB基因部分片段,测序结果显示,所有菌株gyrB基因目标片段序列的长度均为1259bp,不同菌株gyrB基因序列相似性在80.3%~98.9%之间(登录号为MT119755,MT119757~MT119761)。BLASTn比对结果显示,NN01、NN04、NN05菌株gyrB基因与贝莱斯芽孢杆菌(B.velezensis)的相似性最高,达到98.2%,与解淀粉芽孢杆菌(B.amyloliquefaciens)的相似性次之,为95.9%;与枯草芽孢杆菌复合群其他种的相似性则比较低,如与枯草芽孢杆菌枯草亚种的相似仅有79.9%。NN11、NN25、NN29菌株gyrB基因序列则与枯草芽孢杆菌枯草亚种的相似性最高,为98.2%,与枯草芽孢杆菌斯氏亚种(B.subtilissubsp.spizizeni)和枯草芽孢杆菌沙漠亚种(B.subtilissubsp.inaquosorum)的相似性依次为94.1%、93.4%。基于gyrB基因构建的系统进化树结果显示,菌株NN01、NN04、NN05与贝莱斯芽孢杆菌(B.velezensis)聚集为独立的分支,亲缘关系较近;菌株NN25、NN29、NN11则与枯草芽孢杆菌枯草亚种聚集为独立的分支(图2)。依据16SrDNA序列和gyrB基因序列及系统进化树的分析结果,将菌株NN01、NN04、NN05鉴定为贝莱斯芽孢杆菌,菌株NN11、NN25、NN29鉴定为枯草芽孢杆菌。
3讨论与结论
枯草芽孢杆菌复合群内种间具有较高的遗传相似性,通过16SrDNA序列比对难以准确确定其种水平的分类地位[15]。目前已有多种编码蛋白的基因,如gyrB基因等被用于枯草芽孢杆菌复合群的分类研究中[5,15]。本研究测定了6株拮抗菌株的16SrDNA序列,比对结果显示,所有菌株的16SrDNA序列与枯草芽孢杆菌复合群内的大多种类核苷酸水平的相似性均高于99.3%,结合gyrB基因的序列分析及系统进化树分析,将它们分别鉴定为贝莱斯芽孢杆菌和枯草芽孢杆菌。枯草芽孢杆菌具有较高的防病促生功能和较强的抗逆能力,是最早被应用于作物病害生物防治的菌种之一[4,10]。贝莱斯芽孢杆菌具有广谱抑菌活性和促进植物生长的作用,在农业生产中具有较好的开发潜力[16-19]。本研究获得的枯草芽孢杆菌和贝莱斯芽孢杆菌菌株对桑枝枯菌核病病菌菌丝具有较强的抑制作用,离体接种防治试验结果显示其防治效果均高于50.00%,具有较好的生防潜力。今后将进一步验证其田间的防治效果,最终为桑枝枯菌核病的生物防治提供优良的生防菌株。
拮抗芽孢杆菌通常可以产生一些胞外酶,如β-1,3-葡聚糖酶、几丁质酶、蛋白酶和纤维素酶等。邢介帅等从小麦根际土壤中分离得到的生防细菌T2菌株高产蛋白酶[20]。孙建波等筛选出对香蕉枯萎病有强抑制作用的拮抗菌株具有较高的几丁质酶活性[21]。β-1,3-葡聚糖酶是拮抗菌常见的拮抗蛋白,异源枯草芽孢杆菌Em7菌株的β-1,3-葡聚糖酶基因,其产物可以有效抑制病原菌菌丝的生长[22]。有研究显示,能产生多种胞外酶的拮抗菌株的生防效果较好[10]。本研究获得的6个拮抗菌株多数均能产生2种或2种以上的胞外酶,其中以NN05菌株产生的种类最多,可以同时产生蛋白质酶、纤维素酶和β-1,3-葡聚糖酶,离体接种结果也显示NN05菌株的防治效果最好,离体防效达85.71%,是最具有应用潜力的拮抗菌株。微生物溶磷可转化水体和土壤中难溶性无机磷,促进植物生长,改善土壤磷肥状况[23],那些同时具有抑菌能力和解磷能力的菌株除了具有生物防治的效果,还可以促进植物生长,具有用于制备新型抑菌生物菌肥的潜力[24]。本研究中获得5个具有解磷能力的菌株,在今后复合生防菌的利用中,可以考虑使用這些具有解磷能力的菌株,以增强其促生作用,提高生防效果。
参考文献:
[1]李乙,朱方容,陈小青,等.广西桑树主要病害调查初报[J].广西蚕业,2010,47(2):23-26.
[2]谢锦灵.宜州市桑枝枯菌核病发生流行规律及综合防治措施[J].广西植保,2016,29(1):18-20.
[3]毛建萍,浦冠勤,薛忠庆,等.桑枝枯菌核病药剂防治试验[J].江苏蚕业,2002(1):52-54.
[4]马佳,李颖,胡栋,等.芽孢杆菌生物防治作用机理与应用研究进展[J].中国生物防治学报,2018,34(4):639-648.
[5]王若琳,徐伟芳,王飞,等.桑树内生拮抗菌的分离鉴定及其对桑断枝烂叶病的生防初探[J].微生物学报,2019,59(11):2130-2143.
[6]方翔,徐伟芳,牛娜,等.一株桑树内生拮抗菌的分离、鉴定及发酵条件优化[J].微生物学报,2018,58(12):2147-2160.
[7]XuWF,WangF,ZhangM,etal.Diversityofcultivableendophyticbacteriainmulberryandtheirpotentialforantimicrobialandplantgrowth-promotingactivities[J].MicrobiologicalResearch,2019,229:126328.
[8]谢洁,任慧爽,唐翠明,等.一株桑树内生细菌的鉴定和对桑椹核地杖菌的拮抗作用[J].蚕业科学,2015,41(5):815-824.
[9]XuWF,RenHS,OuT,etal.GenomicandfunctionalcharacterizationoftheendophyticBacillussubtilis7PJ-16strain,apotentialbiocontrolagentofmulberryfruitsclerotiniose[J].MicrobialEcology,2019,77(3):651-663.
[10]王芳,吕顺,刘文清,等.香蕉枯萎病生防菌的筛选及生防物质分析[J].江西农业大学学报,2014,36(6):1264-1269.
[11]蒙月月.桑树细菌性枯萎病菌生物学特性研究及其拮抗细菌和防治药剂筛选[D].南宁:广西大学,2014.
[12]KhamnaS,YokotaA,LumyongS.Actinomycetesisolatedfrommedicinalplantrhizospheresoils:diversityandscreeningofantifungalcompounds,indole-3-aceticacidandsiderophoreproduction[J].WorldJournalofMicrobiologyandBiotechnology,2009,25(4):649-655.
[13]李海云,牛世全,孔维宝,等.猪粪堆肥中一株溶磷菌的筛选鉴定及溶磷能力初步测定[J].环境科学学报,2015,35(5):1464-1470.
[14]奥斯伯F.M,,布伦特R.,金斯顿R.E.,等.精编分子生物学实验指南[M].金由辛,包慧中,赵丽云,等译.5版.北京:科学出版社,2008:39-40.
[15]曹凤明,杨小红,马鸣超,等.枯草芽孢杆菌近缘种群鉴定方法研究进展[J].微生物学通报,2014,41(5):968-974.
[16]HashemA,TabassumB,FathiAbdAllahE.Bacillussubtilis:aplant-growthpromotingrhizobacteriumthatalsoimpactsbioticstress[J].SaudiJournalofBiologicalSciences,2019,26(6):1291-1297.
[17]DunlapCA,KimSJ,KwonSW,etal.BacillusvelezensisisnotalaterheterotypicsynonymofBacillusamyloliquefaciens,Bacillusmethylotrophicus,Bacillusamyloliquefacienssubsp.plantarumand‘BacillusoryzicolaarelaterheterotypicsynonymsofBacillusvelezensisbasedonphylogenomics[J].InternationalJournalofSystematicandEvolutionaryMicrobiology,2016,66(3):1212-1217.[HJ2mm]
[18]RabbeeMF,AliMS,ChoiJ,etal.Bacillusvelezensis:avaluablememberofbioactivemoleculeswithinplantmicrobiomes[J].Molecules,2019,24(6):1046.
[19]陶永梅,潘洪吉,黄健,等.新型生防微生物因子贝莱斯芽孢杆菌(Bacillusvelezensis)的研究与应用[J].中国植保导刊,2019,39(9):26-33.
[20]邢介帅,李然,赵蕾,等.产蛋白酶生防细菌的筛选及其对病原真菌的拮抗作用[J].西北农业学报,2008,17(1):106-109.
[21]孙建波,王宇光,李伟,等.产几丁质酶香蕉枯萎病拮抗菌的筛选、鉴定及抑菌作用[J].果树学报,2010,27(3):427-430.
[22]WangNN,GaoXN,YanX,etal.Purification,characterization,andheterologousexpressionofanantifungalproteinfromtheendophyticBacillussubtilisstrainEm7anditsactivityagainstSclerotiniasclerotiorum[J].GeneticsandMolecularResearch:GMR,2015,14(4):15488-15504.
[23]宮安东,孔宪巍,翟新可,等.枯草芽孢杆菌WY8-7的溶磷、抑菌及促生长作用[J].南京农业大学学报,2019,42(4):697-705.
[24]郭立佳,汪军,杨腊英,等.芽孢杆菌JK05的鉴定及其对香蕉、玉米的促生和生防潜能研究[J].热带作物学报,2020,41(2):351-358.
- 弘扬中华体育精神 坚定体育文化自信
- 苗族文化融入小学语文
- 浅析小学低年级课间游戏活动实践
- 小学体育中提高学生体质健康水平的策略探究
- 新时期电子科学技术的实际应用
- 关于群文阅读教学的尝试与思考
- 浅谈如何培养小学生的科学素养
- 浅析翻转课堂在初中生物教学中的应用
- 小学体育教学质量提高的途径与策略研究
- 浅析核心素养背景下的高中政治议题式教学策略
- 简析新高考背景下的高中地理教学
- 探赜小学班主任班级管理中德育的渗透
- 浅析高中生数学建模核心素养的培养策略
- 微课在动物科学专业教学中的应用
- 新时代需具有创新精神
- 建筑工程结构力学计算中的自然辩证法原理
- 论现代信息技术在小学六年级语文教学中的有效运用
- 以职业技能大赛促进教学团队建设
- 高校党建与大学生思想政治教育有效融合路径研究
- 初中英语课堂上的互动教学有效策略
- 高中共青团德育工作开展实践探索
- 数学教育教学践行新课改理念的实践
- 如何提高初中道德与法治课堂教学的有效性
- 小学美术课堂有效教学的策略
- 思维导图
- miscorrelation
- miscorrelations
- miscount
- miscounted
- miscounting
- miscounts
- miscreates
- miscreating
- miscreations
- miscreed
- miscultivated
- miscut
- miscuts
- miscutting
- misdated
- misdates
- misdating
- misdecide
- misdecision
- misdeclare
- misdeclared
- misdeclares
- misdeclaring
- misdeeds
- misdeemed
- 复市
- 复常趋向
- 复底鞋
- 复建
- 复式
- 复式住宅
- 复式句
- 复式同语
- 复式成分
- 复式教学
- 复式构字成分
- 复式标题
- 复式税制
- 复式结构
- 复式记账法
- 复归
- 复循故辙
- 复心弘道
- 复指
- 复指与插说
- 复指代词
- 复指关系
- 复指动词
- 复指动词句型
- 复指句