陈花 关富佳 肖启圣 程亮
摘 ?????要:针对气体压缩因子计算精度制约了甲烷水合物分解热计算准确程度,从提高压缩因子计算精度和简单可行性出发,通过对复杂气体状态方程编程计算求取气体压缩因子,经与美国标准局数据对比发现Setzmann方程计算精度最高,应用于Clausius-Clapeyron方程计算水合物分解热,更接近于传统实验的量热法测试结果。同时,为了明确加入SDS对甲烷水合物分解热的影响,进行了室内合成实验,利用改进后的Clausius-Clapeyron方程计算了纯水条件下和含0.3% SDS甲烷水合物的分解熱,结果表明,在285 K下,含0.3%SDS条件下与纯水条件下合成的甲烷水合物分解热误差约为1.92%。
关 ?键 ?词:Clausius-Clapeyron方程;压缩因子;水合物;分解热
中图分类号:TQ 013 ??????文献标识码: A ??????文章编号: 1671-0460(2019)08-1783-05
Abstract: The accuracy of calculating the decomposition heat of methane hydrate is restricted by the accuracy of calculating the gas compression factor. In order to improve the calculation accuracy and simplicity of the compression factor, the gas compression factor was calculated by programming the complex gas state equation. Through comparing with the data of American Bureau of Standards, it was found that the Setzmann equation has the highest calculation accuracy. It was applied to Clausius-Clapeyron equation to calculate the dissociation heat of hydrate, which was closer to the calorimetry test results of traditional experiments. At the same time, in order to clarify the effect of SDS addition on the decomposition heat of methane hydrate, laboratory synthesis experiments were carried out. The decomposition heat of methane hydrate in pure water and 0.3% SDS was calculated by using the improved Clausius-Clapeyron equation. At 285K, the error of methane hydrate decomposition heat under 0.3% SDS and pure water conditions was about 1.92%.
Key words: Clausius-clapeyron equation; Compression factor; Hydrate; Dissociation heat
天然气水合物(NGH)是21世纪最具有开发潜力的高效、清洁能源,是由气体小分子和水在一定温度、压力条件下形成的笼型结晶状包合物[1]。其主要储存于深水区的海底沉积物和陆地永久冻土带中[2],1 m3天然气水合物可释放出164 m3甲烷气体[3]。NGH在合成与分解过程中的相变热是水合物基础物性参数之一,对其简便、准确的测量一直是水合物物性研究中极其重要的一部分[4]。目前国内外对于水合物动力学的研究、储存、抑制形成、预测生成 等方面研究很广泛[5],而对相变热精确计算的分析却很少。相变热测量方法主要有卡计法、差热分析法(DTA)和差示扫描量热法(DSC)等。Handa[6]、 Rueff[7]、Lievois[8]等通过量热法对气体水合物的分解热进行了测量,发现甲烷水合物在温度为285 K条件下平均分解热为54.48 kJ·mol-1;董福海等[9]提出了一种采用混合量热法测量常压下水合物分解热的实验方法,发现气体水合物相变热与冰接近。孙志高[10]等通过Lee-Kesler模型计算混合气体压缩因子,利用Clausius-Clapeyron方程得到了多元气体水合物分解热,但由于多孔介质中水合物平衡条件与理论值存在差异,且在低温高压条件下应用Clausius-Clapeyron方程计算分解热时,其中压缩因子计算不准确,导致了计算的结果误差较大;刘永红[11]通过NIST REFPROP6.01软件计算气体压缩因子,利用Clausius-Clapeyron方程得到了制冷剂气体水合物分解热;2008年李栋梁等[12]研究了甲烷-四丁基溴化铵(TBAB)水合物的分解条件,并应用Clausius-Clapeyron方程计算了该二元水合物的分解热。
运用Clausius-Clapeyron方程计算水合物的分解热是一种简单可行的方法,为了提高计算的准确性,需对不同状态方程的压缩因子计算结果进行对比分析,找到适用于Clausius-Clapeyron方程计算分解热的气体状态方程至关重要。本文利用水合物合成试验装置,测得添加质量浓度0.3%的SDS溶液的NGH生成的平衡温度、压力条件。同时,选取Vanderwaals方程、RK方程、SRK方程、PR方程、PRSV1方程、PRSV2方程、ESD方程、Setzmann方程,通过VB编程实现复杂气体状态方程计算压缩因子,并与美国标准局(NIST)数据进行对比。通过校正不同状态方程的压缩因子,选取适用于Clausius-Clapeyron方程的气体状态方程,提高分解热计算结果的准确性,对水合物的资源评估、勘探、开采、储运各个环节都具有重大意义[13]。
Clausius-Clapeyron方程是用于描述单组分系统在相平衡时压强随温度的变化率的方法。Sloan[14]指出,水合物在0 ℃以上时的分解,其水合物分解热△Hd可通过NGH水合物相平衡条件,利用Clausius-Clapeyron方程求得,具体公式如下:
由式(1)可以看出,NGH分解热与气体压缩因子及水合物相平衡条件有关,当lnP与1/T线性相关时,NGH分解热与气体压缩因子成正比关系,可以根据气体状态方程计算气体压缩因子,从而得到不同相平衡条件下的水合物分解热。
1.2 ?引入復杂气体状态方程计算压缩因子
决定NGH分解热计算精度的是甲烷气体压缩因子的计算准确程度。现有的压缩因子计算模型均是根据 Standing和 Katz 在 1941 年发表的压缩因子图表拟合而来的,导致适用条件与计算精度也各不相同, 但多数模型仅适用于常温常压情况。Dranchuk 与Abu-kassm 建立的用于高压情况下计算天然气压缩因子的模型(DAK 模型),以及李相方[15]建立的高压高精度天然气压缩因子解析模型(LXF 模型),两者适用的压力条件范围都非常有限,且误差较大。同时,NGH相平衡压力的对数和相平衡温度的倒数曲线的斜率为104~105数量级,因此压缩因子计算结果的微小偏差会带来较大的分解热计算误差。所以,不能片面的寻求状态方程中计算简便的计算公式,要保证计算结果的高精度、低误差,计算过程的复杂性可以利用VB编程解决,通过试算、循环迭代实现复杂公式的使用。
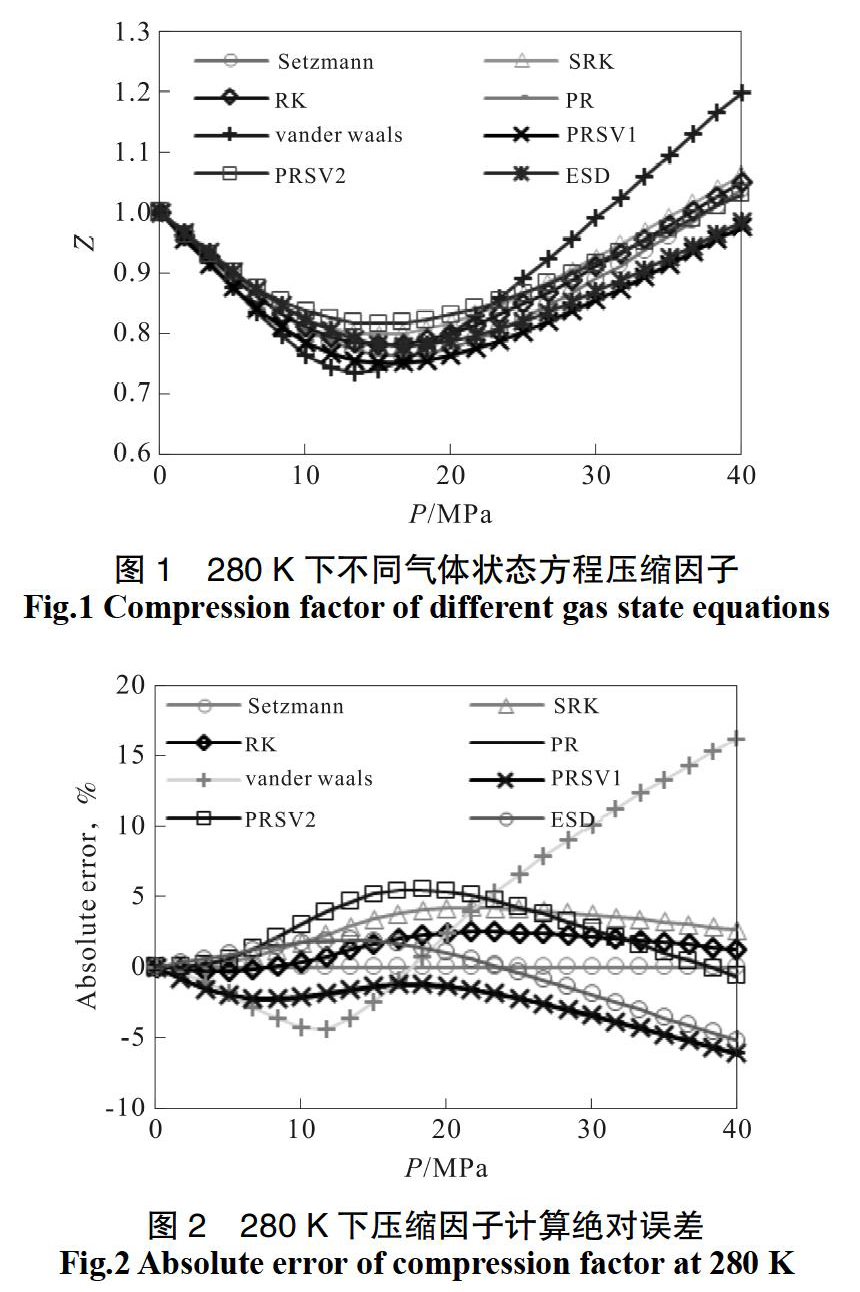
利用VB语言对Vanderwaals方程、RK方程、SRK方程、PR方程、PRSV1方程、PRSV2方程、ESD方程、Setzmann方程进行编程并计算CH4在不同温度下0~40 MPa下的压缩因子,与美国标准局(NIST)数据计算结果进行对比,温度为280 K时,计算结果及绝对误差如图1和图2所示。从图2可以看出,Setzmann方程在0~40 MPa下计算的压缩因子与美国标准局(NIST)数据计算结果相比,绝对误差在0.002 5%~0.008 3%,计算结果准确性高。因此,选用Setzmann方程计算的气体压缩因子来改进Clausius-Clapeyron方程分解热计算方法。
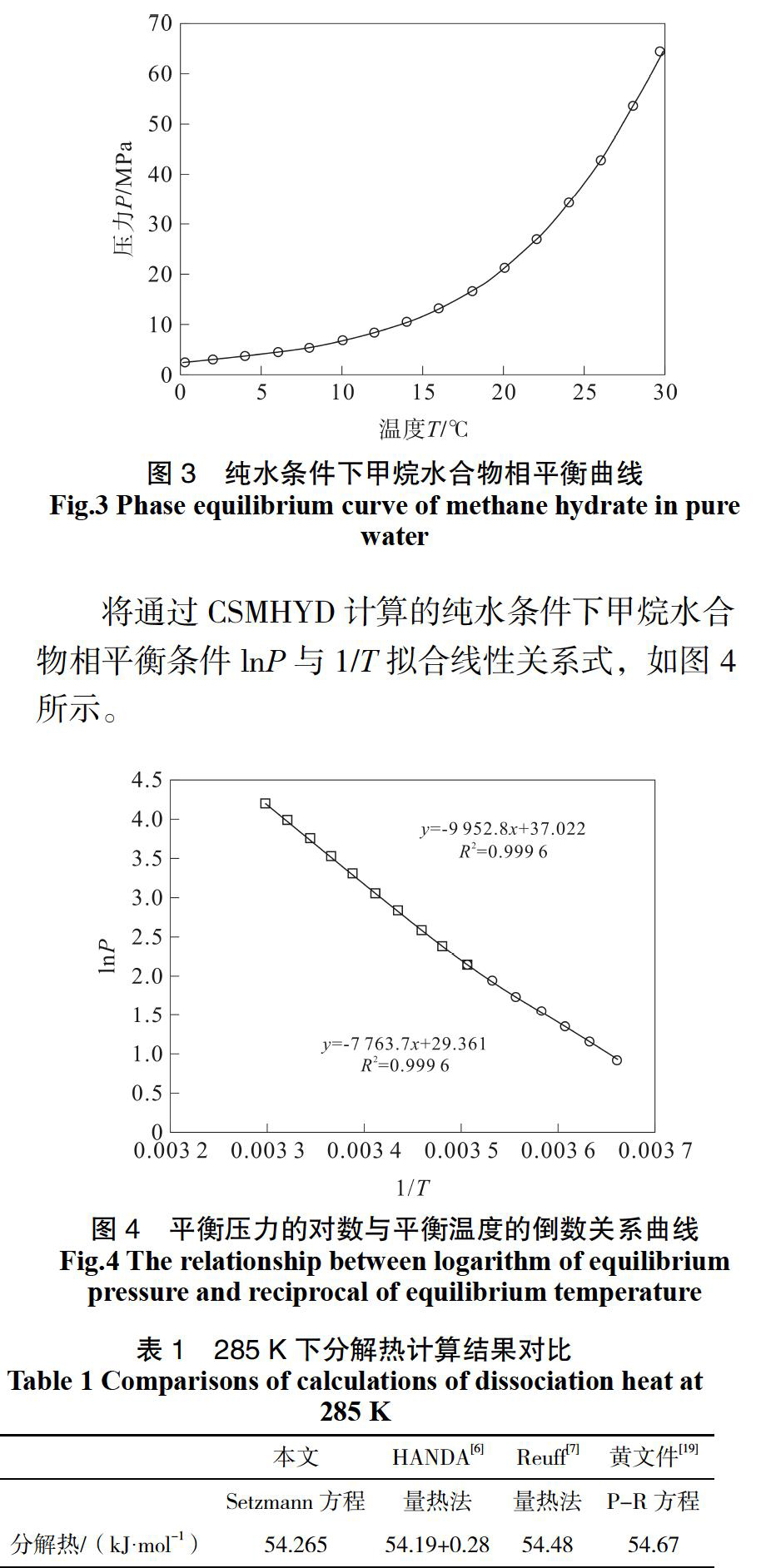
国内外学者基于热力学和动力学研究了气体水合物相平衡条件,得到了John-Holder模型、Chen-guo模型和Van der Waals-Platteeuw模型等一系列用于计算相平衡条件的模型,并通过编程简化了计算过程。由Sloan的CSMHYD[17,18]相平衡程序计算可得到纯水条件下,不同温度、压力条件下的甲烷水合物相平衡条件,如图3所示。
发现并不是在任意相平衡条件下呈完全一致的线性关系,而是以12 MPa为界分为两段,所以应用Clausius-Clapeyron方程计算分解热时,对于相平衡曲线的选择应当考虑气体水合物平衡温度、压力范围。通常情况下,实验室条件下合成甲烷水合物压力在12 MPa以下,故本文取斜率K为-7 763.7。
2.1.2 ?纯水条件下分解热计算
根据Setzmann方程计算程序得到甲烷压缩因子,通过绘制相平衡条件下lnP与1/T的关系曲线,拟合线性关系获得斜率K,得到改进的Clausius-Clapeyron方程,可以计算不同相平衡压力、温度下的分解热。与相同平衡温度条件下的量热法及Peng-Robinson方程计算压缩因子得到的分解热计算结果进行了对比,对比结果如表1所示。
HANDA[6]等用量热法测得的甲烷水合物分解热为(54.19+0.28)kJ/mol,与本文Setzmann方程计算结果相比,误差仅为0.14%。Reuff[7]等也用量热法对甲烷水合物的分解热进行了测量,与其285 K条件下的平均分解热54.48 kJ/mol相比,误差仅为0.4%。黄文件[19]等在相平衡温度为285 K条件下,通过P-R方程计算此温度条件下甲烷气体压缩因子,利用Clausius-Clapeyron方程计算甲烷水合物分解热为54.67 kJ/mol。与本文Setzmann方程计算的54.265 kJ/mol误差为0.74%。本文引入的Setzmann方程改进的Clausius-Clapeyron方程计算的分解热与传统的量热法测得的分解热相比误差小、精确度高,可以代替复杂且耗时的传统测量方法。
2.2 ?含0.3%SDS条件下甲烷水合物分解热计算
2.2.1 ?含0.3%SDS甲烷水合物合成实验
表面活性剂可降低水的表面张力,加快水合物的合成速度[20,21],其中SDS溶液常作为水合物生成的促进剂[22]。FEKLISTOV等[23]研究认为SDS溶液能够防止形成的水合物颗粒聚结,阻止在气液界面形成致密的水合物层阻碍气体进入液相,因此可促进水合物高效合成,但其对水合物样品物性参数的影响未知。 本文选用质量浓度0.3%的SDS溶液合成甲烷水合物,选取0~11 ℃中7个温度进行甲烷水合物平衡条件测试实验。
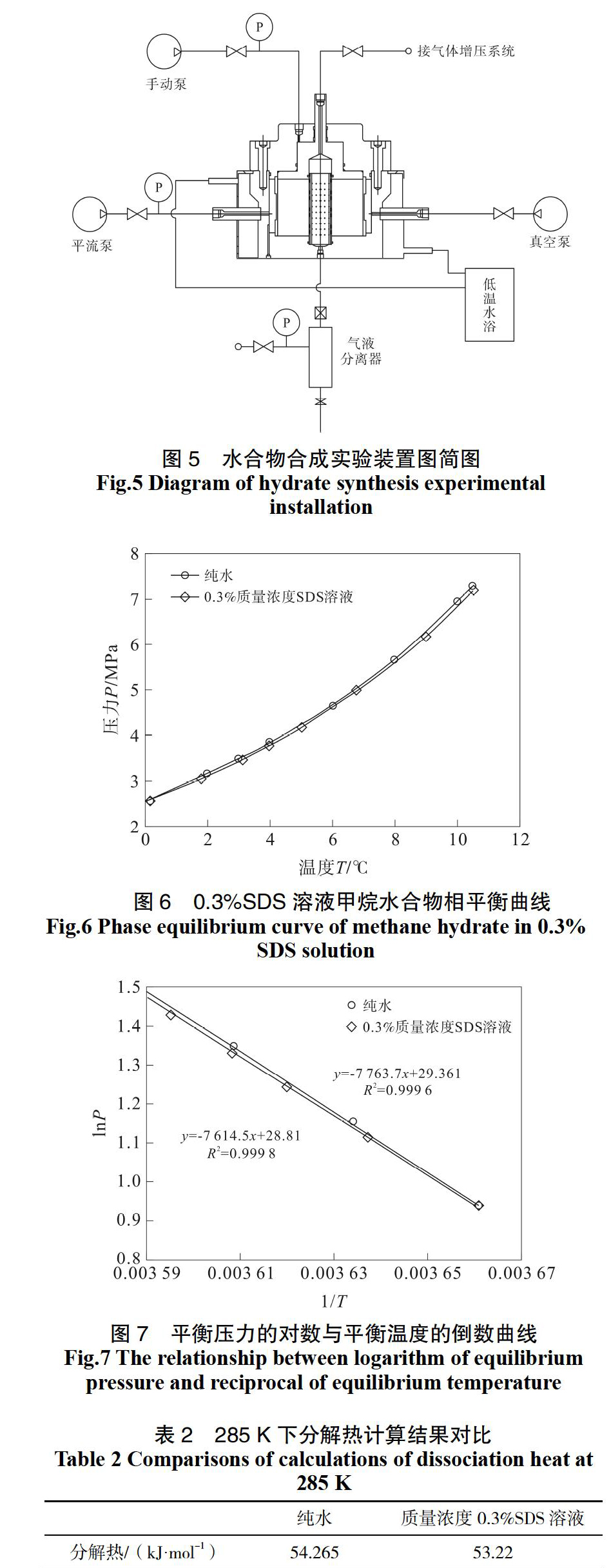
实验仪器采用江苏联友石油仪器有限公司研制的“天然气水合物生成与开采模拟实验装置”,仪器原理图如图5所示。
仪器包括上覆应力加载系统、模拟储层室、恒温控制系统、天然气增压进气进水系统、背压控制系统以及温度压力流量采集系统。反应釜有效容积为1 766 mL,模拟最大承压为40 MPa,恒温控制系统通控温区间为-20~100 ℃,控温精度0.1 ℃。
2.1.2 ?实验结果分析
表2给出了添加质量浓度0.3%SDS溶液条件下的CH4水合物合成实验结果,其拟合关系式为:
实验结果表明,添加质量浓度0.3%SDS溶液条件下NGH相平衡曲线与纯水条件下NGH相平衡曲线相比,趋势大致相同,仅在高压下略有偏差,说明SDS溶液在加快合成速率的同时,对水合物相平衡条件影响不大,如图6所示。
同时,此实验条件下的lnP与1/T关系曲线斜率的绝对值略低于纯水条件下的值,斜率为-7 614.5,如图7所示。
利用改进后Clausius-Clapeyron方程计算水合物分解热可知,添加质量浓度0.3%的SDS溶液条件下合成的CH4水合物分解热为53.22 kJ/mol,与纯水条件下相差1.92%,如表2所示。即可以利用加入SDS促进水合物生成速度和质量,进行水合物开采模拟实验。
3 ?结 论
(1)基于VB编程引入了Setzmann方程,克服了气体状态方程高压下不适用性,可以精确计算不同平衡温度、压力条件下甲烷气体的壓缩因子,从而提高Clausius-Clapeyron方程计算甲烷水合物分解热计算精度。
(2)含SDS溶液条件下合成的甲烷水合物与纯水条件下合成的甲烷水合物分解热误差不足2%,添加SDS溶液合成水合物,可节省大量合成时间,进行注热开采实验得到相关参数和规律可以代表储层中水合物的注热开采规律。
参考文献:
[1]卞小强,韩兵,杜志敏.基于支持向量机的酸性天然气水合物生成条件预测[J].中国科技论文,2016,11(09):1017-1020.
[2]孙可明,王婷婷,翟诚,等.天然气水合物加热分解储层变形破坏规律研究[J]特种油气藏.2017,24(5):91-96.
[3]李文卓.天然气水合物生成与相平衡曲线的试验分析[J].当代化工,2018,47(08):1585-1588.
[4]胡亚飞,蔡晶,徐纯刚,等.气体水合物相变热研究进展[J].化工进展,2016,35(07):2021-2032.
[5]吴欣雨,李锐,刘蓉,等.天然气调压器水合物冻堵的数值模拟分析[J].中国科技论文,2016,11(01):92-95.
[6]Handa Y P. Calorimetric determinations of the compositions, enthalpies of dissociation, and heat capacities in the range 85 to 270 K for clathrate hydrates of xenon and krypton ☆[J]. Journal of Chemical Thermodynamics, 1986, 18(9):891-902.
[7]Rueff, R.M. Heat capacity and heat of dissociation of methane hydrates: a new approach[J]. Aiche Journal, 1985, 34(9):1468-1476.
[8]Lievois J S , Perkins R , Martin R J , et al. Development of an automated, high pressure heat flux calorimeter and its application to measure the heat of dissociation and hydrate numbers of methane hydrate[J]. Fluid Phase Equilibria, 1990, 59(1):73-97.
[9]董福海,樊栓狮,梁德青.混合量热法测定水合物分解热[J].中国科学院研究生院学报,2008(06):732-737.
[10]孙志高,樊栓狮,郭开华,等.天然气水合物分解热的确定[J].分析测试学报,2002(03):7-9.
[11]刘永红,梁得青,郭开华,等.制冷剂气体水合物分解热的确定[J].西安交通大学学报,2003(03):234-236+313.
[12]李栋梁,梁德青,樊栓狮,等.CH_4-TBAB二元水合物的分解热测定[J].工程热物理学报,2008(07):1092-1094.
[13]岳英洁,业渝光,刁少波,等.沉积物中水合物热物理性质测试实验初探[J].海洋地质动态,2007(05):35-37.
[14]Sloan E D.Flefel F. Hydrate dissociation enthalpy and guest size[J].Fluid Phase Equilibria,1992(76):123-140.
[15]李相方,刚涛,庄湘琦,等.高压天然气偏差系数的高精度解析模型[J].石油大学学报:(自然科学版),2001,25(6):45-46+51.
[16]Dickens G R , Mary S. Quinby‐Hunt. Methane hydrate stability in seawater[J]. Geophysical Research Letters, 1994, 21.
[17]Sloan E D , Jr. Clathrate Hydrates of Natural Gases, Second Edition, Revised and Expanded[M]. Crc Press Inc, 1990.
[18]Sloan E D , Jr. Clathrate Hydrates of Natural Gases, Third Edition, Revised and Expanded[M]. Crc Press Inc, 2007.
[19]黄文件,刘道平,周文铸,等.天然气水合物的热物理性质[J].天然气化工,2004(04):66-71.
[20]苏正,陈多福,冯东,等.天然气水合物体系的相平衡及甲烷溶解度计算[J].地球物理学进展,2007(01):239-246.
[21]Dickens G R, Quinby-Hunt M S. Methane hydrate stability in pore water: A simple theoretical approach for geophysical applications[J]. Journal of Geophysical Research Solid Earth, 1997, 102(B1):773-783.
[22] 李鹏飞, 雷新华, 徐浩,等. 天然气水合物相平衡影响因素研究[J]. 天然气化工:c1化学与化工, 2012, 37(6):12-17.
[23] FEKLISTOV V V. Investigation of kinetics of gas hydrate formation by turbidimetry method[D]. Novosibirsk(in Russian):Institute of Inorganic Chemistry,2001.
- 初中英语书面表达写作指导策略
- 初中英语互动教学模式的探讨与实践
- 互动式教学模式在初中英语阅读教学中的实践研究
- 初中英语文本阅读课堂读与写教学研究分析
- 初中英语教学中对词汇教学的研究
- 初中英语词汇学习策略刍议
- 教海无涯用“心”方灵
- 现代信息技术与小学英语教学的融合策略
- 小议积极情感教学在高中英语的运用
- 论在初中英语教学中渗入德育因子
- 关于高中英语写作教学与高考的接轨分析
- 浅谈英语教学中如何培养学生语用能力
- 如何科学地调动中学生英语学习的积极性
- 如何让高中生突破英语学习的瓶颈
- 小组合作学习在初中英语教学中的应用分析
- 多管齐下,开展高中英语课外阅读
- 有效运用语境开展英语词汇教学
- 情感在初中英语教学中的作用浅谈
- 初中英语教学中的素质教育研究
- 如何在初中英语阅读教学中有效地教学词汇
- 浅谈如何转化提高英语学困生学习能力
- 初中英语教学中合作学习的应用探究
- 试论英文电影欣赏在高中英语教学中的催化作用
- 浅谈英语教学中的兴趣培养
- 浅谈初中英语教学中的师生互动
- accordance
- accordances
- accordancy
- accorded
- accorder
- accorders
- according
- accordingly
- according to
- according to the law
- accordion
- accordioned
- accordioning
- accordionist
- accordionists
- accordions
- accordment
- accords
- accord²
- accord¹
- accost
- accostable
- accosted
- accoster
- accosting
- 精神头儿
- 精神奋发
- 精神奕奕
- 精神好,不觉疲劳
- 精神好,心情舒畅
- 精神安形,年寿得长
- 精神安适愉快
- 精神家园
- 精神容态
- 精神导游
- 精神就业
- 精神年货
- 精神很好,气质不凡
- 精神很好,神采奕奕
- 精神快餐
- 精神性的宇宙主体
- 精神恍忽之病
- 精神恍忽心神恍惚
- 精神恍惚
- 精神恍惚不集中
- 精神恍惚,思维错乱:颠倒错乱 颠倒错缪(指理性认识的过程
- 精神恍惚,自相惊扰
- 精神恍惚,魂不附体
- 精神愉快,对事物的发展充满信心
- 精神愉快,气息通泰