系统思维在高三电化学复习中的实践与思考
丁雯
摘要:系统思维是一种重要的解决问题的思维,整体性是其核心思想。作者着眼于阐述系统思维在高三电化学复习课堂中的实践应用,并根据实践过程出现的问题提出了自己的思考。
关键词:系统思维;高三电化学;实践;思考
文章编号:1008-0546(2018)10-0040-03 中图分类号:G633.8 文献标识码:B
高三化学复习的一个鲜明特点就是要帮助学生逐步完善自己的知识结构,形成系统的知识体系,在解决问题的时候能从整体出发,排除无用文字干扰,看到问题的实质,提取有用信息来帮助思考并解决问题。而系统思维可以有效帮助实现这一复习目的。
一、系统思维及其主要观点
系统思维起源于系统论。它是1945年美籍奥地利人、理论生物学家L.Von.Bertalanffy在1945年创立的。系统论中认为,系统思维是把认识对象作为系统来识物想事。它的主要观点有:①从整体上认识和解决问题;②深入内容细致分析问题;③重点解决关键问题;④向下要关注到更小的系统;向上要看到更大的系统;⑤跳出系统看系统。系统思维的核心思想就是整体性。
二、电化学内容的教材分析
高中化学电化学部分内容出现不止一次,第一次出现在高一必修2的第二专题——化学反应与能量转化,初步给出原电池和电解池的概念,对学生的要求是从宏观能量转化的角度理解化学能和电能之间的转化,通过对原电池和电解实验现象的观察,认识生产生活中一些有关电化学的应用实例。此处并不要求学生认识原电池及电解池的原理,只要求学生知道原电池和电解池的反应实质上是氧化还原反应,对电极反应方程式的书写要求并不高,更不涉及原电池电解池的设计。第二次出现在选修4化学反应原理中,这一次的呈现和第一次相比,编者特别注意在必修2的基础上进行深化和提高,如盐桥装置的出现可以帮助原电池提高效率,燃料电池原理的剖析,电解原理的应用示例都配上示意图帮助学生理解,并且各种情况的电极反应方程式也不断出现。高二选修部分的能力重点在于学生在理解原电池和电解池原理的基础上,能写出相应的电极反应式,并能根据有关原理去设计原电池和电解池。在最近几年的高考中,电化学都是以新的信息包装成陌生新颖的原电池和电解池呈现出来,学生只有在理解电化学能量转化的基础上,根据原电池或者电解池的反应原理,才能正确分析出两极的电极反应,并结合化学方程式的书写规则正确写出电极反应式和总反应式来解决问题。
三、学生学情分析
在高三电化学复习之时,学生已经复习过氧化还原反应以及元素化合物知识,对于陌生物质的化学方程式的书写也有了基础。一部分之前电化学掌握不理想的同学会混淆原电池和电解池的电极反应,对电化学中的得失电子的方向,离子的流向不会判断,对考题中出现的陌生电化学装置难以找到分析的突破口。
四、教学思路分析
笔者认为在高三一轮复习中电化学内容可以分成三步:
第一步,从系统思维的角度帮助学生找出电化学和氧化还原反应之间的联系,从“电路中电荷移动形成回路”的这一学生熟悉的物理知识人手,帮助学生先明确原电池和电解池上的电极得失电子的方向,有助于学生更好地从总体上去把握问题的本质,这是电化学知识体系建构中最关键的一步。
第二步,在掌握各电极电子得失方向和离子流向的基础上,根据之前复习的氧化还原反应和离子方程式书写的规则,将电子得失方向用化学用语——电极反应式正确地表达出来,这也是近几年高考中第20题的常考形式。
第三步,从化学学科核心素养上来说,化学学科还要追求科学态度和社会责任,将理论联系实际,用学到的化学知识去解决生活中遇见的问题,帮助学生养成用节约资源、保护环境的可持续发展意识和思想去解决能源问题,认识开发新的电源。
下面就以第一步为例,谈谈系统思维在高三电化学复习中的应用。
五、系统思维在电化学复习中的应用实例
1.从整体上认识和解决问题
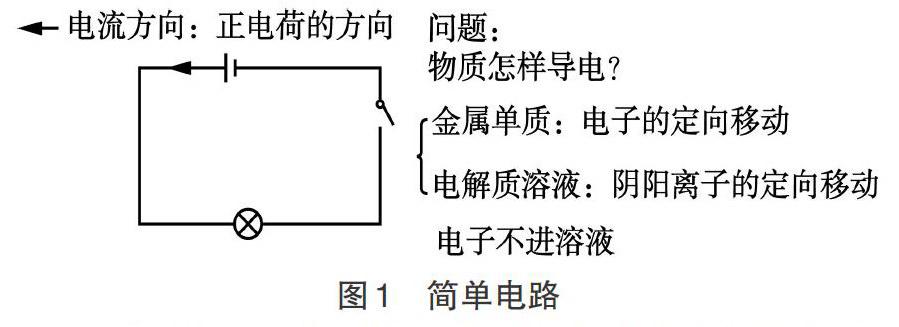
【例1】教师以最简单的物理电路图(如图1)入手,从物质导电性入手,分析金属导电的原因是电子的定向移动,电解质溶液和熔融电解质是靠阴阳离子的定向移动.明确电子不能进入浓液。
本课引入时,将电化学中的原电池和电解池的内容看作一个系统,但是,如果将学生的已有知识看作一个更大的系统,我们可以跳出这个电化学的子系统,用学生已经掌握的其他子系统知识比如物理上的电化学基础知识作为引入。对学生来说,死记硬背一个新的知识点总是不如从已经掌握的知识作为新课的引入来得更方便和有效,这也符合认知规律。此处的提问一方面帮助学生扫清带电微粒的移动这一容易混淆的概念障碍,另一方面就是为了让学生从已知的知识进入新知识,使复习更加有效。从整体上来看,电化学中的原电池和电解池也就是电路中的电源和用电器,一个是提供能量,即化学能转化为电能,一个是利用电能,即电能转化为化学能。这样一种思维方式,不仅有利于學生从整体上来看电化学知识,有效突破学习难点,而且能更好地理解物理和化学等科学知识的整体性。
2.深入内部细致分析问题
【例2】教师提问1:根据原电池的定义,原电池相当于上述电路图中的哪个电子元件?比如可以以电池Cu-Zn/H2SO4(aq)为例来分析。
学生回答:原电池是直流电源。
教师提问2:根据电流方向及与之相反的负电荷的方向写出Cu-Zn/H2SO4(aq)电池两极的电极反应式。
学生练习。
学生总结:根据负电荷的回路情况,电子是从电源的负极出来,经过外电路,回到电源正极,电源内电路中,阴离子是从正极移向负极,这样负电荷可以构成一个回路。
此处以具体的Cu-Zn/H2SO4(aq)原电池为模型,帮助学生理清楚原电池电路中的电子得失方向和离子移动方向,即电荷的移动情况。有些学生靠死记硬背的方法,只能记住少数电池的电子转移情况,下次换个形式出现就又会混淆了,用这个原电池不回避学生靠低效的学习方法记住的内容,而是换一个角度来解读他们记下的内容,帮助学生理解结论,同时细致深入地分析透彻这一原电池,那么接下来更复杂的电池情况,学生迁移起来将会更加顺利。
3.重点解决关键问题
【例3】教师提问3:根据电路形成通路看看电源要能输出电能需要满足什么条件?
学生回答:1.自发的氧化还原反应(要有电子的得失)
2.两电极的活泼性要不同(要能形成电势差)
3.要形成闭合回路
应用延伸:同样的电池装置,电极材料的不同和电解质溶液的不同,电极反应就会不同,甚至正负极都会改变。
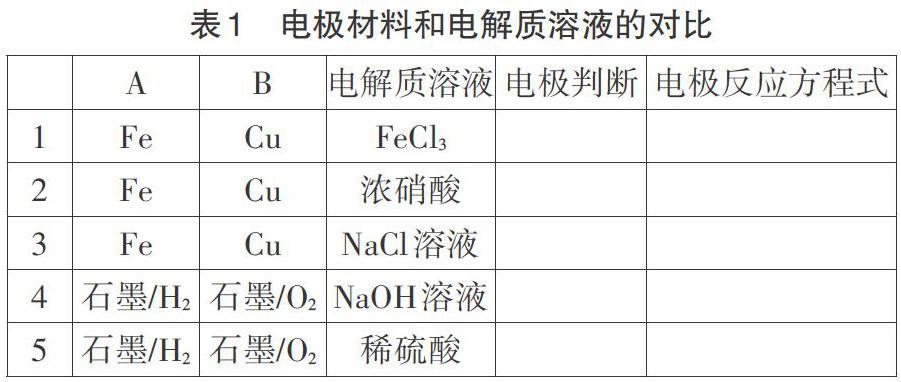
在高考试卷中,电化学部分的内容通常是披着科技信息的外衣,需要学生读懂题干所给信息去判断正负极,写出正确的电极反应方程式。表1中一系列电极材料和电解质溶液的对比有助于学生从本质上理解,负极发生的是失电子反应,流出电子到外电路,正极是得电子的反应,学生也就能理解同样是铜和铁作两极,电解质溶液不一样,正负极都有可能不一样,因为不一样的氧化还原反应,失电子的一方有可能发生改变。在之前复习氧化还原反应中,学生已经知道氧化性(或还原性)强的物质优先得电子(或失电子)。在电极反应方程式的练习过程中,需要加深对环境影响产物这一思想的渗透,根据题中所给信息判断反应环境,进而判断反应产物,这一点和高考热点题型——陌生化学方程式的书写中的书写原则是一致的。
4.向下要关注到更小的系统
如果说整体电化学概念的构建是一个系统,那么具体的考题呈现方式和得分点就是更小的系统。作为教师不仅要帮助学生构建整体的知识框架,更要帮助学生知道这部分知识考什么,怎么考,知道考题的方向,在考试中拿分也就不是什么难事了。例3的教学情境不仅可以帮助学生辨析清楚原电池中的概念,关于电极反应式的正确书写就是常见的考题形式,对这一题型的训练和纠错就是关注到更细微的系统,让学生不仅能看懂题,更能拿到分。
5.向上要看到更大的系统
电化学说到底是得失电子的反应,这就可以联系氧化还原反应的概念来复习,比如燃料电池的正负极判断,氧气做氧化剂,通常是正极,再比如电解池溶液中离子放电顺序就和氧化性还原性强弱有关。
6.跳出系统看系统
一般来讲,电化学复习是先讲原电池,包括高二选修中涉及到的盐桥,然后是化学电源,也就是巩固电极反应方程式的书写以及设计电池,将原电池和电化学的内容全部结束后再讲电解池,也就是将原电池和电解池作为两个独立知识单元来看。而本节课,在学生复习完电极反应方程式后直接进入电解池的基本装置。这一设计就是将原电池和电解池看作一个系统,它们是化学能和电能转化的两个方向,它们作为电路中的电源和用电器,实现了化学能和电能的相互转化。系统思维的核心思想就是整体性,我们在找规律时需要将对象按照某一规则划分成一个特定的整体。那么原电池和电解池它们因为共同完成了化学能和电能之间的相互转化,将它们看作整体电路的一部分。然后在这一整体电路中根据它们的特点再将整体中的部分用对比和联系的方法加以整合从而帮助学生从整体上用系统思维的观点去重新构建知识。
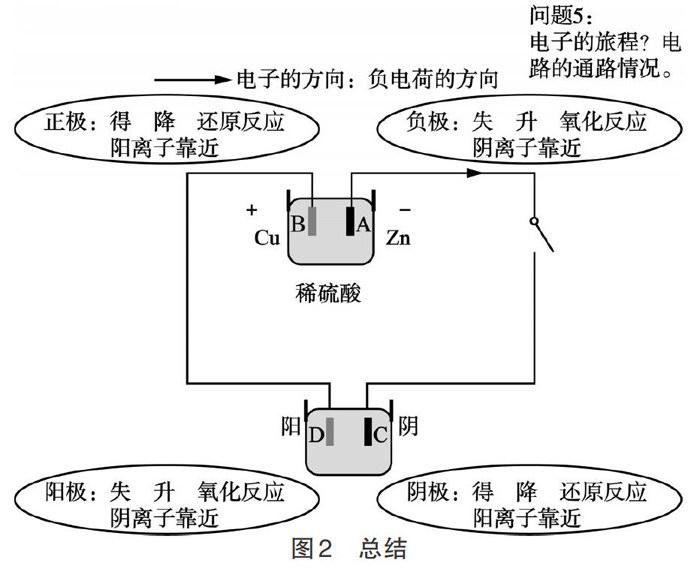
本节课的复习,虽然外观相似,但是原电池是提供电能的电源,电解池是消耗电能的用电器。电子从电源的负极出发,来到电解池的阴极,电解池溶液中的阳离子靠近阴极得电子,阴离子靠近阳极失电子,失去的电子通过导线回到电源的正极,在原电池内部,阴离子会从正极移向负极,这样负电荷就可以形成一个闭合回路,各电极上电子得失方向不容易混淆,溶液中阴离子的移动方向也容易记住,阳离子的移动方向恰好相反。分析清楚原电池和电解池中各电极的反应,在最后在一张图(如图2)中,既有原电池又有电解池,按照电子的流向加以总结,这样对电化学中最核心的问题,也就是各电极得失电子的反应、离子的流向、能量的转化、氧化还原反应的辨析,都能比较牢固地掌握。
本节课最后,结合高考电化学中的常见题型,明确接下来要解决的问题:①电子流向的化学表述即电化学中电极反应方程式的书写;②得失电子顺序,明确电化学复习后阶段的方向。这就是对系统的向下延伸。
五、对系统思维在高三化学复习中应用实践的思考
高中化学学习的一个重要目的是为了应对高考,这就要求在复习中不能以低级的刷题、解题、固定格式为追求,而是要帮助学生学会思维方法、提高思维能力,将知识统整与内化,从而更加有效地提高复习效率,提升化学学科素养。
以电化学为例,因为原电池和电解池都是在两个电极将氧化还原反应拆成两个半反应,所以可以将它们看作一个整体,两者共同实现了化学能和电能的相互转化,这就体现了系统思维从整体上认识和解决问题的思想。当宏观基本概念框架搭好后,再深入内部细致分析问题就显得顺理成章并容易得多了。从电路中电子的流向为线索,明确原电池是直流电源,负极流出电子,正极流人电子,电解池是用电器,阴极连到电源负极,所以接收电子,也就是得電子,阳极要把电子给出,通过导线流人电源正极,也就是失电子,这就体现了本文开头的系统思维的两个主要观点,即深入内部细致分析问题和重点解决关键问题。那么向下关注到更小的系统,就是本节课最后提到的间题,电极反应方程式的书写和电子得失顺序,联系之前氧化还原的内容来看,又体现了向上看到更大的系统。
所以,当我们帮助学生从系统思维的角度来思考问题时,就抓住了最核心的问题,即培养学生的学习能力,帮助学生提高学科素养、优化思维方式、提升价值观念。
参考文献
[1]苗东升.论系统思维(一):把对象作为系统来识物想事[J].系统辩证学报,2004(7):7
[2]苗东升.论系统思维(二):从整体上认识和解决问题[J].系统辩证学报,2004(10):1
[3]苗东升.论系统思维(三):整体思维与分析思维相结合[J].系统辩证学报,2005(1):7
[4]苗东升.论系统思维(四):深入内部精细的考察系统[J].系统辩证学报,2005(4):1
[5]苗东升.论系统思维(五):跳出系统看系统[J].系统辩证学报,2005(7):1
[6]谷莹莹,吴永才.系统思维在高三化学复习教学中的应用研究[J].北学教学,2014(8):34-38



摘要:系统思维是一种重要的解决问题的思维,整体性是其核心思想。作者着眼于阐述系统思维在高三电化学复习课堂中的实践应用,并根据实践过程出现的问题提出了自己的思考。
关键词:系统思维;高三电化学;实践;思考
文章编号:1008-0546(2018)10-0040-03 中图分类号:G633.8 文献标识码:B
高三化学复习的一个鲜明特点就是要帮助学生逐步完善自己的知识结构,形成系统的知识体系,在解决问题的时候能从整体出发,排除无用文字干扰,看到问题的实质,提取有用信息来帮助思考并解决问题。而系统思维可以有效帮助实现这一复习目的。
一、系统思维及其主要观点
系统思维起源于系统论。它是1945年美籍奥地利人、理论生物学家L.Von.Bertalanffy在1945年创立的。系统论中认为,系统思维是把认识对象作为系统来识物想事。它的主要观点有:①从整体上认识和解决问题;②深入内容细致分析问题;③重点解决关键问题;④向下要关注到更小的系统;向上要看到更大的系统;⑤跳出系统看系统。系统思维的核心思想就是整体性。
二、电化学内容的教材分析
高中化学电化学部分内容出现不止一次,第一次出现在高一必修2的第二专题——化学反应与能量转化,初步给出原电池和电解池的概念,对学生的要求是从宏观能量转化的角度理解化学能和电能之间的转化,通过对原电池和电解实验现象的观察,认识生产生活中一些有关电化学的应用实例。此处并不要求学生认识原电池及电解池的原理,只要求学生知道原电池和电解池的反应实质上是氧化还原反应,对电极反应方程式的书写要求并不高,更不涉及原电池电解池的设计。第二次出现在选修4化学反应原理中,这一次的呈现和第一次相比,编者特别注意在必修2的基础上进行深化和提高,如盐桥装置的出现可以帮助原电池提高效率,燃料电池原理的剖析,电解原理的应用示例都配上示意图帮助学生理解,并且各种情况的电极反应方程式也不断出现。高二选修部分的能力重点在于学生在理解原电池和电解池原理的基础上,能写出相应的电极反应式,并能根据有关原理去设计原电池和电解池。在最近几年的高考中,电化学都是以新的信息包装成陌生新颖的原电池和电解池呈现出来,学生只有在理解电化学能量转化的基础上,根据原电池或者电解池的反应原理,才能正确分析出两极的电极反应,并结合化学方程式的书写规则正确写出电极反应式和总反应式来解决问题。
三、学生学情分析
在高三电化学复习之时,学生已经复习过氧化还原反应以及元素化合物知识,对于陌生物质的化学方程式的书写也有了基础。一部分之前电化学掌握不理想的同学会混淆原电池和电解池的电极反应,对电化学中的得失电子的方向,离子的流向不会判断,对考题中出现的陌生电化学装置难以找到分析的突破口。
四、教学思路分析
笔者认为在高三一轮复习中电化学内容可以分成三步:
第一步,从系统思维的角度帮助学生找出电化学和氧化还原反应之间的联系,从“电路中电荷移动形成回路”的这一学生熟悉的物理知识人手,帮助学生先明确原电池和电解池上的电极得失电子的方向,有助于学生更好地从总体上去把握问题的本质,这是电化学知识体系建构中最关键的一步。
第二步,在掌握各电极电子得失方向和离子流向的基础上,根据之前复习的氧化还原反应和离子方程式书写的规则,将电子得失方向用化学用语——电极反应式正确地表达出来,这也是近几年高考中第20题的常考形式。
第三步,从化学学科核心素养上来说,化学学科还要追求科学态度和社会责任,将理论联系实际,用学到的化学知识去解决生活中遇见的问题,帮助学生养成用节约资源、保护环境的可持续发展意识和思想去解决能源问题,认识开发新的电源。
下面就以第一步为例,谈谈系统思维在高三电化学复习中的应用。
五、系统思维在电化学复习中的应用实例
1.从整体上认识和解决问题
【例1】教师以最简单的物理电路图(如图1)入手,从物质导电性入手,分析金属导电的原因是电子的定向移动,电解质溶液和熔融电解质是靠阴阳离子的定向移动.明确电子不能进入浓液。
本课引入时,将电化学中的原电池和电解池的内容看作一个系统,但是,如果将学生的已有知识看作一个更大的系统,我们可以跳出这个电化学的子系统,用学生已经掌握的其他子系统知识比如物理上的电化学基础知识作为引入。对学生来说,死记硬背一个新的知识点总是不如从已经掌握的知识作为新课的引入来得更方便和有效,这也符合认知规律。此处的提问一方面帮助学生扫清带电微粒的移动这一容易混淆的概念障碍,另一方面就是为了让学生从已知的知识进入新知识,使复习更加有效。从整体上来看,电化学中的原电池和电解池也就是电路中的电源和用电器,一个是提供能量,即化学能转化为电能,一个是利用电能,即电能转化为化学能。这样一种思维方式,不仅有利于學生从整体上来看电化学知识,有效突破学习难点,而且能更好地理解物理和化学等科学知识的整体性。
2.深入内部细致分析问题
【例2】教师提问1:根据原电池的定义,原电池相当于上述电路图中的哪个电子元件?比如可以以电池Cu-Zn/H2SO4(aq)为例来分析。
学生回答:原电池是直流电源。
教师提问2:根据电流方向及与之相反的负电荷的方向写出Cu-Zn/H2SO4(aq)电池两极的电极反应式。
学生练习。
学生总结:根据负电荷的回路情况,电子是从电源的负极出来,经过外电路,回到电源正极,电源内电路中,阴离子是从正极移向负极,这样负电荷可以构成一个回路。
此处以具体的Cu-Zn/H2SO4(aq)原电池为模型,帮助学生理清楚原电池电路中的电子得失方向和离子移动方向,即电荷的移动情况。有些学生靠死记硬背的方法,只能记住少数电池的电子转移情况,下次换个形式出现就又会混淆了,用这个原电池不回避学生靠低效的学习方法记住的内容,而是换一个角度来解读他们记下的内容,帮助学生理解结论,同时细致深入地分析透彻这一原电池,那么接下来更复杂的电池情况,学生迁移起来将会更加顺利。
3.重点解决关键问题
【例3】教师提问3:根据电路形成通路看看电源要能输出电能需要满足什么条件?
学生回答:1.自发的氧化还原反应(要有电子的得失)
2.两电极的活泼性要不同(要能形成电势差)
3.要形成闭合回路
应用延伸:同样的电池装置,电极材料的不同和电解质溶液的不同,电极反应就会不同,甚至正负极都会改变。
在高考试卷中,电化学部分的内容通常是披着科技信息的外衣,需要学生读懂题干所给信息去判断正负极,写出正确的电极反应方程式。表1中一系列电极材料和电解质溶液的对比有助于学生从本质上理解,负极发生的是失电子反应,流出电子到外电路,正极是得电子的反应,学生也就能理解同样是铜和铁作两极,电解质溶液不一样,正负极都有可能不一样,因为不一样的氧化还原反应,失电子的一方有可能发生改变。在之前复习氧化还原反应中,学生已经知道氧化性(或还原性)强的物质优先得电子(或失电子)。在电极反应方程式的练习过程中,需要加深对环境影响产物这一思想的渗透,根据题中所给信息判断反应环境,进而判断反应产物,这一点和高考热点题型——陌生化学方程式的书写中的书写原则是一致的。
4.向下要关注到更小的系统
如果说整体电化学概念的构建是一个系统,那么具体的考题呈现方式和得分点就是更小的系统。作为教师不仅要帮助学生构建整体的知识框架,更要帮助学生知道这部分知识考什么,怎么考,知道考题的方向,在考试中拿分也就不是什么难事了。例3的教学情境不仅可以帮助学生辨析清楚原电池中的概念,关于电极反应式的正确书写就是常见的考题形式,对这一题型的训练和纠错就是关注到更细微的系统,让学生不仅能看懂题,更能拿到分。
5.向上要看到更大的系统
电化学说到底是得失电子的反应,这就可以联系氧化还原反应的概念来复习,比如燃料电池的正负极判断,氧气做氧化剂,通常是正极,再比如电解池溶液中离子放电顺序就和氧化性还原性强弱有关。
6.跳出系统看系统
一般来讲,电化学复习是先讲原电池,包括高二选修中涉及到的盐桥,然后是化学电源,也就是巩固电极反应方程式的书写以及设计电池,将原电池和电化学的内容全部结束后再讲电解池,也就是将原电池和电解池作为两个独立知识单元来看。而本节课,在学生复习完电极反应方程式后直接进入电解池的基本装置。这一设计就是将原电池和电解池看作一个系统,它们是化学能和电能转化的两个方向,它们作为电路中的电源和用电器,实现了化学能和电能的相互转化。系统思维的核心思想就是整体性,我们在找规律时需要将对象按照某一规则划分成一个特定的整体。那么原电池和电解池它们因为共同完成了化学能和电能之间的相互转化,将它们看作整体电路的一部分。然后在这一整体电路中根据它们的特点再将整体中的部分用对比和联系的方法加以整合从而帮助学生从整体上用系统思维的观点去重新构建知识。
本节课的复习,虽然外观相似,但是原电池是提供电能的电源,电解池是消耗电能的用电器。电子从电源的负极出发,来到电解池的阴极,电解池溶液中的阳离子靠近阴极得电子,阴离子靠近阳极失电子,失去的电子通过导线回到电源的正极,在原电池内部,阴离子会从正极移向负极,这样负电荷就可以形成一个闭合回路,各电极上电子得失方向不容易混淆,溶液中阴离子的移动方向也容易记住,阳离子的移动方向恰好相反。分析清楚原电池和电解池中各电极的反应,在最后在一张图(如图2)中,既有原电池又有电解池,按照电子的流向加以总结,这样对电化学中最核心的问题,也就是各电极得失电子的反应、离子的流向、能量的转化、氧化还原反应的辨析,都能比较牢固地掌握。
本节课最后,结合高考电化学中的常见题型,明确接下来要解决的问题:①电子流向的化学表述即电化学中电极反应方程式的书写;②得失电子顺序,明确电化学复习后阶段的方向。这就是对系统的向下延伸。
五、对系统思维在高三化学复习中应用实践的思考
高中化学学习的一个重要目的是为了应对高考,这就要求在复习中不能以低级的刷题、解题、固定格式为追求,而是要帮助学生学会思维方法、提高思维能力,将知识统整与内化,从而更加有效地提高复习效率,提升化学学科素养。
以电化学为例,因为原电池和电解池都是在两个电极将氧化还原反应拆成两个半反应,所以可以将它们看作一个整体,两者共同实现了化学能和电能的相互转化,这就体现了系统思维从整体上认识和解决问题的思想。当宏观基本概念框架搭好后,再深入内部细致分析问题就显得顺理成章并容易得多了。从电路中电子的流向为线索,明确原电池是直流电源,负极流出电子,正极流人电子,电解池是用电器,阴极连到电源负极,所以接收电子,也就是得電子,阳极要把电子给出,通过导线流人电源正极,也就是失电子,这就体现了本文开头的系统思维的两个主要观点,即深入内部细致分析问题和重点解决关键问题。那么向下关注到更小的系统,就是本节课最后提到的间题,电极反应方程式的书写和电子得失顺序,联系之前氧化还原的内容来看,又体现了向上看到更大的系统。
所以,当我们帮助学生从系统思维的角度来思考问题时,就抓住了最核心的问题,即培养学生的学习能力,帮助学生提高学科素养、优化思维方式、提升价值观念。
参考文献
[1]苗东升.论系统思维(一):把对象作为系统来识物想事[J].系统辩证学报,2004(7):7
[2]苗东升.论系统思维(二):从整体上认识和解决问题[J].系统辩证学报,2004(10):1
[3]苗东升.论系统思维(三):整体思维与分析思维相结合[J].系统辩证学报,2005(1):7
[4]苗东升.论系统思维(四):深入内部精细的考察系统[J].系统辩证学报,2005(4):1
[5]苗东升.论系统思维(五):跳出系统看系统[J].系统辩证学报,2005(7):1
[6]谷莹莹,吴永才.系统思维在高三化学复习教学中的应用研究[J].北学教学,2014(8):34-38

