李东娴 杜春华 张晓南 袁凡婷 王鹏 游燕

摘要:目的对盐酸小檗碱片的微生物限度检查进行了方法适用性研究。方法按《中国药典》2015 年版通则1105,通则1106,通则1107。结果盐酸小檗碱片应使用薄膜过滤法进行微生物限度检查,而薄膜过滤法冲洗液中加入聚山梨酯-80作为助溶剂,提高冲洗液温度(不超过45℃)等方法均可以对回收率的提高有一定作用,最终实验采用1:100稀释液薄膜过滤法对样品进行检测,回收率可达到药典要求。结论该方法可以用于盐酸小檗碱片的微生物限度检查。
关键词:盐酸小檗碱片 微生物限度 方法适应性
中图分类号:R286.0文献标志码:B文章编号:1007-2349(2019)10-0072-03
鹽酸小檗碱片的主要成分为盐酸小檗碱,这是从黄连等植物中提取的一种异喹啉类生物碱,临床上主要用于清热解毒、治疗肠道感染,近年发现还有治疗心律失常、高血压、高血脂、糖尿病和抗肿瘤等作用[1]。
盐酸小檗碱属于小檗碱类物质,小檗碱自1969年Amin等首次发现体外抑菌作用以来[2],又在之后的实验中被报道具有光谱的抗菌活性,对金黄色葡萄球菌,耐甲氧西林金黄色葡萄球菌,肺炎链球菌,大肠杆菌等都表现出一定的抑菌作用[3-7]。
由于该药品具有抗菌作用,所以很容易影响微生物检测的结果,应按药典要求对其进行微生物限度检查方法适用性验证。
1试验材料
1.1样品盐酸小檗碱(云南省药物研究所生产,共三批,XBJ201701,XBJ201702,XBJ201703)。
1.2稀释剂及培养基pH7.0氯化钠-蛋白胨缓冲液、胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基、麦康凯液体培养基、麦康凯琼脂培养基聚山梨酯-80,除聚山梨酯-80由国药集团提供外,其余均由北京三药提供。
1.3菌种金黄色葡萄球菌〔CMCC(B)26 003 第III代〕、大肠埃希菌〔CMCC(B)44 102 第IV代〕、枯草芽孢杆菌〔CMCC(B)63 501 第III代〕、铜绿假单胞菌〔CMCC(B)10 104 第III代〕和白色念珠菌〔CMCC(F)10 123 第III代〕均由云南省食品药品检验所提供,黑曲霉[CMCC(B)98 003 第III代],由中国药品生物制品检定所提供。
2试验方法
参照《中国药典》2015年版第四部非无菌产品微生物限度检查(1105、1106)实验,简述如下:
2.1菌液制备接种金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、沙门菌的新鲜培养物至胰酪大豆胨液体培养基,30 ℃~35 ℃培养18~24 h。接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基,20 ℃~25 ℃培养2~3 d。取接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂培养基,20 ℃~25 ℃培养5~7 d。取金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、沙门菌、白色念珠菌的新鲜培养物用0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。取黑曲霉的新鲜培养物,加入3~5 mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,之后用含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液将孢子悬液稀释成适宜浓度的黑曲霉孢子悬液。
2.2方法摸索与优化
2.2.1平皿法与培养基稀释法(1)供试品制备:取供试品20 g,加pH7.0无菌氯化钠-蛋白胨缓冲液200 mL,制成1:10的供试液,并依次稀释为1:100,1:500,1:1000的供试液。(2)试验组:取1:10,1:100,1:500,1:1000供试液9.9 mL于灭菌试管中,加入制备好的金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉菌液0.1 mL,使其终浓度为每1 mL含菌落数不大于100cfu的菌液,从试管中吸取1mL注入灭菌平皿中,立刻倾注胰酪大豆胨琼脂培养基,摇匀,待凝后倒置于35 ℃恒温培养基中培养2 d。(3)供试品对照组:以缓冲液代替菌液,同试验组操作。(4)菌液对照组:以缓冲液代替供试液,同试验组操作。见表1。
2.2.2薄膜过滤法(1)供试品制备:取供试品10 g,加冲洗液100 mL,制成1:10的供试液,并稀释为1:100供试液。(2)试验组:取供试液加入400 mL冲洗液中,通过两张滤膜,每张滤膜用冲洗液冲洗,最后一次向冲洗液中加入金黄色葡萄球菌菌液,使每最后一瓶冲洗液中含菌量不大于100cfu。滤干后取下滤膜,过滤面朝上贴于胰酪大豆胨琼脂培养基平板上,倒置,在30~35℃培养2 d,以算术均值作为计数结果。具体试验方案见表1(3)供试品对照组:以缓冲液代替菌液,同试验组操作。(4)菌液对照组:以缓冲液代替供试液,同试验组操作。
2.2.3大肠埃希菌检测方法(1)试验组:取1:10的供试液10 mL及不大于100 cfu/mL大肠埃希菌菌液各1 mL,分别加入100 mL和200 mL胰酪大豆胨液体培养基中,混匀,置35℃培养24 h。取上述培养物1 mL接种至100 mL麦康凯液体培养基中,42℃培养24 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,35℃培养18 h。纯化培养若麦康凯琼脂培养基平板上有菌落生长,用接种针轻轻接触单个疑似菌落的表面中心,沾取培养物,应挑选数个疑似菌落,分别接种胰酪大豆胨琼脂斜面,培养18 h,作鉴定试验。(3)供试品对照组:以缓冲液代替菌液,同试验组操作。(4)菌液对照组:以缓冲液代替供试液,同试验组操作。
2.3方法验证参考2.2.2中对敏感菌金黄色葡萄球菌的回收率实验结果,需氧菌总数按以下条件进行方法适应性验证:取制备好的1:100供试液2 mL,加入冲洗液400 mL中,平行通过两张滤膜,每张滤膜用冲洗液400 mL冲洗(分4次,100 mL/次),最后一次向冲洗液中加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌,黑曲霉孢子悬液,使每最后一瓶冲洗液中含菌量不大于100cfu。滤干后取下滤膜,过滤面朝上贴于胰酪大豆胨琼脂培养基平板上,倒置,在30~35℃培养2 d,以算术均值作为计数结果。霉菌和酵母菌总数按以下条件验证:取上述制备好的1:100供试液2 mL,加入冲洗液400 mL中,平行通过两张滤膜,每张滤膜用冲洗液300 mL冲洗(分3次,100 mL/次),最后一次向冲洗液中加入白色念珠菌菌悬液、黑曲霉孢子悬液,使每最后一瓶冲洗液中含菌量不大于100cfu。滤干后取下滤膜,过滤面朝上贴于胰酪大豆胨琼脂培养基平板上,倒置,在20 ℃~25 ℃培养2 d,以算术均值作为计数结果。大肠埃希菌以常规法进行验证。
3实验结果
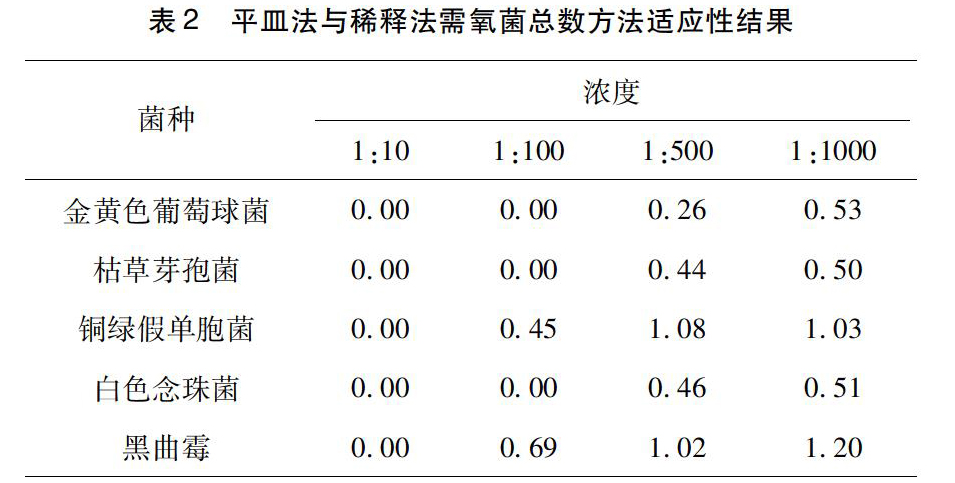
3.1平皿法与稀释法结果见表2。
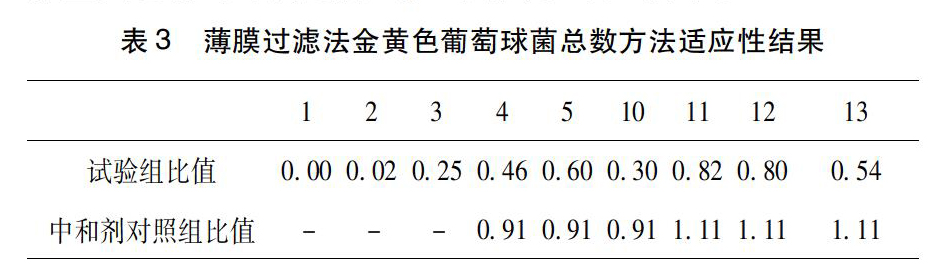
3.2薄膜过滤法结果用薄膜过滤法以不同条件对敏感菌株金黄色葡萄球菌进行试验的结果如表3所示。
3.3大肠埃希菌100 mL与20 0mL TSB的实验结果一致,试验组与菌液对照组为阳性,供试品对照组与阴性对照组为阴性,均可用于大肠埃希菌的检测。
3.4方法适用性验证结果见表4。
采用100mL对大肠埃希菌进行验证,试验组与菌液对照组为阳性,供试品对照组与阴性对照组为阴性。
4讨论
本实验在用薄膜过滤法进行试验时,以敏感菌金黄色葡萄球菌摸索了很多条件,结果发现在冲洗液中加入适量的吐温80可以提高敏感菌株的回收率,但吐温80的含量的增加并不能显著提高回收率,故推测适量的吐温80对盐酸小檗有一定助溶作用。同时,药典中有关于温度增加能够提高盐酸小檗碱的溶解度的描述[8],文献中也有相关报道[9],以此为依据设计了同样冲洗量不同温度的试验组,发现水浴到40℃的冲洗液可以明显提高金黄色葡萄球菌的回收率,由于药典对样品前处理的规定为“均匀加热且温度不超过45℃”,故继续加温虽能提高回收率,但不建议采用40℃以上的冲洗液。除此之外,本实验还进行了不同冲洗速度的對比,发现在冲洗的前2次使用较慢冲洗速度也可以提高菌株回收率,但实验时间的增长会加大污染的可能性,所以是否使用这一改进措施,需按具体情况进行分析。
除了对检测方法进行验证外,本实验还确定了消除盐酸小檗碱片抑菌效果的三个关键因素,即冲洗液温度,吐温80的助溶作用和冲洗液通过滤膜的速度,希望能对之后该药品和含盐酸小檗碱药物的微生物限度检查方法开发有一定指导作用。
参考文献:
[1]LiB,Zhu WL,Chen KX,et al.Advances in the study of berberine and its der ivatives[J].Yao Xue Xue Bao,2008,43(8):773-778.
[2]Amin AH,Aubbaiah TV,Abbasi KM.Berberine sulfate:antimicrobial activity,bioassay,and mode of action[J].Can J microbiol,1969,(15):1067-1076.
[3]Freile ML,Giannini F,Pucci G,et al.Anitimicrobial activity of aqueous extracts and of berberine isolated from Berberis heterophylla[J].Fitoterapia,2003,(74):705.
[4]Yu HH,Kim KJ,Cha JD,et al.Antimicrobial activity of ber berine alone and in combination with ampicillin or oxacillin against methicillin-resistant Staphylococcus aureus[J].J Med Food,2005,(8):454-461.
[5]Kang S,Li Z,Yin Z,et al.The antibacterial mechanism of berberine against Actinobacillus pleuropneumoniae[J].Nat Prod Res,2015,(29):2203-2206.
[6]Peng L,Kang S,Yin Z,et al.Antibacterial activity and mechanism of berberine against Staphylococcus agalactiae[J].Int J Clin Exp Pathol,2015,(8):5217-5223.
[7]Liang RM,Yong XL,Duan YQ,et al.Potent in vitro synergism of fusidic acid(FA)and berberine chloride(BBR)against clinical isolates of methicillin-resistant Staphylococcus aures(MRSA)[J].World J Microbiol Biotechnol,2014,(30):2861-2869.
[8]国家药典委员会.中华人民共和国药典[M].2部.北京:中国医药科技出版社,2015.875.
[9]罗小飞,宋丹青,苏显英,等.提高盐酸小檗碱溶解度的研究[J].化学世界.2016,(7):393-395.
- 初中英语教学对学生语言素养培养的要点分析
- 思维导图优化初中英语词汇教学探析
- 注重多样化教学提高体育教学质量
- 基于学科核心素养下高中生物教学的科学构建
- 小学数学益智课堂教学中导入方法的探究
- 小学数学教学中培养学生思维能力的策略
- 小学语文教学中师生互动中的话语沟通技巧探讨
- 浅谈小学数学教学中如何提高学生解决问题的能力
- 巧用微课优化初中物理教学
- 基于在高中历史教学中培养学生批判性思维的策略分析
- 理性认识——关于思维训练在新课程高中语文教学中的思考
- 高中数学学习困难的成因与对策
- 刍议语篇情境在初中英语词汇教学中的应用
- 新课标下的高中英语教学研究
- 情景教学法在初中英语教学中的应用
- 探究新课改下小学数学教学方法的创新
- 快乐教学法在初中八年级数学的应用研究
- 初中物理课堂教学的导入策略研究
- 高中物理课堂教学多元策略的研究
- 例谈高中数学核心素养中数学抽象能力的培养
- 提高农村高中艺术生实际问题数学化能力的探究
- 初中数学“任务型”阅读教学中深层次阅读探究
- 基于数感培养的小学数学教学策略
- 高中美术欣赏课中学生审美能力的培养策略
- 浅析小学语文课堂上进行教学互动的方法
- storages
- store
- storeandforward
- store-and-forward
- store audit
- storeaudit
- storebrand
- store brand
- store card
- storecard
- stored
- storedetective
- store deˌtective
- storefront
- storehouse
- storehouses
- storekeeper
- storekeepers
- storekeeping
- storekeepings
- store label
- storelabel
- storeman
- storemen
- storeroom
- 动向
- 动吧
- 动听
- 动听的歌声
- 动听的话
- 动听的语言文章
- 动听而使人精神愉快
- 动听而奸伪的言辞
- 动员
- 动员会
- 动品
- 动唇有曲,发口成音
- 动嘴三分利,不挣也够本
- 动嘴大吃
- 动嘴皮子
- 动因
- 动土
- 动在四肢戏在脸
- 动地惊天
- 动外科手术
- 动大手术
- 动天地
- 动天殷地
- 动如参商
- 动如脱兔