
图像题是以图像的形式将一些相关量之间的关系通过形象直观的曲线表示出来,把化学原理抽象为数学问题,旨在考查学生对曲线的数学意义和化学意义之间对应关系的分析、理解和运用能力,是一类难度较大的题型。要解答此类试题,首先要做到“五看”,一看坐标(纵、横坐标的含义)、二看起点(图像的起点)、三看拐点(图像的拐点及终点)、四看比例(看图像中横纵坐标的比例关系)、五看特征(看图像的走向,如上升还是下降)。其次把图像表示的意义与化学知识结合起来,找出与相关知识的具体关系即可。
一、pH变化曲线图像
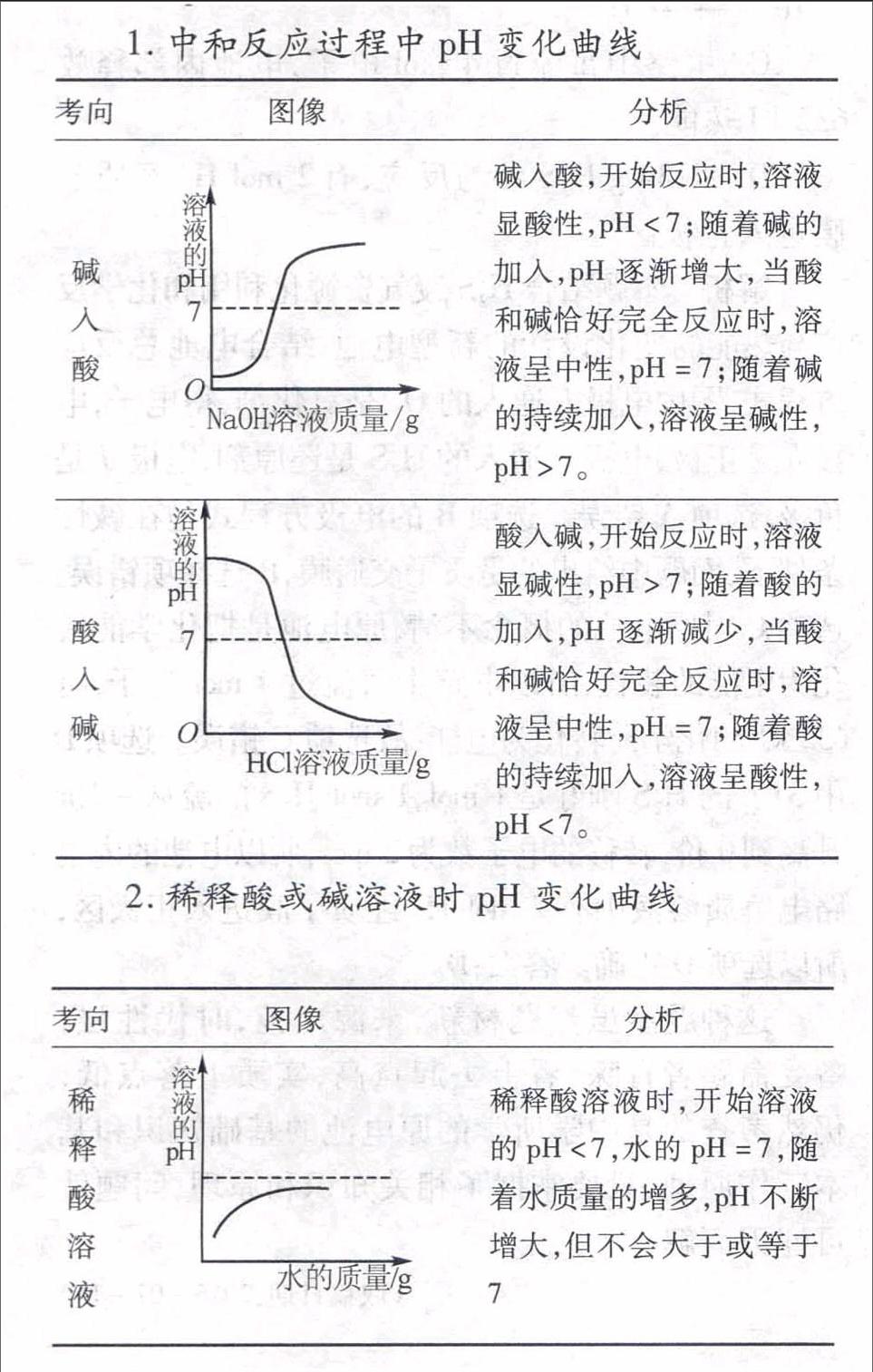
1.中和反应过程中pH变化曲线
考向图像分析
碱入酸碱入酸,开始反应时,溶液显酸性,pH<7;随着碱的加入,pH逐渐增大,当酸和碱恰好完全反应时,溶液呈中性,pH=7;随着碱的持续加入,溶液呈碱性,pH>7。
酸入碱酸入碱,开始反应时,溶液显碱性,pH>7;随着酸的加入,pH逐渐减少,当酸和碱恰好完全反应时,溶液呈中性,pH=7;随着酸的持续加入,溶液呈酸性,pH<7。
2.稀释酸或碱溶液时pH变化曲线
考向图像分析
稀释酸溶液
稀释酸溶液时,开始溶液的pH<7,水的pH=7,随着水质量的增多,pH不断增大,但不会大于或等于7
稀释碱溶液
稀释碱溶液时,开始溶液的pH>7,水的pH=7,随着水质量的增多,pH不断减少,但不会小于或等于7
3.中和反应(以HCl和NaOH为例)的溶质
考向图像溶液的溶质
碱入酸
A点HClB点HCl和NaClC点NaClD点NaOH和NaCl
酸入碱
A点NaOHB点NaOH和NaClC点NaClD点HCl和NaCl
例1(2015年上海)向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是()。
分析A项,氢氧化钠溶液显碱性,盐酸显酸性,因此溶液的pH开始大于7,恰好中和时,溶液的pH等于7,盐酸过量时,溶液的pH小于7;B项,中和反应放热,因此溶液温度开始时升高,而后降低;C项,盐酸与氢氧化钠反应生成氯化钠,因此开始时氯化钠的质量分数变大,当氯化钠的质量不再变化,而溶液的质量还在继续增大,因此氯化钠的质量分数开始减小;D项,开始时,HCl与NaOH反应,因此加入一定体积的盐酸(即将氢氧化钠完全反应)后,溶液的HCl的物质的量才开始增大,但之后只要不断加入盐酸,HCl的物质的量会持续的增大,而不是不变。
答案:D
二、表格和图像结合型
这类问题主要是考查学生识表获取信息的能力,突出数据分析解决实际问题能力的考查,关键是从表中数据和图像里分析、筛选、计算出有价值的数据。这类题以大型计算题为多。
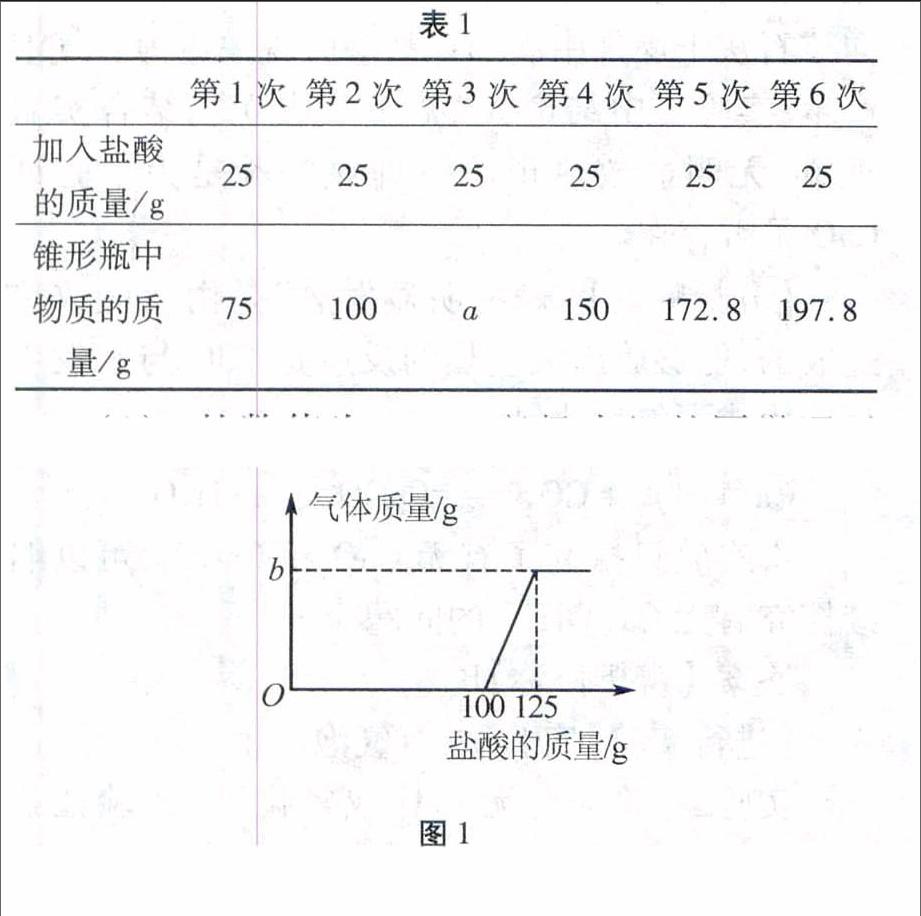
例2(2015年东营)在实验室中,化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂19.8 g放入锥形瓶中,加入30.2 g的水,充分振荡,再向锥形瓶中依次滴加25 g盐酸充分反应。测得部分数据与图像见表1、图1。请根据有关信息回答问题。
表1
第1次第2次第3次第4次第5次第6次
加入盐酸的质量/g252525252525
锥形瓶中物质的质量/g75100a150172.8197.8
(1)a的数值为 ,兴趣小组的同学通过实验,得出该 试剂己部分变质的结论,其依据是(通过实验数据和图像做出你的分析) 。
(2)b的数值 为 。
计算该试剂中氢氧化钙的质量分数(写出计算过程,结果保留一位小数)。
图1
分析根据Ca(OH)2的性质,敞口放置的Ca(OH)2粉末可能会跟空气中的CO2反应而生成CaCO3。本题是通过向一定的待测物质中加入稀盐酸的方法测定其变质的情况。(1)根据优先反应原则:酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应。分析表中数据,加入盐酸前锥形瓶中物质的质量为19.8g+30.2g=50g,前2次和第4次加入盐酸,溶液增加的质量等于加入盐酸的质量,说明此时是盐酸与未变质的Ca(OH)2反应,反应没有气体放出,故a的数值应为100g+25g=125g。当第5次加入25g盐酸时,加入后锥形瓶内物质的质量比总质量减小质量为:25g+150g-172.5g=2.2g,说明有2.2g CO2放出,第6次锥形瓶内物质增加的质量和加入盐酸的质量相等,不再有气体放出,说明此前CaCO3已完全反应。整个过程共放出2.2g CO2,所以图像中b的数值为2.2。
信息梳理
设问该试剂中氢氧化钙的质量分数
需要知道的量①试剂样品的质量;
②试剂样品中氢氧化钙的质量。
已知条件①试剂样品的质量19.8g;
②生成CO2的质量2.2g;
③反应的化学方程式
CaCO3+2HClCaCl2+H2O+CO2↑
分析或计算公式①根据2.2g CO2的质量,利用化学方程式CaCO3+2HClCaCl2+H2O+CO2↑计算出试剂样品中CaCO3的质量:5g;
②试剂样品中Ca(OH)2的质量=19.8g-5g=14.8g;
③试剂样品中Ca(OH)2的质量分数=14.8g19.8g×100%=74.7%
答案:(1) 125滴加盐酸至 100g 时, 开始有 CO2生成,证明有 CaCO3存在;之前滴加盐酸无现象,说明盐酸与 Ca(OH)2 反应,从而证明有Ca(OH)2存在。
(2) 2.2
解设参加反应的 CaCO3的质量为 x
CaCO3+2HClCaCl2+H2O+CO2↑
100 44
x 2.2g
10044=x2.2g
x=5g
故试剂中 Ca(OH)2的质量为:19.8g-5g=14.8g
Ca(OH)2的质量分数为:
14.8g19.8g×100%=74.7%
(收稿日期:2016-08-15)
- 根植语文素养践行语用课堂
- 巧设多种问题,实现深度阅读
- 在多维活动中提升学生的语用品质
- 着眼“四个关注”,把准语言文字运用目标
- 浅析群文阅读的教学价值及实施策略
- 刍议“1+N”群文阅读模式的教学策略
- 单元主题统领下的课堂教学窥探
- 统编教材默读课文的编排特点及教学思考
- 关注学生情感,注重朗读感悟
- 智慧理答,巧妙练就表达能力
- 词语教学要具有“三性”
- “披文以入情”,彰显语文课堂的魅力
- 高年级学生课外阅读能力的培养
- 创造条件,让学生学会学习
- 让低年级学生在生活中学语习文
- 冲突:阅读思辨能力提升的助燃器
- 多元聚合,提升阅读教学有效性
- VR技术下的情境教学浅探
- 第一学段阅读教学中渗透心理教育浅探
- 微课巧运用 古诗深体悟
- 挖掘文本价值,培养学生心理品质
- 说理文知识和能力教学策略浅探
- 立足语文根本,涵泳语言意蕴
- “涵养语文”的三个立意点
- 面对阅读障碍,应智慧等待
- send-up
- send your love
- send your regards
- send you to sleep
- senile
- senilely
- seniles
- senility
- senilize
- senior
- senior citizen
- seniorcitizen
- senior citizens
- senior citizenships
- senior high
- senior high school
- senior high schools
- seniorities
- seniority
- seniors
- senior²
- senior¹
- sensation
- sensational
- sensationalise
- 老太太吃麻花——要的就是这股劲儿
- 老太太吃黄连
- 老太太吃黄连——苦口婆心
- 老太太吃黏糕——闷了口
- 老太太啃鸡脚——横扯筋
- 老太太坐牛车——慢透
- 老太太坐牛车——慢透了
- 老太太坐飞机——抖起来了
- 老太太念经——从头来
- 老太太扎鞋底——千针(真)万针(真)
- 老太太打呵欠——一望无涯(牙)
- 老太太打呵欠——一望无牙
- 老太太打呵欠——一望无牙(涯)
- 老太太找飞机——往远瞧
- 老太太捅烟袋——直来直去
- 老太太捋下巴——假牵须(谦虚)
- 老太太掐谷穗——一码对一码
- 老太太搬家
- 老太太搬家——什么都拿
- 老太太数鸡蛋——捣腾半天
- 老太太没事打鞋底——顶针
- 老太太没事打鞋底——顶针(真)
- 老太太的包袱——鼓鼓囊囊
- 老太太的嘴——吃软不吃硬
- 老太太的嫁妆