
化学是一门以实验为基础的学科,在高考试题中也充分体现了这一特征。在以往的高考中,实验题一直作为各省市高考的必考试题,虽然侧重点有所不同,但是实验题的比重有增无减,特别是新课程改革以来,进入了对学生能力的培养和科学素养的提高有更深层次要求的时代,实验的地位越来越高,它能充分考察学生对实验基础知识和基本操作的掌握、实验综合分析和应用能力。
纵观近几年的各省市高考试题,重点考查内容相近,基本以物质的制备、分离与提纯、性质的探究、定性和定量分析等为主,以简答题、选择题的考查形式出现。如近三年的浙江省理综卷中的第28题(见表1)。
表12012年~2014年浙江省高考理综卷第28题(实验题)的考查内容
2012年2013年2014年
(1)装置名称和用途装置名称仪器选择和使用、试剂的替代与优化
(2)实验条件控制实验操作流程流程试剂作用
(3)原料混合要求实验流程设计目的分离条件控制
(4)实验流程目的、萃取剂的选择要求实验操作原理实验流程设计目的
(5)仪器的规范操作定量计算和溶液配制的仪器选择洗涤剂的选择
(6)实验操作的基本原理实验误差分析
分析这三年实验题,均以物质制备实验为载
6H2O-24e-6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/6 L
解析高温条件下微生物会变性,A错误;负极是葡萄糖失电子生成CO2,电极反应为C6H12O6+6H2O-24e-6CO2↑+24H+,B正确;原电池内部阳离子应向正极移动,C错误;正极反应式为O2+4e-+4H+2H2O,消耗1 mol O2生成1 mol CO2,标准状况下体积是22.4L, D错误。选B。
【巩固练习】
图3
1.(2013年江苏)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图3。该电池工作时,下列说法正确的是( )。
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
2.(2013年新课标全国卷Ⅱ)“ZEBRA”蓄电池的结构如图4所示,电极图4材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )。
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为NiCl2+2e-Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
图5
3.(2013年北京理综)通过NOx传感器可监测NOx的含量,其工作原理示意图如图5:
①Pt电极上发生的是反应(填“氧化”或“还原”);②写出NiO电极的电极反应式:。
参考答案:
1.C 2.B
3.①还原②NO+O2--2e-NO2
4.(2010?安徽理综)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
4、D
附通讯地址:
广东省深圳市宝安新中心区金科路新安中学高中部(518101) 兰建祥
联系电话: 15013523518 E-mail:hhjx70@163.com
(收稿日期:2015-05-15)
体,试题涉及面广、综合度高、问题的设计可难可易、区分度较大,有效调控试卷的难度系数,广受命题专家青睐。在相对陌生背景下的实验题,学生得分率较低,如表2所示。
表22012年~2014年浙江省高考理综卷第28题(实验题)的平均得分(含零分卷)
2012年2013年2014年
试题总分141414
平均得分6.237.665.7
从日常的试题批改和批阅高考试卷的教师反映,学生失分的原因之一是因为题干陌生,导致紧张、思路混乱,出现词不达意、不规范、语言描述不精练、条理不清、含糊其辞、表达不完整等现象。据此,笔者结合近几年的高考真题和模拟试题,归纳总结常见的实验题中答题的规范表述,为高考增分。
一、常见仪器及规范使用
1.仪器名称表述
化学仪器是化学专业术语的重要组成部分,所以一定要避免写错别字,如坩埚,切勿写成“钳锅”;也要避免根据自己的意愿写,如蒸馏烧瓶,尽量不要写成具支烧瓶或带支管的圆底烧瓶;如吸滤瓶,不要写成具支锥形瓶;如将三口(三颈)烧瓶写成“三头、三嘴、三井、三劲”烧瓶。
2.常考仪器的规范使用
(1)密封性检查
①检漏(见表3)
表3常见仪器检漏操作的文字表述
仪器操作的规范文字表述
容量瓶加入少量水,塞紧玻璃塞,将容量瓶倒转,观察是否有水滴流出,再正放将玻璃塞旋转180°,再倒转观察是否漏水
滴定管关闭开关,加入约为3 mL~5 mL水,静置观察是否有水滴滴下
分液漏斗关闭开关,向分液漏斗中加入少量的水,垂直放置,观察是否有水滴流出(玻璃旋塞的检漏);然后将漏斗倒转,观察是否有水滴流出,再正放将玻璃塞旋转180°,再倒转观察是否漏水(玻璃塞的检漏)
②气密性检查
先形成封闭系统(如关闭活塞、导气管插入水中等),后操作(如手捂、用酒精灯微热、加水等),现象描述(如导管末端出现气泡且冷却后形成一段水柱、漏斗的导管中形成一段水柱且一段时间后不下落等),最后结论(一般为:则气密性良好)。在实际答题中学生往往只答操作,表达不完整。
(2)滴定管的使用
①检漏(见表3)
②洗涤、润洗(见二中的2、洗涤)
③装液:从上口注入溶液至滴定管“0”刻度以上2 mL~3 mL,用滴定管夹固定。
④调整液面:轻轻转动酸式滴定管的活塞或轻轻挤压碱式滴定管的玻璃球,使滴定管的尖嘴部分充满溶液,无气泡,调整液面至“0”刻度或以下;(酸式滴定管开大开关,使水快速流出;碱式滴定管将橡皮管向上弯曲,轻轻挤压玻璃球,使水缓慢流出(见图1))。
⑤滴定:用左手控制活塞,右手摇晃锥形瓶,眼睛注意锥形瓶内溶液颜色的变化(如图2、图3)。
图1图2图3
⑥滴定终点的判断:滴入最后一滴,溶液由……色突变为……色,且半分钟不变色。
(3)试纸的使用
①pH试纸:用镊子夹取pH试纸于干燥的表面皿(玻璃片、点滴板)上,用洁净的玻璃棒蘸取待测液于试纸上,待变色稳定后,与标准比色卡对比。
②其他试纸:基本操作相同,但有些试纸先要润湿。
二、实验的基本操作
1.物质的检验
在物质的检验中,学生非常容易失分,往往只看到“加……试剂,现象……”,少了几个关键点。正确的表述为:
(1)某种微粒的检查:取少量样品,滴加……试剂,如看到……现象,则结论……(如果是固体,一般要加水或……溶解后再检验);(一般用沉淀法、显色法等灵敏度高的方法)。
(2)沉淀是否完全:静置,取少量上层清液,滴加……试剂,如看到……现象,则结论……。
(3)沉淀是否洗涤干净:取少量最后一次洗涤液,滴加……试剂,如看到……现象,则结论……;(一般用沉淀法、显色法等灵敏度高的方法,尽量不用气体法、焰色反应等低灵敏度的方法)。
(4)固体质量变化的恒重表述:最后两次称量质量之差小于0.1g。
2.洗涤
(1)普通过滤后洗涤:沿玻璃棒往漏斗中加蒸馏水(或其他洗涤剂)至没过滤渣,等水自然流完后重复2~3次。学生中会出现“将滤渣取下放入烧杯中,加水洗涤”或“加水洗涤”等答案,都是表述错误或不规范的。
(2)减压过滤后洗涤:
①关小水龙头,往布氏漏斗中加洗涤剂至没过滤渣,让洗涤剂缓慢通过滤渣,等洗涤剂流完后,重复2~3次。
②粘在布氏漏斗上的物质:用滤液冲洗。
(3)溶液配制中的洗涤:用蒸馏水冲洗烧杯和玻璃棒。
(4)滴定管的洗涤或润洗:从滴定管上口装入3~5 mL的水或所装溶液,慢慢倾斜转动滴定管,使洗涤液润湿内壁,然后竖直从下口放出洗涤液,重复2~3次。
3.萃取、分液:重要操作步骤的文字表述
(1)检漏(见表3)
图4(2)振荡:右手压住分液漏斗的玻璃塞,左手握住旋塞,将分液漏斗倒转过来,用力振荡。
(3)放气:将分液漏斗的瓶身倾斜,导管朝上,左手握住旋塞,用拇指和食指旋开旋塞放气(见图4)。
(4)分液:
①操作的规范表述:将分液漏斗口上的玻璃塞打开或是玻璃塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通;打开旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,将上层液体从漏斗口上口倒出。
②萃取剂的选择:互不相溶,互不反应,溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度。
4.减压过滤(抽滤或吸滤)
重要操作步骤的文字表述。
(1)滤纸的选择:一般选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸。
(2)布氏漏斗:布氏漏斗的颈口斜面应与吸滤瓶的支管口相对。
(3)安全瓶:导管应短进长出或短进短出。
(4)相关操作:
①滤纸润湿:用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上。
②转移:用倾析法转移溶液,溶液量不超过漏斗容量的2/3,开大水龙头,待溶液快流尽时再转移沉淀。
③滤液的取出:当吸滤瓶内滤液高度快达到支管口时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶的上口倒出溶液;(不能从支管口倒出)。
④吸滤完毕或中途停止:先拆下连接抽气泵和吸滤瓶间的橡皮管,后关闭水龙头,以防倒吸。
5.焰色反应实验操作的文字表述
用洁净的铂丝(铁丝、铬丝)蘸取待测物于酒精灯火焰上灼烧,观察火焰焰色,火焰为……色,则含有……。(钾元素的焰色观察必须透过蓝色的钴玻璃)
6.结晶操作的规范表述
(1)蒸发结晶:加热到有大量晶体析出。
(2)冷却结晶:
①现象表述:加热到溶液表面有晶膜出现。
②冷却结晶的基本流程表述:加热浓缩→冷却结晶→过滤→洗涤→干燥。
三、实验流程设计目的或作用
1.过滤后洗涤滤渣的目的
(1)水洗:去除固体表面……可溶性杂质。
(2)冰水洗涤:
①去除表面的杂质。
②减少溶解而损耗。
(3)乙醇洗涤:
①去除表面的杂质(包括水)。
②减少溶解而损耗。
③乙醇易挥发,可以得到较干燥的晶体(但杂质只有水时,只答②③)。
2.某些实验温度控制的目的
(1)一般控温的目的:控制反应温度,防止……(如某物质的分解、发生副反应等)。
(2)保持恒温的目的:提高反应物的转化率,加快反应速率。
(3)反应温度不易过高的可能目的:
①防止……物质分解。
②防止……物质脱去水等。
③防止……物质发生副反应(主要用于有机反应)等。
(4)水浴/油浴/沙浴加热的优点:
①受热均匀。
②易控制温度。
(5)温度计水银球的位置及使用目的:
①制乙烯:混合液的液面下,测反应液的温度;
②蒸馏(或分馏):蒸馏烧瓶的支管口略偏下,测馏分即出去的气体的温度。
③水浴/油浴/沙浴加热:水/油/沙中,测水/油/沙的温度。
3.趁热过滤的目的
(1)除去……晶体。
(2)防止目标产物晶体的析出。
4.有机化学中制备反应后经常加无机盐(如乙酸乙酯中加饱和Na2CO3、皂化反应后加NaCl)的目的
(1)可能降低有机物的溶解度,便于分层析出(盐析法)。
(2)可能与某些物质反应,从而与其他物质分离(如阿司匹林的制备中加
NaHCO3,将阿司匹林变成可溶性的盐,与聚合物分离)。
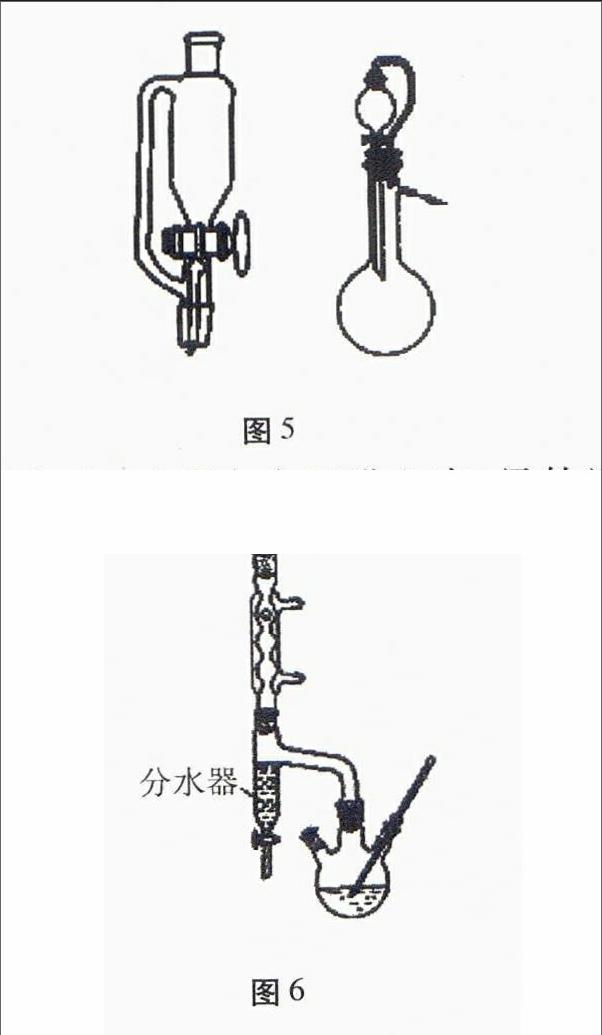
5.恒压漏斗(连通管)的作用(见图5)
平衡气压,使溶液顺利滴下。
图56.冷凝管的使用目的
(1)作用:横放——冷凝;竖放——冷凝回流,提高反应物的利用率。
(2)冷却水:冷凝水应下进上出,目的为增强冷凝效果。
7.固体粉碎的目的
增大接触面积,加快反应速率,且使反应更完全(或提高反应物的转化率),而学生往往只叙述使反应完全,表述不完整。
8.玻璃棒搅拌的作用
(1)稀释:加快散热。
(2)溶解:加快溶解。
(3)蒸发:加快散热,防止飞溅。
(4)反应中搅拌:增大接触面积,加快反应速率,使反应充分。
9.无水操作的目的
防止…水解或防止…吸水,失去…的性质。
10.有机等反应中加一种液体(不参与反应)的作用
一般为溶剂,促进……的溶解。
图6
11.实验题中的分水器的使用(见图6)
(1)使用目的:分离出水,使平衡向正方向移动。
(2)判断反应已基本结束的现象表述:分水器中水量不再增加。
12.两种气体反应前同时通入浓硫酸等溶液中的作用
(1)混合均匀。
(2)控制气流的流速。
(3)如果是浓硫酸,还起到干燥作用。
化学实验题是高考化学试题中重要的组成部分,规范的文字表述可以提高学生答题的得分率,适当地避免了因考试的紧张而导致发挥的失常,通过总结了近几年高考中几个考点,希望学生能达到事半功倍的效果。
(收稿日期:2015-03-15)
- 引导自主学习,提升数学素养
- 来一场翻转课堂的华丽转身
- 小学数学习题教学中核心素养提升策略
- 让学生在数学学习中自在生长
- 让学引思,让学生数学学习真正发生
- 借助类比,让数学学习真正走向自主
- “四格图”辅助解决问题的实践与思考
- 小学数学低段读图能力培养的探索
- 基于数学活动 推进概念学习
- 基于学生本位 引导数学交流
- 老师,除法有分配律吗
- “以学定教”引探究 “深度学习”促发展
- 逐梦平衡:在预设与生成的路上阔步前行
- 多想一步,在“想”中培养数学核心思想
- 运用“适时等待” 优化数学学习
- 在对话中提升数学教学
- 对“有效使用、开发教材”的再思考
- 转化思想在“图形与几何”领域中的运用
- 探究数形结合思想在解决问题过程中的渗透
- 借助数形结合 优化问题解决
- 以方程教学为载体,培养学生的数学思想
- 基于“模型思想”的小学数学教学
- 五“点”让数学学习更有意义
- 小学数学交互电子白板在教学情境中的创设与应用
- 提升学生思维与理解深度的教学技巧
- overscruple
- overscrupled
- overscruples
- overscrupling
- overscrupulously
- overscutched
- overseas
- overseason
- overseasoned
- overseasoning
- overseasons
- oversecretion
- oversecretions
- oversecure
- oversecured
- oversecurely
- oversecures
- oversecuring
- over-securities
- oversecurities
- oversecurity
- over-security's
- slimier
- slimiest
- slimily
- 空间制造
- 空间副词
- 空间大学
- 空间广阔
- 空间广阔,无边无际
- 空间广阔,气势雄壮
- 空间感
- 空间或位置靠前的部分
- 空间或时间没有边际
- 空间技术
- 空间探测
- 空间探测器
- 空间望远镜
- 空间武器
- 空间没有尽头
- 空间的深广
- 空间的距离短
- 空间的距离长
- 空间碎片
- 空间科学
- 空间站
- 空间线索
- 空间词
- 空间资源
- 空间辽远