王夏珩 叶永谦 陈珍珠 严业安

摘要: 现有的可燃性气体爆炸极限测定演示实验存在气体需事先制备、精确度不高等有待改进之处。通过设计氢气氧气简易发生装置、借用碱式滴定管等常用仪器设计混合气体爆炸装置,现场制备氢气、氧气并演示氢气在氧气中爆炸极限的测定过程,测得该条件下爆炸极限为14.89%~97.33%,精确度较高。通过课堂演示和科学体验,分析测定结果与文献数据的差异,培养学生的创新精神、实践能力和安全意识。
关键词: 氢气; 爆炸极限; 演示实验装置; 实验改进
文章编号: 10056629(2019)7007204中图分类号: G633.8文献标识码: B
氢气等可燃性气体的爆炸可能带来极为严重的后果,因此,控制爆炸是石油、化工等行业的重中之重。武丽娜等[1]认为: 在石油、化工等行业生产过程中,从原料到成品,使用、产生的易燃易爆物质很多,一旦发生爆炸事故,常会带来非常严重的后果,造成巨大的经济损失和人员伤亡,譬如泵房垮塌、油罐爆炸着火、管道爆炸、装置报废、人员伤亡等。因此,混合燃气爆炸极限的测定就成为化工设计人员考虑最多的因素之一,也是中学化学有必要介绍但目前相关演示实验装置还有待改进的实验之一。
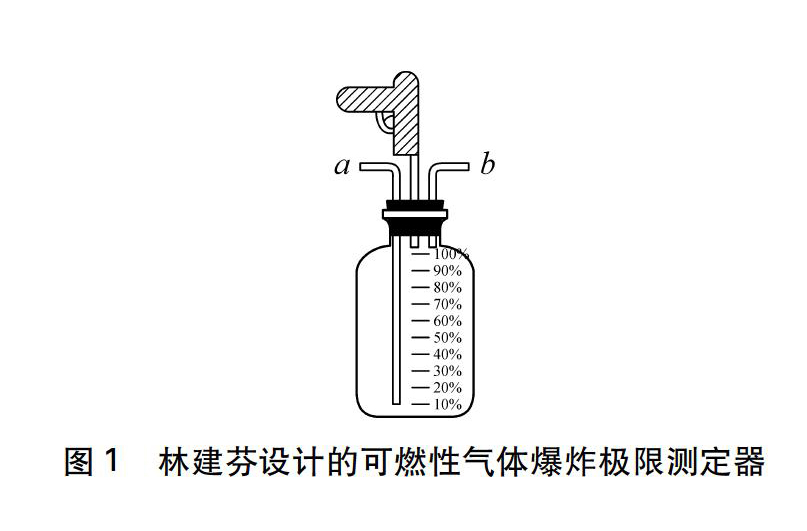
关于可燃性气体爆炸极限演示实验装置的设计,自2000年以来,分别有孟宪昌[2]、肖文中[3]、林建芬[4]等进行研究且取得明顯的演示效果。其共同特点均为使用已制备的氢气、氧气进行混合点燃,通过不同混合比例进行爆炸极限研究。以林建芬[5]所介绍的演示装置(如图1所示)为例,该装置通过改装的塑料瓶使用排水法实现不同比例的气体混合,并用电子点火器引爆,演示氢气的爆炸极限测定过程。该装置原理简单、现象明显,但氢气氧气必须事先制备,不方便在教室现场演示;且气体体积的测定不够精确,在定量研究上还存在可改进之处。
通过设计氢气氧气简易发生装置、借用碱式滴定管等设计混合气体燃烧爆炸装置,可以在教室现场演示氢气在氧气中爆炸极限的测定过程,且测定的气体体积可精确到0.01mL,有效提高了数据测定的精确度。
1 装置的组成及使用方法
氢气爆炸极限测定演示实验装置由氢气发生装置、氧气发生装置、混合气体爆炸装置等三部分组成,测定装置如图2所示。
1.1 氢气简易发生装置的设计及使用
氢气简易发生装置由150mL的锥形瓶、50mL的碱式滴定管及双孔橡皮塞等组成。使用的药品有长条锌片、常温下密度为1.20g/mL稀硫酸。使用时在碱式滴定管的下端套上橡皮套(或橡皮筋),橡皮套下方插入用于反应的长条锌片(如图2左图氢气发生装置)。往锥形瓶中加入120mL稀硫酸,插入碱式滴定管并套紧,关闭玻璃活塞。碱式滴定管下端的锌片接触稀硫酸后开始反应生成氢气,产生的氢气将反应液压入碱式滴定管。当反应液的液面下降到与锌片全部脱离后,反应停止。打开玻璃活塞,碱式滴定管中液面下降,将氢气压到混合气体爆炸装置。
1.2 氧气简易发生装置的设计及使用
氧气简易发生装置与氢气简易发生装置相同,使用的药品有用棉花包裹的二氧化锰粉末、常温下浓度为5%的过氧化氢溶液。使用时在碱式滴定管的下端用橡皮筋固定内部包有二氧化锰粉末的棉花团(如图2右图氧气发生装置)。往锥形瓶中加入120mL 5%的过氧化氢溶液,插入碱式滴定管并套紧,关闭玻璃活塞。碱式滴定管下端的二氧化锰接触过氧化氢后开始反应生成氧气,产生的氧气将反应液压入碱式滴定管。当反应液的液面下降到与棉花团全部脱离后,反应停止。打开玻璃活塞,碱式滴定管中液面下降将氧气压到混合气体爆炸装置。
1.3 混合气体爆炸装置
混合气体爆炸装置由150mL的磨口锥形瓶、改装的50mL碱式滴定管、50mL的塑料三角漏斗、气流单向阀及自制辅助装置组成。使用的药品有溶有蔗糖的洗洁精、水。其中碱式滴定管改装方法如下: 在碱式滴定管的下端加装玻璃外管,外管下口处理成标准磨口,可与上述锥形瓶紧密磨合在一起。外管上装有三个导气管,均带有玻璃活塞。其中连接活塞1、活塞2的两个导气管分别用于充入氢气、氧气,第三个导气管用于将混合气体放出进入气流单向阀生成气泡(如图2中图混合气体爆炸装置)。
使用时,往锥形瓶中装满水,塑料三角漏斗下端插入气流单向阀,气流单向阀再套在活塞3所连接的导气管上。三角漏斗中滴入2mL溶有蔗糖的洗洁精。将改装后的碱式滴定管插入集气瓶(图2中图锥形瓶),剩余两个导管分别用橡皮管连接氢气和氧气发生装置。控制氢气氧气发生装置的玻璃活塞,可以将一定体积的氢气和氧气分别导入集气瓶中进行充分混合。导入的气体将锥形瓶中的水压入碱式滴定管中,通过碱式滴定管上液面的上升读数可以判断导入的气体体积。打开并控制三角漏斗下方玻璃活塞3,碱式滴定管中液面下降,将混合气体缓慢通过气流单向阀进入三角漏斗中的洗洁精形成混合气体的肥皂泡。由于溶解有蔗糖,使水分子间氢键明显增强,可以得到大而稳定的肥皂泡[6]。点燃该肥皂泡,通过肥皂泡的不燃烧、安静燃烧、爆炸等现象判断爆炸极限。由于该爆炸仅限于气体肥皂泡的爆炸,并有气流单向阀阻断,爆炸产生的火焰不会被引到气体发生装置中,确保安全。
2 氢气爆炸极限测定的实验步骤
国家标准《空气中可燃气体爆炸极限测定方法》中给出了可燃气体与空气混合物爆炸极限的具体测定方法[7]。该标准规定,用渐进法通过测试确定极限值,测定爆炸下(上)限时,如果在某浓度下未发生爆炸现象,则增大(减少)可燃气体浓度直至测得能发生爆炸的最小(大)浓度;如果在某浓度下发生爆炸现象,则减少(增大)可燃气体浓度直至测得不能发生爆炸的最小(大)浓度。同一试验装置测得的重复试验结果,误差不应大于5%。并且要求该测试要具有重复性,即同一个测试人员测得的重复试验结果误差不应大于5%;要具有再现性,不同实验室测得的重复试验结果的平均值误差不应大于10%。按照该标准,设计了以下实验步骤。
2.1 检验气密性
按图2装置图将仪器装配好,关闭所有玻璃活塞。分别往三个碱式定管中加水,如加到一定量的水后液面均无法再下降且保持液面高度不变,说明整个装置气密性良好。
2.2 固定锌片和二氧化锰
将三片锌片用橡皮筋固定在碱式滴定管(图2左图)距离下管口5cm的管壁上;将二氧化锰用棉花包裹,用橡皮筋固定在另一碱式滴定管(图2右图)距离下管口5cm的管壁上,再分别加入密度为1.20g/mL的稀硫酸和浓度为5%的过氧化氢溶液。
2.3 检验氢气的纯度
药品加入一段时间后,实现固液分离效果,氢气、氧气生成后均收集在各自发生装置中。打开活塞1,使氢气进入中间混合气体爆炸装置,氢气将水压入碱式滴定管,关闭活塞1。打开活塞3,控制气流进入形成氢气肥皂泡,关闭活塞3。点燃后如果出现清脆的爆鸣声,说明氢气不纯。将锥形瓶中气体全部排出,再次通入氢气形成肥皂泡,直至点燃氢气肥皂泡时安静地燃烧,说明该氢气是纯净的。
2.4 检验氧气的纯度
在检验氢气的纯度之后,打开活塞2,使氧气进入混合气体爆炸测定装置,氧气将水压入碱式滴定管,关闭活塞2。打开活塞3,控制气流进入形成氧气肥皂泡,关闭活塞3。用带火星的木条靠近,如果出现爆鸣声,说明氧气中还混有氢气,不纯净。将集气瓶中气体全部排出,再次通入氧气形成肥皂泡,直至带火星的木条可以安静地复燃,说明该氧气是纯净的。
2.5 测定氢气在氧气中的爆炸极限
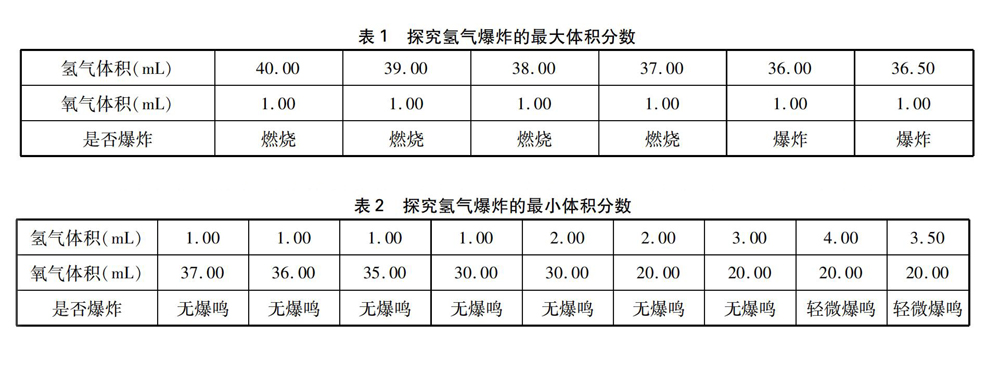
(1) 测定氢气爆炸的最大体积分数: 在氢气氧气的混合气体中,如果氢气体积远远大于氧气体积,其燃烧就如纯净氢气的燃烧,呈现安静燃烧的现象。只有当氢气体积小于一定比例时,才会发生爆炸。因此,使用二分法尋找氢气在氧气中的爆炸极限: 由于50mL碱式滴定管一部分插入锥形瓶中无法读数,取可读数的氧气体积40.00mL,控制每次氧气体积为1.00mL,氢气体积从40.00mL开始试探,如果不爆炸,再降1.00mL试探(见表1)。经过多次试探,发现氧气为1.00mL,氢气为37.00mL时安静燃烧;氧气为1.00mL,氢气为36.00mL时爆炸;再减小区间,当氧气为1.00mL,氢气为36.50mL时爆炸。通过以上数据,测得氢气爆炸的最大体积比例为氧气1.00mL、氢气36.50mL,此时氢气的体积分数为97.33%。找到最大体积分数后,对该比例重复三次且结果均一致,该比例才符合测定要求(下同)。
(2) 测定氢气爆炸的最小体积分数: 在氢气氧气的混合气体中,如果氧气体积远远大于氢气体积,用燃烧着的木条靠近混合气体,就如靠近接近纯净的氧气,其现象为木条燃烧得更旺但不爆炸。使用试探法寻找氢气开始爆炸的最小体积分数: 氢气体积固定为1.00mL,氧气体积从37.00mL起开始试探,此时木条火焰更旺但不爆炸;氧气再按每次降1.00mL试探,直至氧气为30.00mL,仍不爆炸。此时增加氢气体积为2.00mL,氧气保持为20.00mL再试探仍不爆炸(见表2)。经过多次试探,发现氢气为3.00mL,氧气为20.00mL时无爆鸣且燃烧,火焰更旺;氢气为4.00mL,氧气为20.00mL时发生轻微爆鸣;再将氢气减少为3.50mL,氧气为20.00mL时轻微爆鸣(见表2)。重复三次,结果均一致。通过测定,可以判断氢气爆炸的最小体积比例为氢气为3.50mL、氧气为20.00mL,即可计算出氢气爆炸的最小体积分数为14.89%。
综合以上两个数据可以得出,在该实验条件下氢气在氧气中的爆炸极限为14.89%~97.33%。
3 装置设计及使用的意义
魏书斌等[8]认为,中学生学习化学的时间和动手实验的机会减少,学生学习化学的兴趣在消退。解决这一问题的对策包括统筹兼顾演示实验、分组实验、探究实验和家庭实验,提高师生研究性学习能力等。本演示实验装置设计的初衷就是通过模拟氢气爆炸极限的测定,强化学生对可燃性气体燃烧安全性的关注,并在实验过程中强化定量研究的严谨性。测定的结果是在该实验条件下,氢气在氧气中的爆炸极限为14.89%~97.33%。 但是,根据杨金翠等[9]测定的结果为: 氢气在纯氧气中爆炸极限下限为4.0%,上限为94.0%。数据上存在较大差别的原因可能与测定的条件有关,杨金翠等测定的数据是在隔绝空气的条件下用电子脉冲点火的;而本装置实验并未完全隔绝空气,含有水蒸气且用明火点燃氢氧混合气体形成的肥皂泡。基于正常的生活条件,完全纯净的氢气和氧气的混合爆炸是不现实的,含有水蒸气等气体的爆炸反而更常见。因此,在演示实验后,应组织学生分析文献数据与本实验数据的差别及其可能原因。通过分析,培养学生尊重实验数据、辩证分析数据的科学习惯。本实验装置已在课堂上进行演示,并在科学课中让小学生、初中生、高中生等不同学段学生体验。通过让更多的学生参与实验过程,使实验装置的教育和警示作用得以更大范围的传播,这是装置设计及使用的意义。
(1) 原理简单而创意不简单。设计的氢气、氧气简易发生装置,用橡皮筋将锌片、棉花包裹二氧化锰固定在滴定管下管实现固液分离,小创意达到了启普发生器的效果。将剧烈危险的氢气爆炸改进为氢氧肥皂泡的爆炸,既安全环保又可以通过气泡的爆炸与否判断爆炸极限的范围,便于推广应用。
(2) 仪器简单而现象不简单。用改装的碱式滴定管、锥形瓶、三角漏斗及气流单向阀等即可设计出氢气爆炸极限测定的演示装置。以气泡的燃烧、火焰的大小、爆鸣的声音等形成强烈的视觉和听觉冲击,让学生更直观地理解爆炸极限的测定原理。
(3) 过程简单而影响不简单。将粗略的体积测定改进为精确度为0.01mL的定量研究过程,通过在课堂上演示、体验进行警示教育以及简易的操作让学生体会启普发生器的原理、混合气体燃烧爆炸的过程及爆炸极限测定的步骤、注意事项,有效地提高了学生的化学学科核心素养。
总之,实验设计的目的不是为设计而设计,而是为了解决生产、生活和学习中的问题。通过氢气爆炸极限测定演示实验装置的创新设计、课堂演示以及在科学课上体验,可以有效地提高了学生的创新精神、实践能力和安全意识,有利于学生核心素养的培养。
参考文献:
[1]武丽娜, 陈睿谦, 徐莹, 张喜春. 确定混合燃气爆炸极限的重要意义及计算方法[J]. 化肥设计, 2014, 52(2): 18~21.
[2]孟宪昌. 氢、空气混合气体爆炸极限实验的演示[J]. 化学教育, 2000, (11): 43.
[3]肖文中, 何维建. 自制可燃性气体“爆炸极限”测定器及爆鸣演示器[J]. 实验教学与仪器, 2011, (5): 48~55.
[4][5]林建芬. 一种适用于定量科学探究活动的氢气爆鸣演示仪[J]. 教育与装备研究, 2017, (5): 75~78.
[6]叶麦琪, 叶永谦, 陈珍珠. 巧用“肥皂泡”设计几种常见气体检验的分组实验方案[J]. 化学教学, 2017, (5): 69~73.
[7]GB/T 12474-90. 空气中可燃气体爆炸极限测定方法[S]. 北京: 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008.
[8]魏书彬, 陈加柱. 浅议高中化学实验教学的问题与对策[J]. 化学教学, 2015, (11): 76~78.
[9]杨金翠, 吴志刚. 对氢气与氧气混合发生爆炸的分析[J]. 内蒙古科技与经济, 2007, (2): 105.
- 课堂“活”起来,学生“动”起来
- 小学语文教学中学生朗读能力培养策略
- 浅谈提高三年级少数民族学生国语能力的方法
- 激发、聆听和拓展
- 解析小学语文朗读训练策略
- 海明威和他的黑暗短篇小说《士兵之家》
- 传统文化在党校文学教学中的应用探究
- 鲁迅文学的图像表达与传播功能探究
- 绿色设计理念在室内设计中的应用研究
- 大数据时代财务专业数据的科学归档与有效利用分析
- 谈对互联网金融在线支付风险的有效措施
- 新形势下电力安全与管理的新思考
- 国有煤矿安全教育培训的探索与思考
- 高等院校房改房的增量改革模式
- 市场营销渠道的冲突与管理
- 食品质量管理中食品安全风险分析的作用
- 林业建设与农村经济的可持续发展探析
- 刍议以人民为中心的发展思想
- 试论民事执行检察监督制度
- 国际商务谈判互动话语理论基础与研究分析
- 交通运输业如何加强财务会计管理工作
- 论明朝地方监察制度的制衡模式
- 企事业单位的电子档案的利用及其管理
- 浅谈影响社区老年人自我养老现状的因素
- 基于军运会的武汉市旅游形象探究
- hisˌtoric cost
- hisˌtoric cost acˌcounting
- hisˌtoric high
- hisˌtoric low
- hit
- hit and miss
- hit-and-miss
- hit and ran
- hit-and-ran
- hit-and-run
- hit and run
- hit and runner
- hit-and-runners
- hit and running
- hit-and-running
- hit-and-runs
- hit a wall
- hit back
- hit back at
- hit back (at sb/sth)
- hit back/strike back
- hit-bottom
- hitch
- hitched
- hitched-up
- 信巫不信医
- 信差
- 信幸
- 信度
- 信当喜极翻愁误,物到难求得尚疑
- 信待
- 信徒
- 信徒、党羽
- 信得及
- 信得过
- 信心
- 信心百倍
- 信志
- 信念
- 信念、意志坚定
- 信恃
- 信息
- 信息业
- 信息中介
- 信息中心
- 信息交换手段
- 信息交易所
- 信息产业
- 信息产权
- 信息企业