单环刺螠Urechisunicinctus幼体肠道消化酶活性的测定方法
杨成林 林淦旻 常林瑞 刘学迁 刘峰 赵彦翠
摘 要:探究了单环刺螠(Urechis unicinctus)幼体(平均体重(1.468 ± 0.222)g)肠道蛋白酶、淀粉酶、脂肪酶的测定方法、操作步骤、注意事项。蛋白酶测定采用Folin-酚法,其中建立的酪氨酸回归方程为y=15.487x-0.092 3(决定系数R2=0.999 2);淀粉酶测定采用淀粉-碘比色法,以0.08%的淀粉溶液为底物。脂肪酶测定采用聚乙烯醇橄榄油乳化液水解法(NaOH滴定法)。结果表明,单环刺螠幼体肠道蛋白酶活力、淀粉酶、脂肪酶活力分别为29.350±2.592、10.600±0.844、(5.266±0.224)U/mg prot。
关键词:单环刺螠(Urechis unicinctus);肠道;蛋白酶;淀粉酶;脂肪酶;测定方法
中图分类号:S917.4
单环刺螠(Urechis unicinctus)俗称海肠、海肠子,属于螠虫动物门(Echiurioidea),螠纲(Echiurida),无管螠目(Xenopneusta),刺螠科(Urchidae)、刺螠属(Urechis),适应能力强,挖“U”型洞穴,栖息于泥沙岸潮间带下区和潮下带浅水区泥沙底质,栖息地广泛分布于俄罗斯、朝鲜半岛、日本和中国的黄渤海沿岸[1]。作为名贵的海鲜产品,单环刺螠具有极高的开发养殖前景。单环刺螠味道鲜美,营养丰富,体壁肌含有丰富的蛋白质以及人体需要的氨基酸,具有极高的营养价值,被誉为“裸体海参”。单环刺螠体内存在速激肽[2]、抗凝血肽[3]等多种生物活性肽,这些生物活性肽具有抗菌、抗肿瘤及提高小鼠免疫力等功能[4],因此单环刺螠还是一种具有潜在药用价值的海洋无脊椎动物。随着单环刺螠育苗技术的突破,单环刺螠的规模化育苗和养殖在辽宁大连、山东烟台等地也日渐展开。单环刺螠的消化道结构简单,主要包括食道、嗉囊、砂囊、胃、肠道等,其中肠约占消化道长度的60%,并且细胞内有大量的泡状结构和线粒体,可以认为中肠是单环刺螠物质吸收的主要场所[5-6]。目前关于单环刺螠消化酶的研究较少。许星鸿等[7]通过Folin-酚法、淀粉-碘比色法、NaOH滴定法,采用正交实验设计,研究了不同盐度、pH及温度对单环刺螠成体(平均体重为(71.2±8.5)g)肠道蛋白酶、淀粉酶和脂肪酶活力的影响。但是许星鸿等[7]的研究并没有具体详细的测定方法,同时目前关于单环刺螠幼苗肠道消化酶的研究也未见报道。单环刺螠的规模化育苗和养殖的发展,离不开饵料/饲料的开发,而消化酶活力研究有助于了解单环刺螠对饵料/饲料中基本营养成分的消化能力,为其筛选饵料/饲料原料提供依据。本研究探索单环刺螠幼体肠道蛋白酶、淀粉酶、脂肪酶活性的测定方法、操作步骤及注意事项,研究单环刺螠幼体肠道蛋白酶、淀粉酶和脂肪酶活性,以期为单环刺螠人工饵料/饲料的开发提供基础研究方法。
1 材料与方法
1.1 粗酶液的制备
取实验室养殖单环刺螠30头,平均体重为(1.468±0.222)g(平均值±标准差)。10头一组,随机分成3组。每一组用解剖工具在冰盘上将单环刺螠的肠道完整取出,用滤纸吸干肠表面的水分,称重,10头混成一个样品(分别为样品1、样品2、样品3),按样品重量与体积比为1∶9加入0.85%的生理盐水在冰浴条件下进行研磨,研磨后将匀浆液进行离心(4 ℃,4 000 r/min),所得上清液就是粗酶液,将粗酶液在液氮中速冻后,转移到-80 ℃冰箱保存,备用。
1.2 粗酶液蛋白浓度的测定
样品粗酶液的蛋白浓度采用考马斯亮蓝试剂盒(南京建成生物工程研究所)测定。根据试剂盒说明书的步骤进行实验操作,每个样品设置两个平行样进行测定,每个样品的结果取两次平行的平均值。样品粗酶液中蛋白浓度的单位换算为mg prot/mL。
1.3 蛋白酶活性的测定——福林-酚法
本实验采用福林-酚法[8]测定单环刺螠肠道蛋白酶活力,Folin-酚试剂是磷钨酸(H3O40PW12)与磷钼酸(H3PO4·12MoO3)混合试剂,在pH值大于7的情况下极其不稳定,被酚类化合物还原而成蓝色(钨兰与钨兰的混合价态的蓝色化合物)。蛋白质中含有具有酚基的氨基酸(酪氨酸、苯丙氨酸、色氨酸),因此可用蛋白酶水解酪素生成酚基氨基酸的呈色反应来间接测定蛋白酶活力。本实验使用的福林试剂购于北京索莱宝科技有限公司。
1.3.1 实验主要试剂
0.02 M pH值7.5磷酸缓冲液、0.5 M NaOH溶液、0.5%酪素。
0.5%酪素的配制:称取酪蛋白0.5 g以0.5 M NaOH 1 mL润湿,加入60 mL 0.02 M pH 7.5磷酸缓冲液稀释后在热水浴中不断搅拌至完全溶解。待完全冷却后,转移至100 mL容量瓶,再用0.02 M pH7.5的磷酸缓冲液定容(冰箱可保存一周)[9]。
1.3.2 酶活力的测定
1.3.2.1 酪氨酸标准曲线制作
1.3.2.1.1 主要试剂及配制
1 mol/L盐酸、0.55 M Na2CO3 溶液、10%三氯乙酸、100.0 μg/mL 酪氨酸标准溶液。
100.0 μg/mL 酪氨酸标准溶液:精确称取L-酪氨酸0.050 0 g(105 ℃干燥至质量恒定),用1 mol/L盐酸溶液30 mL溶解后用50 mL容量瓶定容,即为1.00 mg/mL 酪氨酸标准溶液。吸取1.00 mg/mL 酪氨酸标准溶液10.00 mL,用0.1 mol/L盐酸溶液(将1 mol/L盐酸溶液稀释10倍即得0.1 mol/L盐酸溶液)定容至100 mL容量瓶,即可得到100.0 μg/mL L-酪氨酸标准溶液。
1.3.2.1.2 L-酪氨酸標准曲线的绘制
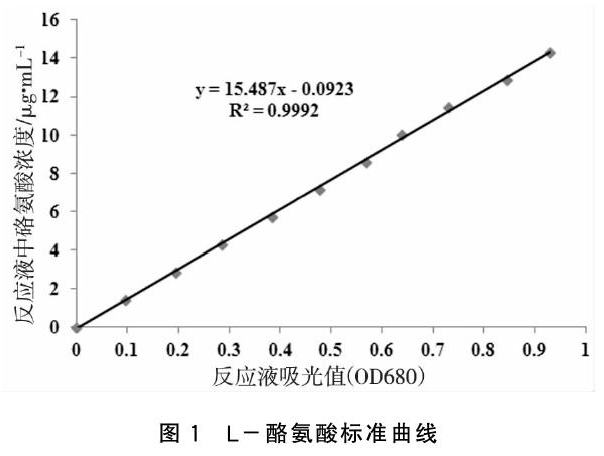
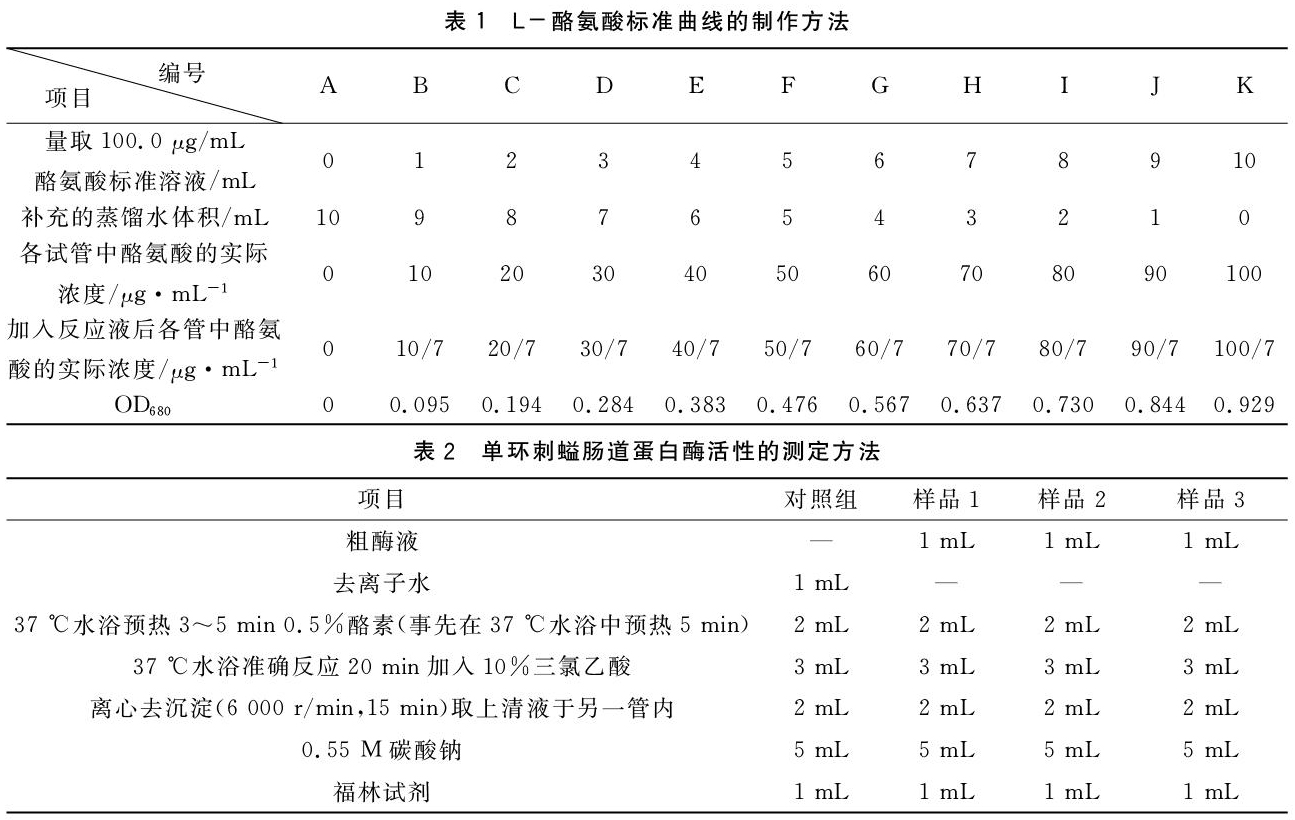
用100.0 μg/mL L-酪氨酸标准溶液,配制系列浓度的L-酪氨酸溶液(0、10、20、30、40、50、60、70、80、90、100 μg/mL),配制方法见表1。取10 mL离心管,分别取上述系列浓度的L-酪氨酸溶液1.00 mL,各加5.00 mL 0.55 M Na2CO3 溶液,再各加入1.00 mL福林试剂,放入37 ℃恒温水浴锅中水浴显色15 min,用分光光度计于波长680 nm[10],以A管为空白管调零(表1),分别测定吸光值,每个系列浓度做两个平行,OD值取两个平行的平均值。
以反应液吸光度OD680为横坐标(表1),以各管反应液中酪氨酸的实际浓度为纵坐标(表1),绘制标准曲线并计算回归方程(图1)。
1.3.2.2 实验样品的测定 实验设置1个对照组与3个样品测定组,对照组和每个测定组分别设两个平行,吸光值取两个平行的平均值。反应用具盖的离心管以便混匀与离心,粗酶液稀释40倍后用于测定,测定步骤如表2。完全混匀后,置于37 ℃恒温水浴锅中水浴显色15 min后,于680 nm波长处以对照组校零,读取样品测定组吸光值。利用绘制的酪氨酸标准曲线回归方程计算出酪氨酸浓度后,进行蛋白酶活力的计算。
1.3.2.3 注意事项 酶液与底物的作用温度、作用时间要严格控制,否则将对实验结果有较大的影响。在正式实验之前,对于同一样品,通过预实验确定粗酶液需要稀释的倍数,以保证实验样品的吸光值在酪氨酸标准曲线范围内。
1.4 淀粉酶活性的测定——淀粉-碘比色法
淀粉-碘比色法的原理在于淀粉经淀粉酶水解后的产物与碘液可形成蓝色包合物[10]。分析淀粉酶活力有助于研究与分析其肠道对不同食物来源的淀粉的消化能力[11]。
1.4.1 主要试剂的配制
0.08%可溶性淀粉:精确称取可溶性淀粉0.20 g,用蒸馏水约10 mL溶解,充分搅拌使其成淀粉悬液,完全转移至250 mL容量瓶中,再用蒸馏水定容。淀粉懸液可在0~4 ℃冰箱内保留一周(最好现配现用)。
0.1 M碘贮存液:准确称取碘化钾(KI)11.25 g及碘酸钾(KIO3)0.891 7 g置于500 mL烧杯中,加入200 mL蒸馏水,待完全溶解后缓慢地加入2.25 mL浓盐酸,混匀后转入250 mL容量瓶中,再用蒸馏水定容。置于冰箱中备用。
0.01 M碘应用液:量取0.1 M碘贮存液20 mL,用蒸馏水稀释至200 mL(200 mL容量瓶定容),贮存于棕色瓶中。可在0~4 ℃冰箱内保存约一个月。
1.4.2 实验样品的测定 实验设置1个对照组和3个样品测定组,每组分别设置两个平行,吸光值取两个平行的平均值。取10 mL离心管,标注对照组与测定组,粗酶液稀释10倍后用于测定,具体操作步骤见表3[12]。立刻混匀。用蒸馏水校零,于660 nm波长处测定吸光值。
1.4.3 注意事项 当淀粉酶含量较多或活性较高时,因淀粉被淀粉酶全部水解而不显色,故可根据反应显色程度,通过预实验,调整淀粉浓度、粗酶液稀释倍数及使用量。此外,淀粉溶液较为稳定,故对照组的吸光值不会改变,因此在测定中不用每次都设置对照组。反应后出现蓝色沉淀,因而测定时须将溶液混匀后再进行测定,否则将影响实验结果。
1.5 脂肪酶活性测定方法——聚乙烯醇橄榄油乳化液水解法(NaOH滴定法)
聚乙烯醇橄榄油乳化液水解法测定单环刺螠脂肪酶活性的原理为天然油脂被水解后而生成的游离脂肪酸可以被NaOH中和,反应式为RCOOH+NaOH→RCOONa+H2O,故可根据消耗的NaOH溶液的量间接测定脂肪酶的活性[13-14]。测定单环刺螠肠道脂肪酶活力有助于研究与分析其肠道对不同食物来源中的脂肪的消化能力。
1.5.1 主要试剂的配制
0.025 M pH值7.5磷酸缓冲液、0.05 M 标准NaOH溶液、4%聚乙烯醇橄榄油乳化液、1% 酚酞。
4%聚乙烯醇橄榄油乳化液:称取10 g聚乙烯醇颗粒(天津市光复精细化工研究所,平均聚合度为1 750±50)放入500 mL烧杯中,加入250 mL蒸馏水,过夜溶胀,一边加热(80~90 ℃)一边不停搅拌至完全溶解,最后用三层纱布过滤,滤液备用。量筒量取4%聚乙烯醇溶液150 mL,加入50 mL分析纯橄榄油,用磁力搅拌器搅拌至呈乳白色,即为聚乙烯醇橄榄油乳化液,存于4 ℃冰箱内待用(3天内使用)。
1% 酚酞:称取1 g酚酞粉末溶于60 mL无水乙醇中,完全转移至100 mL容量瓶中并用无水乙醇定容至100 mL。
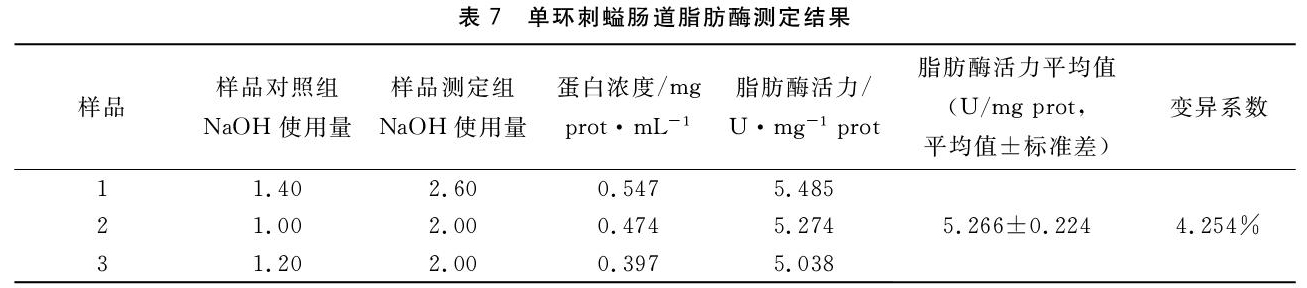
1.5.2 实验样品的测定 取50 mL烧杯若干,分别为样品对照组与样品测定组,每组设两个平行,结果用两个平行的平均值表示,测定使用原始粗酶液,具体操作方法见表4。用0.05 M标准NaOH溶液滴定至微红,并记录使用的NaOH溶液的体积。
1.5.3 注意事项 在加入95%乙醇时要不停搅拌,否则会产生絮状物影响实验结果。加入95%乙醇是为了终止反应停止酶作用和溶解脂肪酸,故在样品测定组加入95%乙醇时要快速,以保证反应时间相同。
2 结果与分析
2.1 蛋白酶活力
蛋白酶比活力单位定义:每毫克组织蛋白在37 ℃下每分钟水解酪素而产生的1 μg酪氨酸为一个蛋白酶活力单位,单位为U/mg prot。
蛋白酶比活力(U/mg prot)=A20÷(取样量×待测样本蛋白浓度稀释倍数)
式中:A表示根据样品的吸光值通过回归方程计算,得出的相应酪氨酸的微克数;20表示反应时间为20 min;取样量为酶反应时所取的酶液的体积,本实验中酶液的使用量为1 mL;稀释倍数是指反应酶液相对于原始粗酶液的稀释倍数,本实验中稀释倍数为40倍[15]。
测定结果见表5,单环刺螠肠道蛋白酶活力为(29.350±2.592)U/mg prot。
2.2 淀粉酶活力
淀粉酶比活力单位定义:每毫克组织蛋白在37 ℃与底物作用30 min,水解10 mg淀粉,定义为1个淀粉酶活力单位,单位为U/mg prot。
淀粉酶比活力(U/mg prot)=(对照组OD值-测定组OD值对照组OD值×0.8×0.510×30 min7.5 min÷(取样量×待测样本蛋白浓度(mg prot/mL)稀释倍数)
式中:0.8为1 mL 淀粉溶液中含有淀粉0.8 mg;0.5为反应体系中加入淀粉溶液的体积0.5 mL;10表示是10 mg 淀粉;稀释倍数是指反应酶液相对于原始粗酶液的稀释倍数,本实验中稀释倍数为10倍。
测定结果见表6,单环刺螠幼体肠道淀粉酶活力为(10.600±0.844)U/mg prot。
2.3 脂肪酶活力
脂肪酶比活力单位定义:在pH值7.5与40 ℃条件下,每毫克組织蛋白每分钟水解脂肪所产生1 μmol脂肪酸定义为一个脂肪酶活力单位,单位为U/mg prot[15]。
脂肪酶比活力(U/mg prot)=(样品测定组NaOH溶液用量-样品对照组NaOH溶液用量)×50t÷(取样量×待测样本蛋白浓度(mg prot/mL)稀释倍数)
式中:(测定组NaOH溶液用量-对照组NaOH溶液用量)单位是 mL;50表示消耗0.05 mol/L 的NaOH 1 mL 相当于反应体系产生脂肪酸50 μmol(GB/T 23535-2009脂肪酶制剂);t表示反应时间,本实验中反应时间为20 min;稀释倍数是指反应酶液相对于原始粗酶液的稀释倍数,本实验中使用的是原始粗酶液,故稀释倍数为1倍。
测定结果见表7,单环刺螠肠道脂肪酶活力为(5.266±0.224)U/mg prot。
3 分析与讨论
消化酶是维持机体正常代谢的生命活性物质,可以催化生物体内各种生化反应,从消化酶活性的大小可以得出机体对营养物质的消化吸收能力,根据其消化对象的不同,可以分为蛋白酶、脂肪酶和淀粉酶等几种。消化酶活性的测定方法多种多样,不同的研究人员,不同的实验条件往往所采用的标准及定义不同,而且不同的动物都有其特异性。因此对于消化酶研究相对匮乏的单环刺螠,针对消化酶活性测定方法的详细操作方法、注意事项的研究尤为重要。本实验所测定的单环刺螠幼体肠道蛋白酶、淀粉酶、脂肪酶活力,在反应温度、反应时间、反应pH值等反应条件下都需要准确把控,否则会对实验产生较大的影响[7,16],同时需要仔细开展预实验摸索合适的取样量,密切关注酶活测定过程中的注意事项,才能保证数据的可信性。
水产动物消化酶活力受不同养殖环境条件如养殖温度、盐度、pH值的影响[7,17-19],尤其是养殖环境温度对水产动物消化酶活性影响最为明显[17-19]。本实验中所用的单环刺螠幼体(平均体重(1.468±0.222)g)养殖条件为温度15~18 ℃,盐度28‰~30‰,pH为7.8~8.0,投喂饲料为配合饲料(粗蛋白质含量为46.80%,粗脂肪含量为7.66%)。本实验测得单环刺螠幼体肠道蛋白酶、淀粉酶、脂肪酶活力分别为29.350±2.592、10.600±0.844、(5.266±0.224)U/mg prot。目前,对单环刺螠消化酶活性的研究很少。许星鸿等[7]研究了不同养殖条件(pH、温度和盐度)对单环刺螠成体(平均体重(71.2±8.5)g,投喂饲料为小球藻和中肋骨条藻)肠道蛋白酶、淀粉酶、脂肪酶活力的影响。许星鸿等[7]研究表明在养殖条件为温度15 ℃,盐度30 ‰,pH为8的情况下,单环刺螠成体肠道蛋白酶、淀粉酶、脂肪酶活力分别为4.42±0.31、16.10±1.08、(3.87±0.47)U/mg prot;养殖条件为温度20 ℃,盐度35 ‰,pH为8的情况下,单环刺螠成体肠道蛋白酶、淀粉酶、脂肪酶活力分别为17.34±1.25、13.38±0.39、(7.46±0.63)U/mg prot。虽然许星鸿等[7]研究中的养殖条件与本实验的养殖条件接近,酶活的测定方法也一致,但是由于饲料的成分对水产动物消化酶活性有较大影响[20-22],所以很难进行单环刺螠幼体和成体肠道蛋白酶、消化酶、脂肪酶活性的比较。
随着对单环刺螠肠道各类消化酶测定的相关研究不断深入,对其消化酶活力的了解会越来越清晰,可以进一步掌握单环刺螠对食物不同成分的消化吸收能力,为其天然饲料的选择、人工饲料各类成分的配比和适宜养殖条件的确定提供理论基础,使其不仅可以提高蛋白质和淀粉的利用率,又可以减少粪便中的氮、磷排放量,这样不仅充分利用饲料、节约资源,又能减轻水体污染,因此单环刺螠消化酶研究将有助于单环刺螠的规模化养殖。
4 结论
本实验详细探究了单环刺螠幼体肠道蛋白酶、淀粉酶、脂肪酶的测定方法、操作步骤、注意事项,为单环刺螠生物学及饲料开发研究中消化酶的测定提供基础参考。在此实验方法的指导下测得投喂配合饲料的单环刺螠幼体(平均体重(1.468±0.222) g)肠道蛋白酶、淀粉酶、脂肪酶活力分别为29.350±2.592、10.600±0.844、(5.266±0.224)U/mg prot。
参考文献:
[1] 郑岩,白海娟,王亚平.单环刺螠对水温、盐度和pH的耐受性的研究[J].水产科学,2006,25(10):513-516.
[2] Sung W S,Park S H,Dong G L.Antimicrobial effect and membrane-active mechanism of Urechistachykinins,neuropeptides derived from Urechis unicinctus[J].Febs Letters,2008,582(16):2463-2466.
[3] Jo H Y,Jung W K,Kim S K.Purification and characterization of a novel anticoagulant peptide from marine echiuroid worm,Urechis unicinctus[J].Process Biochemistry,2008,43(2):179-184.
[4] 温春光,王庆波,吴雅清,等.单环刺螠药学价值开发[J].全国第二届海洋与陆地多糖多肽及天然创新药物研发学术会议,2015,07:24-27.
[5] 陈宗涛,张志峰,康庆浩,等.单环刺螠消化道的发生和分化[J].中国水产科学,2006,13(5):700-704.
[6] 邵明瑜,张志峰,康庆浩,等.单环刺螠虫消化道组织学和细胞学[J].中国水产科学,2003,10(4):265-268.
[7] 许星鸿,朱晓莹,阙义进,等.pH、温度和盐度对单环刺螠消化酶和溶菌酶活力的影响[J].水产科学,2017,36(2):138-142.
[8] Lowry O H,Rosebrough N J,Farr A L,et al.Determination of protein by Folin-Ciocalteu Method[J].Biology Chemistry,1951,193(1):265-275.
[9] 趙玉莲.“福林酚法”蛋白酶活性的探讨[J].中国调味品,1986(6):5-15.
[10] 刘泽军,魏明竞.淀粉酶测定进展[J].国外医学临床生物化学与检验学分册,1992,13(1):15-17.
[11] 戚传利,王福强,钱淑媛,等.复合酶对刺参生长、免疫酶活性和消化酶活性的影响[J].中国饲料,2014(19):33-36.
[12] 桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004,119-121.
[13] 江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[14] 蒋传葵,金承德,吴仁龙,等.工具酶的活性测定[M].上海:上海科学技术出版社,1982:74-76,79-82.
[15] 白燕,王维新.刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性测定方法[J].饲料工业,2012,33(20):28-31.
[16] 王羽,孙永欣,汪婷婷,等.海参消化酶的研究进展[J].中国饲料,2008(13):38-44.
[17] 黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学,2004,11(6):585-588.
[18] 方之平,潘黔生,何瑞国,等.温度对彭泽鲫主要消化酶活力的影响[J].水生态学杂志,1998(2):15-17.
[19] 黄东科,梁华芳,温崇庆,等.温度对波纹龙虾消化酶活力的影响[J].渔业现代化,2017,44(06):35-39.
[20] 吴婷婷,朱晓鸣.鳜鱼、青鱼、草鱼、鲤、鲫、鲢消化酶活性的研究[J].中国水产科学,1994,1(2):10-17.
[21] Pedersen B H,Nilssen E M,Hjelmeland K.Variations in the content of trypsin and trysinogen in larval herring (Clupea harengus) digesting copepod nauplii[J].Marine Biology,1987,94(2):171-181.
[22] 邵庆均,苏小凤,许梓荣.饲料蛋白水平对宝石鲈增重和胃肠道消化酶活性影响[J].浙江大学学报(农业与生命科学版),2004,30(5):553-556.
Abstract:The determination methods, operation steps and precautions for operation methods of intestinal protease, amylase and lipase activity in juvenile Urechis unicinctus (average weight (1.468 ± 0.222)g) were explored in detail. The intestinal protease, amylase and lipase activity in juvenile Urechis unicinctus was respectively determined by method of Folin-phenol, starch-iodine colorimetry and hydrolysis of polyvinyl alcohol emulsion of olive oil (titration of NaOH). In order to determine the intestinal protease activity assay in juvenile Urechis unicinctus, the established regression equation of tyrosine was y = 15.487 x - 0.0923 (R2 = 0.999 2). The intestinal protease activity in juvenile Urechis unicinctus was (29.350 ± 2.592)U/mg prot. The intestinal amylase activity was (10.600±0.844)U/mg prot with 0.08% starch solution as substrate. The intestinal lipase activity was (5.266±0.224)U/mg prot.
Key words:Urechis unicinctus; intestinal tract; protease; amylase; lipase; determination method

