纸基—表面增强拉曼光谱法快速检测弱主药信号药品中的主药成分
李晓+陈梦云+王磊+张倩倩+方芳+苗丽+陆峰
摘 要 建立了弱主药信号药品中主药成分的纸基-表面增强拉曼光谱(SERS)快速检测方法。采用浸泡法制备纳米银溶胶滤纸SERS基底(简称银胶纸),将待检样品滴加于银胶纸上进行SERS检测。通过考察银胶纸制备条件、银胶纸增强能力、SERS检测结果,建立用于弱主药信号药品中主药成分的快速检测方法。通过本方法获得弱主药信号药品中主药成分的SERS图谱,与其对应标准品图谱的相关系数大于0.9,较好地检测出弱主药信号药品中的主药成分,有效克服了常规拉曼光谱分析的不足之处。新型银胶纸制备简单、增强效果明显,与SERS法结合可简便、快速、准确地实现对弱主药信号药品中主药信号的检测,在弱主药信号药品快检中具有广阔的应用前景。
关键词 银胶纸; 表面增强拉曼光谱; 弱主药信号药品; 相关系数
1 引 言
近年来,新药研发的大方向是高效低毒,因此药品中主药成分(API)的含量总体趋势是越来越低,即主药含量通常远低于辅料,主药基本被掩埋于辅料中。目前针对此类药品的检测基本上仍是停留在实验室分析中,如常用的高效液相色谱法[1]、液相色谱-质谱联用法[2]、光谱成像技术[3]等,但上述分析仪器庞大昂贵、操作复杂、专业技术要求高、分析耗时长,无法满足现场快检分析的需求。然而,当采用基于光谱法,如近红外光谱法[4,5]、拉曼光谱法[6,7]等快检分析时,主药成分信息通常被部分或全部掩盖于辅料的光谱信息中,呈现弱主药信号现象,导致假阴性、假阳性或无法判别的情况,从而给药品监督检验带来很大困难。
在常规拉曼光谱(NRS)基础上发展起来的表面增强拉曼光谱(SERS)能较好地弥补NRS的不足。SERS技术更可使NRS信号增强105倍以上,其基底[8]也是多种多样,尤其是纳米银溶胶滤纸(以下简称“银胶纸”),因其制备简单、携带方便等优势,结合SERS技术在环境样品分析[9]、中药材染色筛查[10,11]等领域得到了应用,但在弱主药信号药品研究中尚未见报道。
本研究以新型银胶纸作为SERS基底,以几种弱主药信号药品(阿司咪唑片、苯磺酸氨氯地平片、盐酸特拉唑嗪片、盐酸西替利嗪片)为研究对象,采用研磨、溶解、离心等操作提取主药成分后, 进行SERS检测。此类药品及其标准品NRS图谱相关系数小于0.2,而SERS图谱相关系数大于0.9,因此 SERS技术能较好地增强弱主药信号药品中的主药成分信号,且方法操作简单、高效快捷、精密度好,为当前盛行的小剂量、强药效、弱主药信号药品快检提供了有力支撑,从而较好地保障药品的质量安全。
2 实验部分
2.1 仪器与试剂
BWS415-785H型便携式拉曼光谱仪(美国B&W Tek 公司),激发波长785 nm,分辨率3 cm
1,光谱范围175 ~ 2700 cm;ALPHA型傅立叶变换红外光谱仪(Bruker 公司),光谱范围00~4000 cm
,分辨率4 cm1;电子天平(北京赛多利斯仪器系统有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);TG16-WS型高速离心机(上海卢湘仪离心机有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);扫描电子显微镜(德国Zeiss EVO MA-10 Carl-Zeiss公司)。
阿司咪唑、苯磺酸氨氯地平、盐酸特拉唑嗪、盐酸西替利嗪、对乙酰氨基酚标准品均购自中国食品药品检定研究院,批号分别为100301-199901, 100374-201204, 100375-201103, 100660-201102, 100018-200408;实验所用药品均购自市售药店。
AgNO3、N,N-二甲基甲酰胺(DMF)、聚乙烯吡咯烷酮(PVP)、甲醇等试剂均为分析纯(国药集团化学试剂有限公司);定量滤纸(杭州沃华滤纸有限公司);实验用水为二次蒸馏水。
2.2 溶液的配制
2.2.1 标准品溶液
分别准确称取阿司咪唑、苯磺酸氨氯地平、盐酸特拉唑嗪、盐酸西替利嗪标准品适量,加甲醇溶解,分别制成5 mg/mL的溶液,作为标准品溶液备用。
2.2.2 样品溶液 分别取阿司咪唑片(规格:3 mg)、苯磺酸氨氯地平片(5 mg)、盐酸特拉唑嗪片(2 mg)、盐酸西替利嗪片(10 mg)各1片,研碎,溶于1 mL甲醇中,超声30 min,离心取上清液,作为样品溶液备用。
2.3 银胶纸的制备
将5 mL AgNO3-PVP(0.02 mol/L AgNO3、 9 mg PVP)混合溶液加入至50 mL 沸腾的DMF中,继续加热一段时间后,倒入棕色瓶中,冷却备用。
将普通滤纸浸泡于上述银溶胶中,避光放置 22 h后取出,吹干,将上述滤纸裁剪成1 cm×1 cm方形备用。
2.4 SERS检测
取上述样品溶液与标准品溶液各10 μL,分别滴加于银胶纸上,滴加区立即进行检测,激光功率为180 mW,积分时间为15 s,得到各自的SERS图谱并进行比对。
2.5 数据处理
利用Matlab2013a对光谱数据进行谱段选取(300~1800 cm1)、基线校正、平滑滤噪,矢量归一化等预处理后,采用统计学方法计算相关系数,如公式 (1) 所示。采用Origin 8.0 软件对最终结果进行绘图。
R=ni=1(Xi·Yi)ni=1X2i·ni=1Y2i(1)
式中,X和Y分别代表样品与标准品光谱数据,i代表每条光谱的第i个变量,n为该条光谱变量总数。
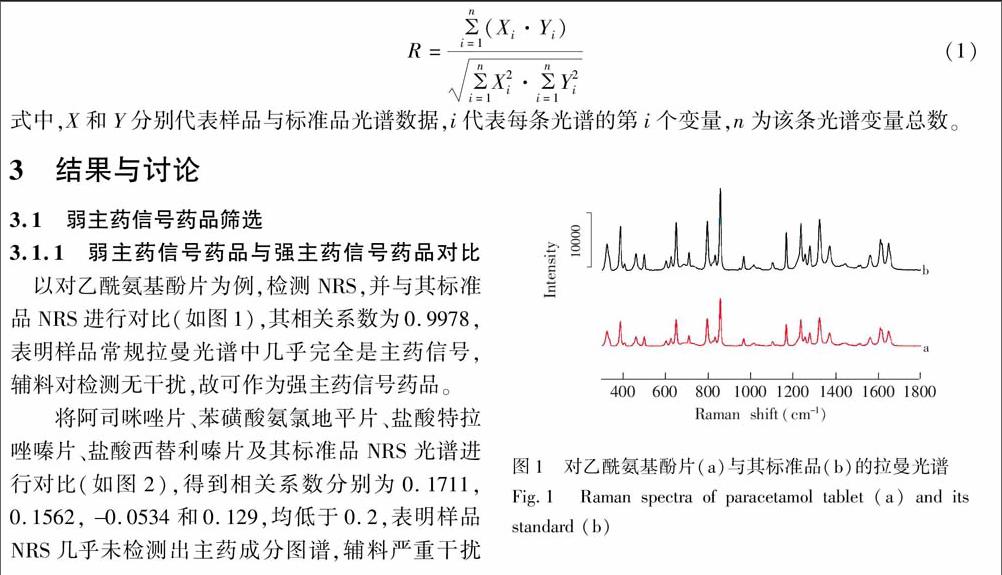
图1 对乙酰氨基酚片(a)与其标准品(b)的拉曼光谱
Fig.1 Raman spectra of paracetamol tablet (a) and its standard (b)
3 结果与讨论
3.1 弱主药信号药品筛选
3.1.1 弱主药信号药品与强主药信号药品对比
以对乙酰氨基酚片为例,检测NRS,并与其标准品NRS进行对比(如图1),其相关系数为0.9978,表明样品常规拉曼光谱中几乎完全是主药信号,辅料对检测无干扰,故可作为强主药信号药品。
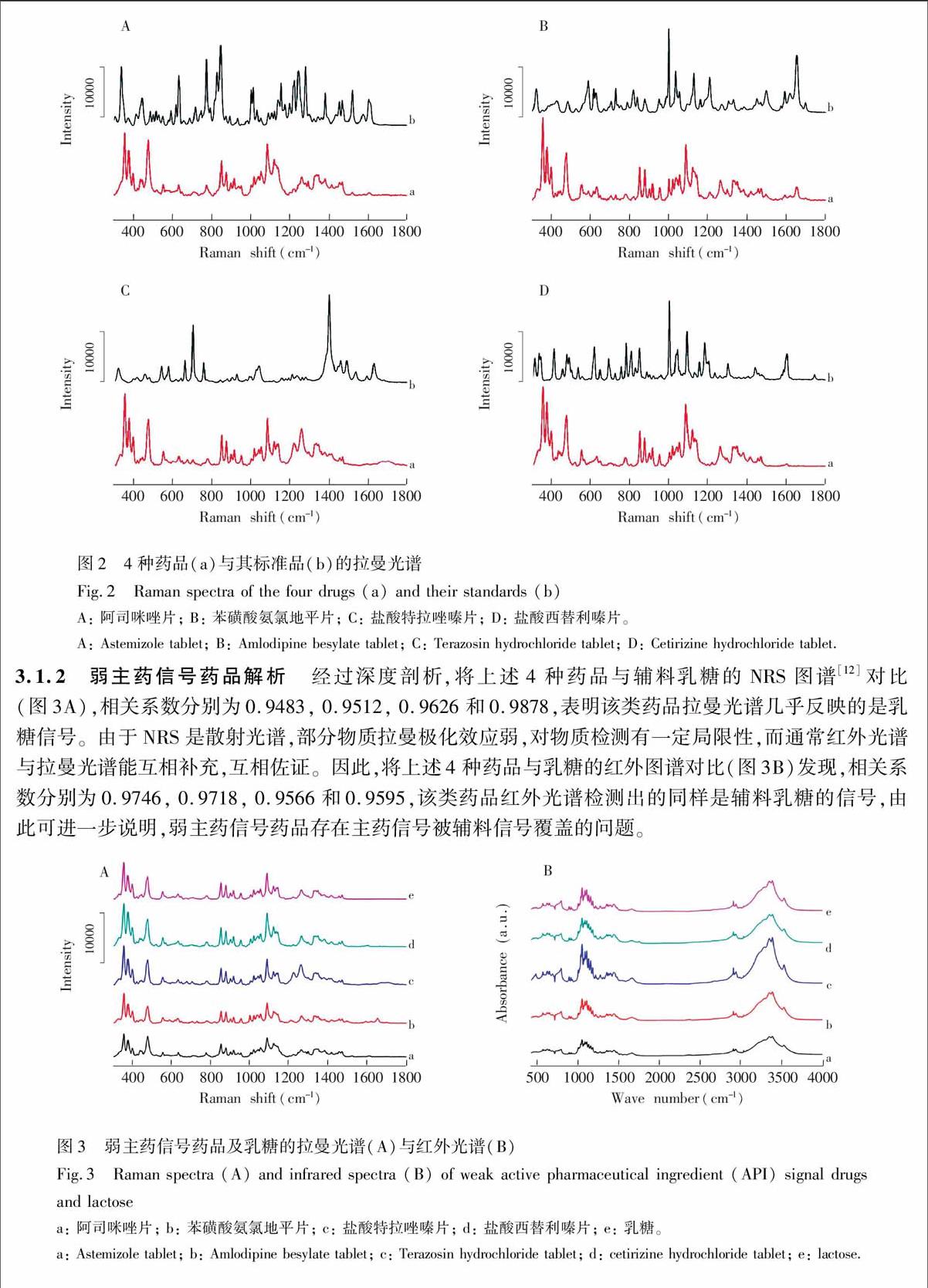
将阿司咪唑片、苯磺酸氨氯地平片、盐酸特拉唑嗪片、盐酸西替利嗪片及其标准品NRS光谱进行对比(如图2),得到相关系数分别为0.1711, 0.1562,
0.0534和0.129,均低于0.2,表明样品NRS几乎未检测出主药成分图谱,辅料严重干扰检测,由此可见,此类药品的检测难度远大于强主药信号药品。一般情况下,NRS无法达到对此类弱主药信号药品快速检测的目的。
图2 4种药品(a)与其标准品(b)的拉曼光谱
Fig.2 Raman spectra of the four drugs (a) and their standards (b)
A: 阿司咪唑片; B: 苯磺酸氨氯地平片; C: 盐酸特拉唑嗪片; D: 盐酸西替利嗪片。
A: Astemizole tablet; B: Amlodipine besylate tablet; C: Terazosin hydrochloride tablet; D: Cetirizine hydrochloride tablet.
3.1.2 弱主药信号药品解析 经过深度剖析,将上述4种药品与辅料乳糖的NRS图谱[12]对比(图3A),相关系数分别为0.9483, 0.9512, 0.9626和0.9878,表明该类药品拉曼光谱几乎反映的是乳糖信号。由于NRS是散射光谱,部分物质拉曼极化效应弱,对物质检测有一定局限性,而通常红外光谱与拉曼光谱能互相补充,互相佐证。因此,将上述4种药品与乳糖的红外图谱对比(图3B)发现,相关系数分别为0.9746, 0.9718, 0.9566和0.9595,该类药品红外光谱检测出的同样是辅料乳糖的信号,由此可进一步说明,弱主药信号药品存在主药信号被辅料信号覆盖的问题。
图3 弱主药信号药品及乳糖的拉曼光谱(A)与红外光谱(B)
Fig.3 Raman spectra (A) and infrared spectra (B) of weak active pharmaceutical ingredient (API) signal drugs and lactose
a: 阿司咪唑片; b: 苯磺酸氨氯地平片; c: 盐酸特拉唑嗪片; d: 盐酸西替利嗪片; e: 乳糖。
a: Astemizole tablet; b: Amlodipine besylate tablet; c: Terazosin hydrochloride tablet; d: cetirizine hydrochloride tablet; e: lactose.
3.2 银胶纸制备条件优化
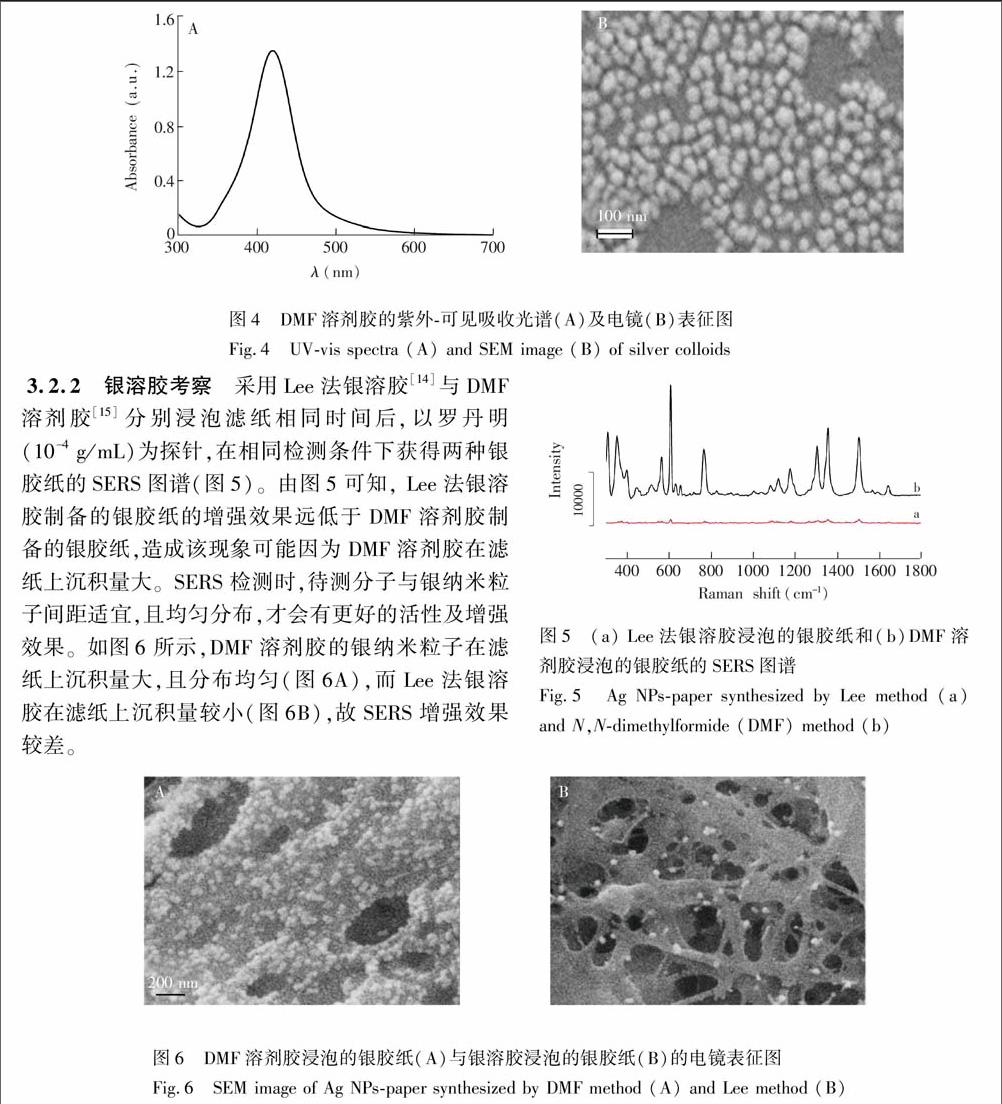
3.2.1 银溶胶表征 DMF溶剂胶的紫外吸收光谱如图4A。其最大吸收峰在420 nm处,呈单峰且半峰宽较窄,表明此峰为银纳米粒子的等离子共振吸收峰,呈球形均匀分布。扫描电镜结果(图4B)也证明其呈球形均匀分布,且银纳米粒子直径约为50 nm [13]。
图4 DMF溶剂胶的紫外-可见吸收光谱(A)及电镜(B)表征图
Fig.4 UV-vis spectra (A) and SEM image (B) of silver colloids
图5 (a) Lee法银溶胶浸泡的银胶纸和(b)DMF溶剂胶浸泡的银胶纸的SERS图谱
Fig.5 Ag NPs-paper synthesized by Lee method (a) and N,N-dimethylformide (DMF) method (b)
3.2.2 银溶胶考察 采用Lee法银溶胶[14]与DMF溶剂胶[15]分别浸泡滤纸相同时间后,以罗丹明(10
4 g/mL)为探针,在相同检测条件下获得两种银胶纸的SERS图谱(图5)。由图5可知, Lee法银溶胶制备的银胶纸的增强效果远低于DMF溶剂胶制备的银胶纸,造成该现象可能因为DMF溶剂胶在滤纸上沉积量大。SERS检测时,待测分子与银纳米粒子间距适宜,且均匀分布,才会有更好的活性及增强效果。如图6所示,DMF溶剂胶的银纳米粒子在滤纸上沉积量大,且分布均匀(图6A),而Lee法银溶胶在滤纸上沉积量较小(图6B),故SERS增强效果较差。
图6 DMF溶剂胶浸泡的银胶纸(A)与银溶胶浸泡的银胶纸(B)的电镜表征图
Fig.6 SEM image of Ag NPs-paper synthesized by DMF method (A) and Lee method (B)
3.2.3 浸泡时间考察 DMF胶浸泡滤纸得到的银胶纸呈棕色,随着浸泡时间延长,银胶纸颜色加深,而其增强能力也发生相应变化,本实验以罗丹明 (10
g/mL)为探针,考察不同浸泡时间(2, 7, 12, 17, 22, 27和32 h)胶纸的增强能力(图7A)。选取612 cm
处峰为特征峰,将3次制备的银胶纸分别进行检测,以3次峰强的平均值作图(图7B),当浸泡时间超过27 h后,增强效果较之前有大幅降低,其原因可能是长期暴露于空气中的银溶胶发生了氧化或团聚,而22 h时增强效果最佳。考虑到银胶纸的增强能力与颜色加深易被激光破坏的特点,最终选择22 h为最优浸泡时间。
图7 银胶纸不同浸泡时间的增强效果(A)及其散点图(B)
Fig.7 The enhanced intensity of Ag NPs-paper at different soaking time (A) and its scatterplot (B)
3.3 银胶纸增强能力考察
3.3.1 银胶纸与滤纸检测结果比较 以盐酸西替利嗪片为例,将样品溶液直接滴加于滤纸上进行拉曼检测(图8A),所得拉曼图谱中只有滤纸背景信号, 而无样品信息。将样品溶液直接滴加于银胶纸上进行SERS检测(图8B)时,SERS图谱中样品信息得到充分体现。将滤纸与银胶纸的背景信号比较,滤纸制备成银胶纸后,其本身的信号减少减弱,对样品检测的干扰也变小。
图8 普通滤纸(A)与银胶纸(B)的增强能力
Fig.8 The enhanced intensity of filter paper (A) and Ag NPs-paper (B)
a. 背景信号; b. 样品信号。
a: Background; b: Sample signal.
图9 滤纸与银溶胶不同混合方式的增强效果
Fig.9 Intensity of different mixed pattern of paper and Ag NPs-solution
a. 银溶胶背景信号; b. 方法三; c. 方法二; d. 方法一。
a: Background signal of Ag NPs, b: method 3, c: method 2, d: method 1.
3.3.2 银溶胶不同加入方式比较 比较银溶胶加入方式对检测的影响,方法一是将滤纸浸泡于银溶胶中制备银胶纸,再于银胶纸上滴加样品溶液进行SERS检测; 方法二是在滤纸上先滴加银溶胶, 再滴加样品溶液进行SERS检测; 方法三是在滤纸上先滴加样品溶液, 再滴加银溶胶进行SERS检测。
以盐酸西替利嗪片为例,3种方式所检测的结果如图9所示,结果表明,按方法一操作时,立即可检测到样品信号, 而无银溶胶信息干扰; 但以方法二和方法三操作时,检测多张图谱后, 只有银溶胶信号, 而无样品信号,可能是在这两种方法中仅通过滴加银溶胶,在滤纸上沉积的银纳米粒子远低于银胶纸上沉积的银纳米粒子数,待测物分子很难与银纳米粒子结合成有活性的分子以被检测。在银溶胶制备过程中, DMF作为溶剂与还原剂,使得银溶胶有DMF溶剂背景信号存在。然而,方法一中的银胶纸通过浸泡后烘干,同时使DMF溶剂挥发,与方法二和方法三中银溶胶的简单滴加而存在的DMF溶剂信号相比,方法一中以银胶纸检测样品时,无银溶胶背景峰的干扰。
3.4 SERS检测结果
3.4.1 SERS图谱的匹配 通过优化点样量与激光功率,选取点样量10 μL,激光功率180 mW,将滴加于银胶纸上的样品溶液与标准品溶液立即检测,得各自SERS图谱(图10),并计算其相关系数,分别为0.9402, 0.9488, 0.9551和 0.9704。可知弱主药信号药品经过简单的研磨、溶解、离心,排除了辅料干扰,使主药信号得以分离,达到鉴别真伪的目的。
图10 4种弱主药信号药品的NRS谱(a标准品)与SERS谱(b样品、c标准品)
Fig.10 Raman spectra (a: standard) and surface enhanced Raman scattering (SERS) spectra (b: sample, c: standard) of four weak API signal drugs
A: 阿司咪唑片; B: 苯磺酸氨氯地平片; C: 盐酸特拉唑嗪片; D: 盐酸西替利嗪片。
A: Astemizole tablet; B: Amlodipine besylate tablet; C: Terazosin hydrochloride tablet; D: Cetirizine hydrochloride tablet.
SERS技术用于检测弱主药信号药品具有高灵敏性,此外为了进一步验证,对二者检测的特征峰进行比对,结果如表1所示。通常SERS位移容差范围在3个波数内(≤3 cm
可视为同一个峰[16],上述4种药品与其标准品的SERS图谱特征峰匹配度极高,可知SERS技术具有很强的专属性。同时,经过分离提取后, 弱主药信号药品SERS峰与其标准品NRS特征峰匹配度也很好。
3.4.2 SERS方法精密度考察 为验证所用方法的可靠性,以盐酸西替利嗪片为例,对其样品与标准品平均检测6次,并计算两者相关系数分别为0.9598, 0.9773, 0.9868, 0.9568, 0.9398和0.9425,以相关系数差异大小为指标,考察方法的精密度。结果表明, 其RSD为1.9%,能满足分析要求[17],且本方法获得的SERS图谱的重复性和重现性良好,亦达到常规分析要求。
综上所述,本研究制备的新型银胶纸可有效实现纸基-SERS法对弱主药信号药品中主药成分的快速检测,其中银胶纸制备简单、携带方便、增强能力强,同时SERS图谱专属性强、准确性高,为药品监管部门检测此类药品提供有力保障,同时为此类药品厂家在生产过程中质量控制奠定良好基础,可见纸基-SERS法在药品快检中对弱主药信号药品检测具有广阔的应用前景。
References
1 XU Qi, MIAO Gang, GU Bing-Ren. Chinese Journal of Modern Drug Application, 2010, 4(9): 1-2
许 奇, 缪 刚, 顾炳仁. 中国现代药物应用, 2010, 4(9): 1-2
2 SHENGuo-Fang, LI Jiong, QIU Yi-Jing, ZHU Jian. J. Pharm. Anal., 2014, 31(1): 146-150
沈国芳, 励 炯, 裘一婧, 朱 健. 药物分析杂志, 2014, 31(1): 146-150
3 Henson M J, Zhang L. Appl Spectrosc., 2006, 60(11): 1247-1255
4 ZHANG Xue-Bo, MA Jin-Jin, CAO Li-Mei. Chinese Journal of Spectroscopy Laboratory, 2013, 4(30): 2010-2015
张学博, 马金金, 曹丽梅, 光谱实验室, 2013, 4(30): 2010-2015
5 Alcal M, León J, Ropero J, Blanco M, Romaach R J. J. Pharmac. Sci., 2008, 97(12): 5318-5327
6 Zhao Y, Ji N, Yin L H, Wang J. AAPS Pharm. Sci. Tech., 2015, 4(16): 914-921
7 Li L, ZANG H C, Li J, Chen D J, Li T, Wang F S. Spectrochim. Acta A, 2014, 6 (127): 91-97
8 Zhang R, Xu B B, Liu X Q, Zhang Y L, Xu Y, Chen Q D, Sun H B. Chem. Commun (Camb)., 2012, 48(47): 5913-5915
9 Halvorson R A, Vikesland P J. Environ. Sci. Technol., 2010, 44(20): 7749-7755
10 LI Dan, WANG Bing, LI Xiao, ZHANG Zhong-Hu, GONG Li-Ping, LU Feng, CHU Ke-Dan. Journal of Pharmaceutical Research, 2015, 34(4): 202-205
李 丹, 汪 冰, 李 晓, 张中湖, 巩丽萍, 陆 峰, 褚克丹. 药学研究, 2015, 34(4): 202-205
11 QU Gan, ZHANG Guan-Nan, SU Yan, XU Hui-Chun, ZHOU Xiao-Dong, SHEN Ai-Guo, HU Ji-Ming. Chinese J. Anal. Chem., 2014, 42(7): 1022-1027
曲 干, 张冠男, 苏 艳, 徐回春, 周晓东, 沈爱国, 胡继明. 分析化学, 2014, 42(7): 1022-1027
12 de Veij M, Vandenabeele P, de Beer T, Thomas Remon, Jean Paul Moens, Luc. J. Raman Spectros., 2009, 40(3): 297-307
13 LI Xiao-Ling, JIA Hui-Ying, XU Wei-Qing, ZHANG Jun-Hu, ZHAO Bing. Journal of Light Scatting, 2004, 16(1): 27-30
李小灵, 贾慧颖, 徐蔚青, 张俊虎, 赵 冰. 光散射学报, 2004, 16(1): 27-30
14 Lee P C, Meisel D. J. Phy. Chem., 1982, 86(17): 3391-3395
15 QIN Jian-Hong. Journal of Pharmaceutical Practice, 2014, 32(3): 206-230
秦剑红. 药学实践杂志, 2014, 32(3): 206-230
16 Athalin H, Lefrant S. J. Raman Spectros., 2005, 36(5): 400-408
17 YANG Xin, WANG Jun, MIAO Hong, ZHOU Ping-Ping. Journal of Food Safety and Quality, 2014, 5(10): 3219-3222
杨 欣, 王 军, 苗 虹, 周萍萍. 食品安全质量检测学报, 2014, 5(10): 3219-3222



摘 要 建立了弱主药信号药品中主药成分的纸基-表面增强拉曼光谱(SERS)快速检测方法。采用浸泡法制备纳米银溶胶滤纸SERS基底(简称银胶纸),将待检样品滴加于银胶纸上进行SERS检测。通过考察银胶纸制备条件、银胶纸增强能力、SERS检测结果,建立用于弱主药信号药品中主药成分的快速检测方法。通过本方法获得弱主药信号药品中主药成分的SERS图谱,与其对应标准品图谱的相关系数大于0.9,较好地检测出弱主药信号药品中的主药成分,有效克服了常规拉曼光谱分析的不足之处。新型银胶纸制备简单、增强效果明显,与SERS法结合可简便、快速、准确地实现对弱主药信号药品中主药信号的检测,在弱主药信号药品快检中具有广阔的应用前景。
关键词 银胶纸; 表面增强拉曼光谱; 弱主药信号药品; 相关系数
1 引 言
近年来,新药研发的大方向是高效低毒,因此药品中主药成分(API)的含量总体趋势是越来越低,即主药含量通常远低于辅料,主药基本被掩埋于辅料中。目前针对此类药品的检测基本上仍是停留在实验室分析中,如常用的高效液相色谱法[1]、液相色谱-质谱联用法[2]、光谱成像技术[3]等,但上述分析仪器庞大昂贵、操作复杂、专业技术要求高、分析耗时长,无法满足现场快检分析的需求。然而,当采用基于光谱法,如近红外光谱法[4,5]、拉曼光谱法[6,7]等快检分析时,主药成分信息通常被部分或全部掩盖于辅料的光谱信息中,呈现弱主药信号现象,导致假阴性、假阳性或无法判别的情况,从而给药品监督检验带来很大困难。
在常规拉曼光谱(NRS)基础上发展起来的表面增强拉曼光谱(SERS)能较好地弥补NRS的不足。SERS技术更可使NRS信号增强105倍以上,其基底[8]也是多种多样,尤其是纳米银溶胶滤纸(以下简称“银胶纸”),因其制备简单、携带方便等优势,结合SERS技术在环境样品分析[9]、中药材染色筛查[10,11]等领域得到了应用,但在弱主药信号药品研究中尚未见报道。
本研究以新型银胶纸作为SERS基底,以几种弱主药信号药品(阿司咪唑片、苯磺酸氨氯地平片、盐酸特拉唑嗪片、盐酸西替利嗪片)为研究对象,采用研磨、溶解、离心等操作提取主药成分后, 进行SERS检测。此类药品及其标准品NRS图谱相关系数小于0.2,而SERS图谱相关系数大于0.9,因此 SERS技术能较好地增强弱主药信号药品中的主药成分信号,且方法操作简单、高效快捷、精密度好,为当前盛行的小剂量、强药效、弱主药信号药品快检提供了有力支撑,从而较好地保障药品的质量安全。
2 实验部分
2.1 仪器与试剂
BWS415-785H型便携式拉曼光谱仪(美国B&W Tek 公司),激发波长785 nm,分辨率3 cm
1,光谱范围175 ~ 2700 cm;ALPHA型傅立叶变换红外光谱仪(Bruker 公司),光谱范围00~4000 cm
,分辨率4 cm1;电子天平(北京赛多利斯仪器系统有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);TG16-WS型高速离心机(上海卢湘仪离心机有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);扫描电子显微镜(德国Zeiss EVO MA-10 Carl-Zeiss公司)。
阿司咪唑、苯磺酸氨氯地平、盐酸特拉唑嗪、盐酸西替利嗪、对乙酰氨基酚标准品均购自中国食品药品检定研究院,批号分别为100301-199901, 100374-201204, 100375-201103, 100660-201102, 100018-200408;实验所用药品均购自市售药店。
AgNO3、N,N-二甲基甲酰胺(DMF)、聚乙烯吡咯烷酮(PVP)、甲醇等试剂均为分析纯(国药集团化学试剂有限公司);定量滤纸(杭州沃华滤纸有限公司);实验用水为二次蒸馏水。
2.2 溶液的配制
2.2.1 标准品溶液
分别准确称取阿司咪唑、苯磺酸氨氯地平、盐酸特拉唑嗪、盐酸西替利嗪标准品适量,加甲醇溶解,分别制成5 mg/mL的溶液,作为标准品溶液备用。
2.2.2 样品溶液 分别取阿司咪唑片(规格:3 mg)、苯磺酸氨氯地平片(5 mg)、盐酸特拉唑嗪片(2 mg)、盐酸西替利嗪片(10 mg)各1片,研碎,溶于1 mL甲醇中,超声30 min,离心取上清液,作为样品溶液备用。
2.3 银胶纸的制备
将5 mL AgNO3-PVP(0.02 mol/L AgNO3、 9 mg PVP)混合溶液加入至50 mL 沸腾的DMF中,继续加热一段时间后,倒入棕色瓶中,冷却备用。
将普通滤纸浸泡于上述银溶胶中,避光放置 22 h后取出,吹干,将上述滤纸裁剪成1 cm×1 cm方形备用。
2.4 SERS检测
取上述样品溶液与标准品溶液各10 μL,分别滴加于银胶纸上,滴加区立即进行检测,激光功率为180 mW,积分时间为15 s,得到各自的SERS图谱并进行比对。
2.5 数据处理
利用Matlab2013a对光谱数据进行谱段选取(300~1800 cm1)、基线校正、平滑滤噪,矢量归一化等预处理后,采用统计学方法计算相关系数,如公式 (1) 所示。采用Origin 8.0 软件对最终结果进行绘图。
R=ni=1(Xi·Yi)ni=1X2i·ni=1Y2i(1)
式中,X和Y分别代表样品与标准品光谱数据,i代表每条光谱的第i个变量,n为该条光谱变量总数。
图1 对乙酰氨基酚片(a)与其标准品(b)的拉曼光谱
Fig.1 Raman spectra of paracetamol tablet (a) and its standard (b)
3 结果与讨论
3.1 弱主药信号药品筛选
3.1.1 弱主药信号药品与强主药信号药品对比
以对乙酰氨基酚片为例,检测NRS,并与其标准品NRS进行对比(如图1),其相关系数为0.9978,表明样品常规拉曼光谱中几乎完全是主药信号,辅料对检测无干扰,故可作为强主药信号药品。
将阿司咪唑片、苯磺酸氨氯地平片、盐酸特拉唑嗪片、盐酸西替利嗪片及其标准品NRS光谱进行对比(如图2),得到相关系数分别为0.1711, 0.1562,
0.0534和0.129,均低于0.2,表明样品NRS几乎未检测出主药成分图谱,辅料严重干扰检测,由此可见,此类药品的检测难度远大于强主药信号药品。一般情况下,NRS无法达到对此类弱主药信号药品快速检测的目的。
图2 4种药品(a)与其标准品(b)的拉曼光谱
Fig.2 Raman spectra of the four drugs (a) and their standards (b)
A: 阿司咪唑片; B: 苯磺酸氨氯地平片; C: 盐酸特拉唑嗪片; D: 盐酸西替利嗪片。
A: Astemizole tablet; B: Amlodipine besylate tablet; C: Terazosin hydrochloride tablet; D: Cetirizine hydrochloride tablet.
3.1.2 弱主药信号药品解析 经过深度剖析,将上述4种药品与辅料乳糖的NRS图谱[12]对比(图3A),相关系数分别为0.9483, 0.9512, 0.9626和0.9878,表明该类药品拉曼光谱几乎反映的是乳糖信号。由于NRS是散射光谱,部分物质拉曼极化效应弱,对物质检测有一定局限性,而通常红外光谱与拉曼光谱能互相补充,互相佐证。因此,将上述4种药品与乳糖的红外图谱对比(图3B)发现,相关系数分别为0.9746, 0.9718, 0.9566和0.9595,该类药品红外光谱检测出的同样是辅料乳糖的信号,由此可进一步说明,弱主药信号药品存在主药信号被辅料信号覆盖的问题。
图3 弱主药信号药品及乳糖的拉曼光谱(A)与红外光谱(B)
Fig.3 Raman spectra (A) and infrared spectra (B) of weak active pharmaceutical ingredient (API) signal drugs and lactose
a: 阿司咪唑片; b: 苯磺酸氨氯地平片; c: 盐酸特拉唑嗪片; d: 盐酸西替利嗪片; e: 乳糖。
a: Astemizole tablet; b: Amlodipine besylate tablet; c: Terazosin hydrochloride tablet; d: cetirizine hydrochloride tablet; e: lactose.
3.2 银胶纸制备条件优化
3.2.1 银溶胶表征 DMF溶剂胶的紫外吸收光谱如图4A。其最大吸收峰在420 nm处,呈单峰且半峰宽较窄,表明此峰为银纳米粒子的等离子共振吸收峰,呈球形均匀分布。扫描电镜结果(图4B)也证明其呈球形均匀分布,且银纳米粒子直径约为50 nm [13]。
图4 DMF溶剂胶的紫外-可见吸收光谱(A)及电镜(B)表征图
Fig.4 UV-vis spectra (A) and SEM image (B) of silver colloids
图5 (a) Lee法银溶胶浸泡的银胶纸和(b)DMF溶剂胶浸泡的银胶纸的SERS图谱
Fig.5 Ag NPs-paper synthesized by Lee method (a) and N,N-dimethylformide (DMF) method (b)
3.2.2 银溶胶考察 采用Lee法银溶胶[14]与DMF溶剂胶[15]分别浸泡滤纸相同时间后,以罗丹明(10
4 g/mL)为探针,在相同检测条件下获得两种银胶纸的SERS图谱(图5)。由图5可知, Lee法银溶胶制备的银胶纸的增强效果远低于DMF溶剂胶制备的银胶纸,造成该现象可能因为DMF溶剂胶在滤纸上沉积量大。SERS检测时,待测分子与银纳米粒子间距适宜,且均匀分布,才会有更好的活性及增强效果。如图6所示,DMF溶剂胶的银纳米粒子在滤纸上沉积量大,且分布均匀(图6A),而Lee法银溶胶在滤纸上沉积量较小(图6B),故SERS增强效果较差。
图6 DMF溶剂胶浸泡的银胶纸(A)与银溶胶浸泡的银胶纸(B)的电镜表征图
Fig.6 SEM image of Ag NPs-paper synthesized by DMF method (A) and Lee method (B)
3.2.3 浸泡时间考察 DMF胶浸泡滤纸得到的银胶纸呈棕色,随着浸泡时间延长,银胶纸颜色加深,而其增强能力也发生相应变化,本实验以罗丹明 (10
g/mL)为探针,考察不同浸泡时间(2, 7, 12, 17, 22, 27和32 h)胶纸的增强能力(图7A)。选取612 cm
处峰为特征峰,将3次制备的银胶纸分别进行检测,以3次峰强的平均值作图(图7B),当浸泡时间超过27 h后,增强效果较之前有大幅降低,其原因可能是长期暴露于空气中的银溶胶发生了氧化或团聚,而22 h时增强效果最佳。考虑到银胶纸的增强能力与颜色加深易被激光破坏的特点,最终选择22 h为最优浸泡时间。
图7 银胶纸不同浸泡时间的增强效果(A)及其散点图(B)
Fig.7 The enhanced intensity of Ag NPs-paper at different soaking time (A) and its scatterplot (B)
3.3 银胶纸增强能力考察
3.3.1 银胶纸与滤纸检测结果比较 以盐酸西替利嗪片为例,将样品溶液直接滴加于滤纸上进行拉曼检测(图8A),所得拉曼图谱中只有滤纸背景信号, 而无样品信息。将样品溶液直接滴加于银胶纸上进行SERS检测(图8B)时,SERS图谱中样品信息得到充分体现。将滤纸与银胶纸的背景信号比较,滤纸制备成银胶纸后,其本身的信号减少减弱,对样品检测的干扰也变小。
图8 普通滤纸(A)与银胶纸(B)的增强能力
Fig.8 The enhanced intensity of filter paper (A) and Ag NPs-paper (B)
a. 背景信号; b. 样品信号。
a: Background; b: Sample signal.
图9 滤纸与银溶胶不同混合方式的增强效果
Fig.9 Intensity of different mixed pattern of paper and Ag NPs-solution
a. 银溶胶背景信号; b. 方法三; c. 方法二; d. 方法一。
a: Background signal of Ag NPs, b: method 3, c: method 2, d: method 1.
3.3.2 银溶胶不同加入方式比较 比较银溶胶加入方式对检测的影响,方法一是将滤纸浸泡于银溶胶中制备银胶纸,再于银胶纸上滴加样品溶液进行SERS检测; 方法二是在滤纸上先滴加银溶胶, 再滴加样品溶液进行SERS检测; 方法三是在滤纸上先滴加样品溶液, 再滴加银溶胶进行SERS检测。
以盐酸西替利嗪片为例,3种方式所检测的结果如图9所示,结果表明,按方法一操作时,立即可检测到样品信号, 而无银溶胶信息干扰; 但以方法二和方法三操作时,检测多张图谱后, 只有银溶胶信号, 而无样品信号,可能是在这两种方法中仅通过滴加银溶胶,在滤纸上沉积的银纳米粒子远低于银胶纸上沉积的银纳米粒子数,待测物分子很难与银纳米粒子结合成有活性的分子以被检测。在银溶胶制备过程中, DMF作为溶剂与还原剂,使得银溶胶有DMF溶剂背景信号存在。然而,方法一中的银胶纸通过浸泡后烘干,同时使DMF溶剂挥发,与方法二和方法三中银溶胶的简单滴加而存在的DMF溶剂信号相比,方法一中以银胶纸检测样品时,无银溶胶背景峰的干扰。
3.4 SERS检测结果
3.4.1 SERS图谱的匹配 通过优化点样量与激光功率,选取点样量10 μL,激光功率180 mW,将滴加于银胶纸上的样品溶液与标准品溶液立即检测,得各自SERS图谱(图10),并计算其相关系数,分别为0.9402, 0.9488, 0.9551和 0.9704。可知弱主药信号药品经过简单的研磨、溶解、离心,排除了辅料干扰,使主药信号得以分离,达到鉴别真伪的目的。
图10 4种弱主药信号药品的NRS谱(a标准品)与SERS谱(b样品、c标准品)
Fig.10 Raman spectra (a: standard) and surface enhanced Raman scattering (SERS) spectra (b: sample, c: standard) of four weak API signal drugs
A: 阿司咪唑片; B: 苯磺酸氨氯地平片; C: 盐酸特拉唑嗪片; D: 盐酸西替利嗪片。
A: Astemizole tablet; B: Amlodipine besylate tablet; C: Terazosin hydrochloride tablet; D: Cetirizine hydrochloride tablet.
SERS技术用于检测弱主药信号药品具有高灵敏性,此外为了进一步验证,对二者检测的特征峰进行比对,结果如表1所示。通常SERS位移容差范围在3个波数内(≤3 cm
可视为同一个峰[16],上述4种药品与其标准品的SERS图谱特征峰匹配度极高,可知SERS技术具有很强的专属性。同时,经过分离提取后, 弱主药信号药品SERS峰与其标准品NRS特征峰匹配度也很好。
3.4.2 SERS方法精密度考察 为验证所用方法的可靠性,以盐酸西替利嗪片为例,对其样品与标准品平均检测6次,并计算两者相关系数分别为0.9598, 0.9773, 0.9868, 0.9568, 0.9398和0.9425,以相关系数差异大小为指标,考察方法的精密度。结果表明, 其RSD为1.9%,能满足分析要求[17],且本方法获得的SERS图谱的重复性和重现性良好,亦达到常规分析要求。
综上所述,本研究制备的新型银胶纸可有效实现纸基-SERS法对弱主药信号药品中主药成分的快速检测,其中银胶纸制备简单、携带方便、增强能力强,同时SERS图谱专属性强、准确性高,为药品监管部门检测此类药品提供有力保障,同时为此类药品厂家在生产过程中质量控制奠定良好基础,可见纸基-SERS法在药品快检中对弱主药信号药品检测具有广阔的应用前景。
References
1 XU Qi, MIAO Gang, GU Bing-Ren. Chinese Journal of Modern Drug Application, 2010, 4(9): 1-2
许 奇, 缪 刚, 顾炳仁. 中国现代药物应用, 2010, 4(9): 1-2
2 SHENGuo-Fang, LI Jiong, QIU Yi-Jing, ZHU Jian. J. Pharm. Anal., 2014, 31(1): 146-150
沈国芳, 励 炯, 裘一婧, 朱 健. 药物分析杂志, 2014, 31(1): 146-150
3 Henson M J, Zhang L. Appl Spectrosc., 2006, 60(11): 1247-1255
4 ZHANG Xue-Bo, MA Jin-Jin, CAO Li-Mei. Chinese Journal of Spectroscopy Laboratory, 2013, 4(30): 2010-2015
张学博, 马金金, 曹丽梅, 光谱实验室, 2013, 4(30): 2010-2015
5 Alcal M, León J, Ropero J, Blanco M, Romaach R J. J. Pharmac. Sci., 2008, 97(12): 5318-5327
6 Zhao Y, Ji N, Yin L H, Wang J. AAPS Pharm. Sci. Tech., 2015, 4(16): 914-921
7 Li L, ZANG H C, Li J, Chen D J, Li T, Wang F S. Spectrochim. Acta A, 2014, 6 (127): 91-97
8 Zhang R, Xu B B, Liu X Q, Zhang Y L, Xu Y, Chen Q D, Sun H B. Chem. Commun (Camb)., 2012, 48(47): 5913-5915
9 Halvorson R A, Vikesland P J. Environ. Sci. Technol., 2010, 44(20): 7749-7755
10 LI Dan, WANG Bing, LI Xiao, ZHANG Zhong-Hu, GONG Li-Ping, LU Feng, CHU Ke-Dan. Journal of Pharmaceutical Research, 2015, 34(4): 202-205
李 丹, 汪 冰, 李 晓, 张中湖, 巩丽萍, 陆 峰, 褚克丹. 药学研究, 2015, 34(4): 202-205
11 QU Gan, ZHANG Guan-Nan, SU Yan, XU Hui-Chun, ZHOU Xiao-Dong, SHEN Ai-Guo, HU Ji-Ming. Chinese J. Anal. Chem., 2014, 42(7): 1022-1027
曲 干, 张冠男, 苏 艳, 徐回春, 周晓东, 沈爱国, 胡继明. 分析化学, 2014, 42(7): 1022-1027
12 de Veij M, Vandenabeele P, de Beer T, Thomas Remon, Jean Paul Moens, Luc. J. Raman Spectros., 2009, 40(3): 297-307
13 LI Xiao-Ling, JIA Hui-Ying, XU Wei-Qing, ZHANG Jun-Hu, ZHAO Bing. Journal of Light Scatting, 2004, 16(1): 27-30
李小灵, 贾慧颖, 徐蔚青, 张俊虎, 赵 冰. 光散射学报, 2004, 16(1): 27-30
14 Lee P C, Meisel D. J. Phy. Chem., 1982, 86(17): 3391-3395
15 QIN Jian-Hong. Journal of Pharmaceutical Practice, 2014, 32(3): 206-230
秦剑红. 药学实践杂志, 2014, 32(3): 206-230
16 Athalin H, Lefrant S. J. Raman Spectros., 2005, 36(5): 400-408
17 YANG Xin, WANG Jun, MIAO Hong, ZHOU Ping-Ping. Journal of Food Safety and Quality, 2014, 5(10): 3219-3222
杨 欣, 王 军, 苗 虹, 周萍萍. 食品安全质量检测学报, 2014, 5(10): 3219-3222

