乙酸胁迫酵母细胞凋亡过程中单个线粒体损伤的拉曼光谱分析
李冰+卢明倩+王巧贞+石贵玉+廖威+黄庶识
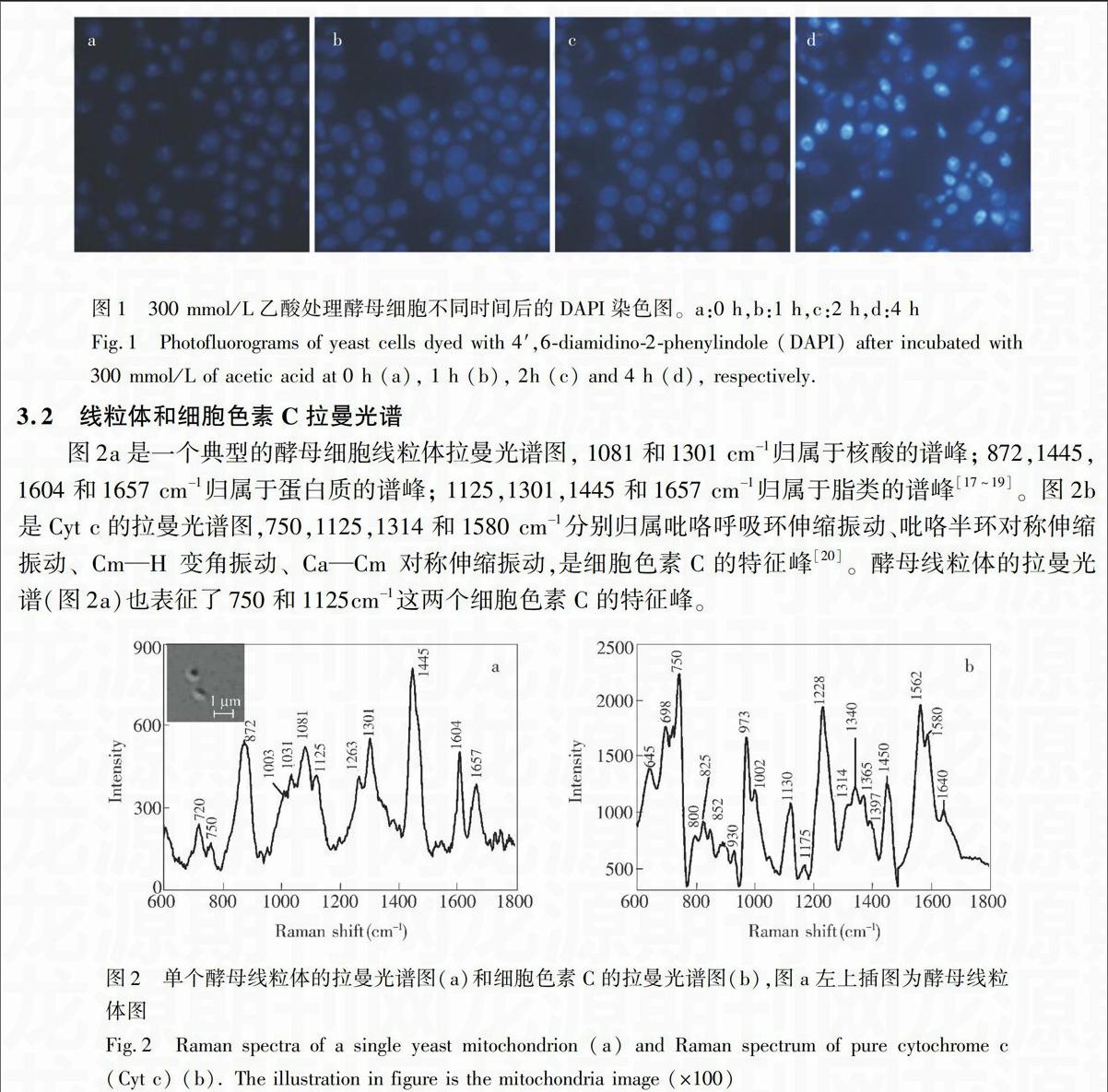
摘 要 应用激光光镊拉曼光谱技术(LTRS)作为一种非入侵分析线粒体的工具,结合氧电极法、紫外分光光度计法,研究乙酸胁迫酵母细胞后提取的线粒体,以及直接胁迫正常酵母细胞的离体线粒体的拉曼光谱。结果显示,乙酸胁迫酵母细胞后提取的线粒体的拉曼光谱,归属于核酸的谱峰(1081和1301 cm)、蛋白质的谱峰(872,1445,1604和1657 cm)、脂类的谱峰(1125,1301,1445和1657 cm)、Cyt c的特征峰(750和1125 cm)、线粒体呼吸特征峰(1604 cm),都随着诱导程度的加深而降低,与常规法测定的指标呼吸率,磷氧比,细胞色素C含量的降低,MDA含量的升高的变化趋势相似;乙酸直接胁迫线粒体的拉曼光谱,归属于核酸的谱峰(1081和1301 cm),蛋白质的谱峰(872,1445,1604和1657 cm),脂类的谱峰(1125,1301,1445和1657 cm),Cyt c的特征峰(750和1125 cm),线粒体呼吸特征峰(1604 cm),都随着诱导程度的加深而降低,与常规法测定的指标呼吸率、磷氧比、细胞色素C含量的降低,MDA含量的升高的变化趋势相似。结果表明,乙酸胁迫细胞过程中,乙酸进到细胞内可能直接作用于线粒体,引起线粒体内物质的释放,导致依赖于线粒体途径的细胞凋亡。
关键词 拉曼光谱; 乙酸胁迫; 酵母细胞; 线粒体; 凋亡
1 引 言
乙酸是酵母发酵过程中的一种代谢产物,它不能被酵母代谢,会对酵母细胞产生生理毒害作用,抑制酵母发酵,如果乙酸等代谢产物进一步积累就会诱发酵母细胞大量死亡【1,2】。用20~200 mmol/L乙酸对对数期的酿酒酵母细胞进行胁迫,酵母细胞会发生染色质伴随着核膜的凝聚、细胞膜磷脂酰丝氨酸的外翻和TUNEL显阳性表型等的凋亡现象,当乙酸胁迫同一种稳定时期的酿酒酵母时,发现依赖于线粒体途径的酵母细胞凋亡现象【3】;进一步研究发现,酵母细胞凋亡与ROS的产生、Cyt c从线粒体释放到细胞质中有关【4】。用一定浓度乙酸处理酵母细胞时,发现酵母细胞凋亡过程释放的Cyt c能激活Caspase,使Caspase裂解成为有酶解活性的异源二聚体,并引发下游的一系列级联反应,通过裂解特异底物和激活内源性核酸酶最终导致细胞凋亡【5,6】。但直到目前为止,酵母的代谢产物如何诱导细胞死亡的过程仍不完全清楚。初步的研究表明,其代谢物可通过诱导线粒体中内含物的释放来启动细胞不可逆的凋亡程序【7】。
激光光镊拉曼系统(LTRS)是利用激光束形成的光镊固定溶液中的单个活细胞,再经过瞬时增加激光功率同时激发和收集细胞的拉曼光谱,具有无损伤、灵敏、快速等优势,是研究溶液中单个活细胞的有力工具。线粒体是真核生物细胞中进行能量代谢的重要细胞器,在功能上线粒体不仅是细胞能量代谢的中枢,还是细胞凋亡的重要参与者;线粒体大小约为0.5~1 μm,在缓冲液中可被激光镊子所捕获,避免了由于布朗运动对线粒体的影响。因此,LTRS的应用使得离体有活性的单个线粒体的研究成为可能【10】。本研究应用LTRS,研究了乙酸胁迫酵母细胞以及离体线粒体过程中的光谱变化,获得乙酸诱导酵母细胞发生凋亡的过程中,线粒体内核酸、蛋白质、脂类等大分子物质变化的实时信息,是单个线粒体水平上的一种简单快速分析方法。
2 实验部分
2.1 菌株与培养基
菌种:安琪酿酒高活性干酵母(安琪酵母股份有限公司)。
培养基为YPD培养基:1%酵母提取物、2%葡萄糖、2%蛋白胨。
2.2 乙酸胁迫酵母细胞以及线粒体的提取
2.2.1 酵母菌的活化 取干酵母粉于YPD液体培养液中,29 ℃、100 r/min培养过夜,将长菌的液体培养基稀释105倍后涂板,29 ℃培养。挑取单菌落至新鲜的YPD液体培养基中,在29 ℃以100 r/min培养过夜,按1%的接种量接种到新鲜的YPD液体培养基中,再在29 ℃以150 r/min培养,当OD≈0.8时,即可离心收集菌体。
2.2.2 线粒体的提取 将离心收集的菌体,用菌体预处理缓冲液处理后加入蜗牛酶缓冲液,再加入原生质体裂解液和玻璃珠(425~600 μm)冰上涡旋破壁,破壁后差速离心法提取线粒体【11,12】,线粒体提取液悬浮,4 ℃保存待用。对所提取的线粒体马上进行稳定性与完整性测试,只有在4 ℃条件下,2 h内保持结构的完整性以及生理稳定性的离体线粒体,才可用于后续实验。
2.2.3 不同浓度乙酸胁迫酵母细胞 将离心收集的菌体,用50 mmol/L Tris缓冲液(pH 7.5)洗2~3次,在等体积、终浓度分别为0,50,100和200 mmol/L乙酸中进行处理,在29 ℃以100 r/min缓慢摇60 min,离心去掉处理液,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。
2.2.4 高浓度乙酸胁迫酵母细胞后不同时间点线粒体的提取
将离心收集的菌体,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,在终浓度为200 mmol/L乙酸中进行处理,在29 ℃以100 r/min缓慢摇,分别在0,30,60和90 min时间点取样,离心去掉上清液,50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。
2.3 乙酸胁迫离体线粒体
将离心收集的酵母细胞,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。提取后的酵母线粒体,在4 ℃条件下,终浓度为20 mmol/L 乙酸中进行处理,不时摇动离心管使线粒体始终悬浮于处理液中,分别在0,15,30,45,60,75和90 min时间点取样,离心去掉处理液,线粒体悬浮液洗涤3次后悬浮,4 ℃保存备用。
2.4 凋亡细胞DAPI染色
细胞凋亡DAPI染色按试剂盒说明书步骤进行(南京凯基生物科技发展有限公司)。离心收集乙酸处理后的细胞,加500 μL DAPI工作液洗1次,再加500 μL DAPI工作液重悬细胞,37 ℃染色15 min,离心收集细胞弃去工作液,加入Buffer A重悬细胞,滴加于载玻片上,荧光显微镜以340/380 nm紫外光激发,镜检、拍照。
2.5 线粒体生理生化活性测定
参照文献\
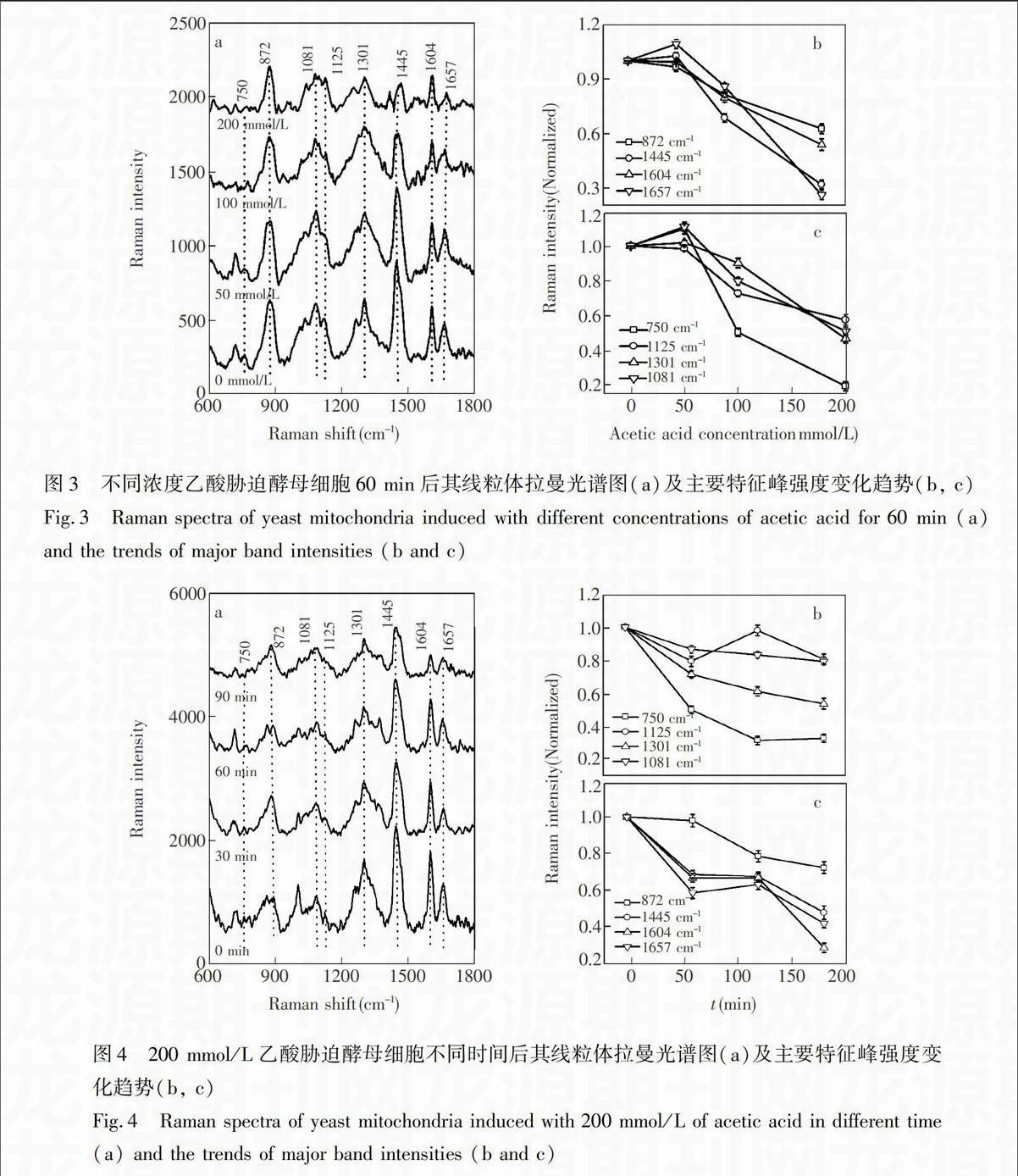
图4是200 mmol/L乙酸胁迫酵母细胞不同时间后提取其线粒体的拉曼光谱及特征峰强度变化趋势图。图中显示,归属于核酸的谱峰(1081和1301 cm),蛋白质的谱峰(872,1445,1604和1657 cm),脂类的谱峰(1125,1301,1445和1657 cm),Cyt c的特征峰(750和1125 cm)及线粒体呼吸特征峰(1604 cm)均随着胁迫时间的增加而降低。所以,200 mmol/L乙酸胁迫下,酵母细胞线粒体内的核酸、蛋白质、脂类、Cyt c的谱峰强度变化和时间存在依赖关系。
3.4 乙酸胁迫酵母细胞后其线粒体生理生化指标
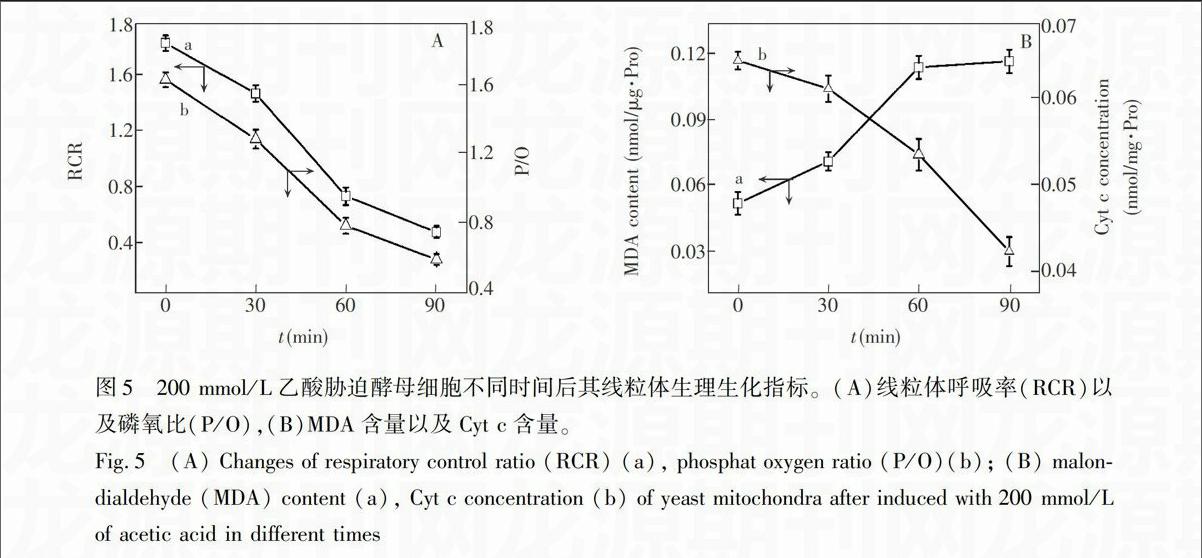
图5是200 mmol/L乙酸胁迫酵母细胞不同时间后,在不同时间点提取其线粒体后所测定的的生理生化指标变化趋势。图5A是乙酸胁迫细胞后其线粒体在不同时间点的呼吸率(RCR)与磷氧比(P/O)值,RCR和P/O反映线粒体氧化磷酸化的偶联程度,图5A显示,随着胁迫时间的延长RCR和P/O均呈下降趋势,说明线粒体的氧化磷酸化偶联程度降低,功能受损【23】,呼吸下降,与图4中呼吸特征峰1604 cm
的变化相似。图5B是乙酸胁迫细胞后其线粒体在不同时间点的丙二醛(MDA)和Cyt c含量变化趋势图。MDA是膜脂过氧化的一种终产物,而且,MDA还具有较强的细胞毒素,对线粒体的呼吸功能具有显著的抑制作用【24】,图5B显示,随着乙酸胁迫时间的延长,MDA含量增加,说明线粒体膜脂过氧化程度加深。Cyt c是存在于膜间隙的水溶性蛋白质,正常情况下不能自由的通过线粒体外膜,当线粒体外膜通透性增加时,会被释放到胞浆中【25,26】;随着乙酸胁迫时间的延长,Cyt c含量降低,说明线粒体外膜受到破坏。图5中的生理生化指标与图4脂类、Cyt c、呼吸的拉曼峰强度变化基本一致。
当细胞受到凋亡信号的刺激时,可导致线粒体跨膜电位降低,外膜破裂,促使线粒体内各种凋亡诱导因子的释放,诱导因子的释放可引起线粒体内蛋白质含量的降低。而线粒体跨膜电位的降低,可使氧化磷酸化过程解偶联,大量的ROS产生,ATP的水解大于合成,造成ATP浓度迅速降低,胞质ADP和膜上肌酸磷酸酯浓度增高,影响线粒体的呼吸作用【27】。线粒体中的线粒体DNA(mtDNA),裸露于基质中,缺乏组合蛋白的保护,最易受到伤害,而且催化mtDNA复制的DNA聚合酶Y不具有校正功能,同时还缺乏有效的修复酶,所以mtDNA一旦受到损伤不易被修复,造成呼吸链功能受损,进一步积累ROS【28】,而线粒体内外膜的破裂可使一些受损伤的mtDNA扩散到胞浆中,引起核酸含量的降低。Cytc从破裂的线粒体中释放出来,导致线粒体呼吸链功能出现异常,引起ATP的减少,影响线粒体的呼吸作用【27】。
3.5 乙酸胁迫酵母离体线粒体拉曼光谱
图6是提取酵母线粒体后,用20 mmol/L乙酸直接胁迫离体线粒体不同时间的拉曼光谱及特征峰强度变化趋势图。结果显示,归属于核酸的谱峰(1081和1301 cm
),蛋白质的谱峰(872,1445,1604和1657 cm
),脂类的谱峰(1125,1301,1445和1657 cm
),Cyt c的特征峰(1125 cm
)及线粒体呼吸特征峰(1604 cm
)均随着胁迫时间的延长而降低,与乙酸直接胁迫细胞后,提取线粒体测定其光谱的变化趋势一致。提示乙酸直接胁迫细胞后,乙酸进到胞内可能直接作用于线粒体,造成生物大分子的流失。
图6 20 mmol/L乙酸胁迫酵母离体线粒体不同时间拉曼光谱图(a)及主要特征峰的强度变化趋势(b, c)
Fig.6 Raman spectra of yeast mitochondria in vitro induced with 20 mmol/L of acetic acid in different times (a) and the trends of major band intensities (b and c)
3.6 乙酸胁迫酵母离体线粒体生理生化指标
图7是20 mmol/L乙酸胁迫酵母离体线粒体后,不同时间点的生理生化指标。呼吸率、磷氧比(图7a)和Cyt c含量(图7b)随着胁迫时间的延长而下降,与图6中呼吸特征峰1604 cm
和Cyt c特征峰1125 cm
的变化相似。MDA的含量(图7b)随着乙酸胁迫时间的延长而上升,与图6中的拉曼谱峰变化趋势相似。这些生理生化指标与图5结果一致。
图7 20 mmol/L乙酸胁迫酵母离体线粒体后其不同时间点的生理生化指标。(a)线粒体呼吸率(RCR)以及磷氧比(P/O),(b)MDA含量以及Cyt c含量。
Fig.7 Changes of RCR (a), P/O (a), MDA content (b),Cyt c concentration (b) of yeast mitochondria in vitro induced with 20 mmol/L of acetic acid in different times
4 结 论
乙酸胁迫酵母细胞后提取线粒体,以及乙酸直接胁迫离体线粒体,归属核酸、蛋白质、脂类、Cyt c、线粒体呼吸特征峰强度均随着胁迫程度的加深而降低。表明在乙酸胁迫酵母细胞过程中,乙酸进入到细胞内可能直接作用于线粒体,导致线粒体膜脂质过氧化程度加深,线粒体内的核酸、蛋白质、脂类、Cyt c含量的降低,呼吸功能衰竭,出现依赖于线粒体途径的细胞凋亡现象。LTRS可以作为一种非入侵性分析线粒体的有用工具。
References
1 LI Xue-Yan, ZHAO Hua. Liquor Making, 2001, 28(6): 58-60
李雪雁, 赵 华. 酿酒, 2001, 28(6): 58-60
2 WANG Xing-Wen, QIU Xing-Tian, JI Geng-Sheng, YONG Qiang, YU Shi-Yuan. Acta Agriculturae Universitatis Jiangxiensis, 2007, 29(5): 834-836
王杏文, 邱兴天, 季更生, 勇 强, 余世袁. 江西农业大学学报, 2007, 29(5): 834-836
3 Ludovico P, Sousa M J, Silva M T, Leao C, Corte-Real M. Microbiology, 2001, 147(9): 2409-2415
4 Ludovico P, Rodrigues F, Almeida A, Silva M T, Barrientos A, Corte-Real M. Mol. Biol. Cell, 2002, 13(8): 2598-2606
5 Guaragnella N, Bobba A, Passarella S, Marra E, Giannattasio S. FEBS Lett., 2010, 584(1): 224-228
6 Guaragnella N, Pereira C, Sousa M J, Antonacci L, Passarella S, Corte-Real M, Marra E, Giannattasio S. FEBS Lett., 2006, 580(30): 6880-6884
7 Kitaqaki H, Araki Y, Funato K, Shimoi H. FEBS Lett., 2007, 581(16): 2935-2942
8 ZHOU Bing, LU Ming-Qian, ZHAO Li-Wei, HUANG Shu-Shi, CHEN Li-Mei. Chinese J. Anal. Chem., 2013, 41(12): 1789-1794
周 冰, 卢明倩, 赵丽伟, 黄庶识, 陈丽梅. 分析化学, 2013, 41(12): 1789-1794
9 WANG Yan-Jun, YAO Hui-Lu, WANG Gui-Wen, WANG Yun, FENG Fu-Mei. Spectroscopy and Spectral Analysis, 2009, 29(7): 1881-1883
王雁军, 姚辉璐, 王桂文, 汪 蕴, 丰美福. 光谱学与光谱分析, 2009, 29(7): 1881-1883
10 Tang H Y, Yao L H, WANG G W, Wang Y, Li Y Q, Feng M F. Opt. Express, 2007, 15(20): 12708-12716
11 JIN Jian-Ling, GAO Dong, SUN Zhong-Dong. Hereditas, 1996, 18(2): 46-48
金建玲, 高 东, 孙忠东. 遗传, 1996, 18(2): 46-48
12 ZHAO Hong-Yu, LI Jun, ZHAO Yue, WANG Xin, CAI Lu. Food Science, 2011, 32(9): 170-173
赵宏宇, 李 珺, 赵 玥, 王 馨, 蔡 禄. 食品科学, 2011, 32(9): 170-173
13 DONG Zhuo-Ya. Journal of Anhui Agricultural Sciences, 2012, 40(26): 12805-12807
董卓娅. 安徽农业科学, 2012, 40(26): 12805-12807
14 ZHANG Jun-Tian, DU Guan-Hua. Modern Experimental Methods in Pharmacology. Beijing: Peking Union Medical College Press, 2012: 1228-1229
张均田, 杜冠华. 现代药理实验方法. 北京: 中国协和医科大学联合出版社, 1998: 1228-1229
15 Yang S, Tan T M C, Wee A, Leow C K. Cell. Mol. Life Sci., 2004, 2(61): 220-229
16 LU Ming-Qian, DONG Rong, WEN Shun-Hua, ZHANG Wei, WANG Qiao-Zhen, HUANG Shu-Shi, CHEN Li-Mei. Chinese J. Anal. Chem., 2012, 40(12): 1845-1851
卢明倩, 董 蓉, 温顺华, 张 韦, 王巧贞, 黄庶识, 陈丽梅. 分析化学, 2012, 40(12): 1845-1851
17 Shetty G, Kendall C, Shepherd N, Stone N, Barr H. Br. J. Cancer, 2006, 94(10): 1460-1464
18 Notingher I. Sens., 2007, 7(8): 1343-1358
19 XU Yi-Ming. Raman Spectroscopy in Application of Structure Biology. Beijing: Chemical industry press, 2005: 11-114
许以明. 拉曼光谱及其在结构生物学中的应用. 北京: 化学工业出版社, 2005: 11-141
20 Onogi C, Hamaguchi H. Chem.Lett., 2010, 39(3): 270-271
21 Palmqvist E, Grage H, Meinander N Q, Hahn-Hgerdal B. Biotechnol.Bioeng., 1999, 63(1): 46-55
22 PAN Jin-Quan, LIU Yun. Biotechnology, 2002, 12(1): 45-47
潘进权, 刘 耘. 生物技术, 2002, 12(1): 45-47
23 ZHANG Lei, CHEN Shun-Zhi, LIU Shu-Sen. Modern Preventive Medicing, 2008, 35(7): 1348-1352
张 蕾, 陈顺志, 刘树森. 现代预防医学, 2008, 35(7): 1348-1352
24 LONG Jian-Gang, WANG Xue-Min, GAO Hong-Xiang, LIU Chang-Sheng, LIU Zhi, MIU Ming-Yong, LIU Jian-Kang. Academic Journal of Second Military Medical University, 2005, 26(10): 1131-1135
龙建纲, 王学敏, 高宏翔, 刘昌盛, 刘 志, 缪明永, 刘健康. 第二军医大学学报, 2005, 26(10): 1131-1135
25 ZHANG Wen-Hua, ZHOU Lu, XU Shu-Jun, CHEN Teng, JIA De-Ze, ZHOU Mao-De, WU Cheng-Yun. Journal of Shandong University(Health Sciences), 2007, 45(12): 1193-1196
张文华, 周 璐, 徐淑军, 陈 腾, 贾德泽, 周茂德, 吴承运. 山东大学学报(医学版), 2007, 45(12): 1193-1196
26 LAI Gui-Hua, WANG Xun-Cui, LI Qing-Lin. Journal of Anhui TCM College, 2013, 32(4): 61-64
赖桂华, 王训翠, 李庆林. 安徽中医学院学报, 2013, 32(4): 61-64
27 Gottlieb E, Armour S M, Thompson C B. PNAS, 2002, 99(20): 12801-12806
28 WU Lan-Fang, YANG Ai-Zhen, LIU He, WANG You-Nian. Chinese Agricultural Science Bulletin, 2010, 26(8): 63-68
吴兰芳, 杨爱珍, 刘 和, 王有年. 中国农学通报, 2010, 26(8): 63-68



摘 要 应用激光光镊拉曼光谱技术(LTRS)作为一种非入侵分析线粒体的工具,结合氧电极法、紫外分光光度计法,研究乙酸胁迫酵母细胞后提取的线粒体,以及直接胁迫正常酵母细胞的离体线粒体的拉曼光谱。结果显示,乙酸胁迫酵母细胞后提取的线粒体的拉曼光谱,归属于核酸的谱峰(1081和1301 cm)、蛋白质的谱峰(872,1445,1604和1657 cm)、脂类的谱峰(1125,1301,1445和1657 cm)、Cyt c的特征峰(750和1125 cm)、线粒体呼吸特征峰(1604 cm),都随着诱导程度的加深而降低,与常规法测定的指标呼吸率,磷氧比,细胞色素C含量的降低,MDA含量的升高的变化趋势相似;乙酸直接胁迫线粒体的拉曼光谱,归属于核酸的谱峰(1081和1301 cm),蛋白质的谱峰(872,1445,1604和1657 cm),脂类的谱峰(1125,1301,1445和1657 cm),Cyt c的特征峰(750和1125 cm),线粒体呼吸特征峰(1604 cm),都随着诱导程度的加深而降低,与常规法测定的指标呼吸率、磷氧比、细胞色素C含量的降低,MDA含量的升高的变化趋势相似。结果表明,乙酸胁迫细胞过程中,乙酸进到细胞内可能直接作用于线粒体,引起线粒体内物质的释放,导致依赖于线粒体途径的细胞凋亡。
关键词 拉曼光谱; 乙酸胁迫; 酵母细胞; 线粒体; 凋亡
1 引 言
乙酸是酵母发酵过程中的一种代谢产物,它不能被酵母代谢,会对酵母细胞产生生理毒害作用,抑制酵母发酵,如果乙酸等代谢产物进一步积累就会诱发酵母细胞大量死亡【1,2】。用20~200 mmol/L乙酸对对数期的酿酒酵母细胞进行胁迫,酵母细胞会发生染色质伴随着核膜的凝聚、细胞膜磷脂酰丝氨酸的外翻和TUNEL显阳性表型等的凋亡现象,当乙酸胁迫同一种稳定时期的酿酒酵母时,发现依赖于线粒体途径的酵母细胞凋亡现象【3】;进一步研究发现,酵母细胞凋亡与ROS的产生、Cyt c从线粒体释放到细胞质中有关【4】。用一定浓度乙酸处理酵母细胞时,发现酵母细胞凋亡过程释放的Cyt c能激活Caspase,使Caspase裂解成为有酶解活性的异源二聚体,并引发下游的一系列级联反应,通过裂解特异底物和激活内源性核酸酶最终导致细胞凋亡【5,6】。但直到目前为止,酵母的代谢产物如何诱导细胞死亡的过程仍不完全清楚。初步的研究表明,其代谢物可通过诱导线粒体中内含物的释放来启动细胞不可逆的凋亡程序【7】。
激光光镊拉曼系统(LTRS)是利用激光束形成的光镊固定溶液中的单个活细胞,再经过瞬时增加激光功率同时激发和收集细胞的拉曼光谱,具有无损伤、灵敏、快速等优势,是研究溶液中单个活细胞的有力工具。线粒体是真核生物细胞中进行能量代谢的重要细胞器,在功能上线粒体不仅是细胞能量代谢的中枢,还是细胞凋亡的重要参与者;线粒体大小约为0.5~1 μm,在缓冲液中可被激光镊子所捕获,避免了由于布朗运动对线粒体的影响。因此,LTRS的应用使得离体有活性的单个线粒体的研究成为可能【10】。本研究应用LTRS,研究了乙酸胁迫酵母细胞以及离体线粒体过程中的光谱变化,获得乙酸诱导酵母细胞发生凋亡的过程中,线粒体内核酸、蛋白质、脂类等大分子物质变化的实时信息,是单个线粒体水平上的一种简单快速分析方法。
2 实验部分
2.1 菌株与培养基
菌种:安琪酿酒高活性干酵母(安琪酵母股份有限公司)。
培养基为YPD培养基:1%酵母提取物、2%葡萄糖、2%蛋白胨。
2.2 乙酸胁迫酵母细胞以及线粒体的提取
2.2.1 酵母菌的活化 取干酵母粉于YPD液体培养液中,29 ℃、100 r/min培养过夜,将长菌的液体培养基稀释105倍后涂板,29 ℃培养。挑取单菌落至新鲜的YPD液体培养基中,在29 ℃以100 r/min培养过夜,按1%的接种量接种到新鲜的YPD液体培养基中,再在29 ℃以150 r/min培养,当OD≈0.8时,即可离心收集菌体。
2.2.2 线粒体的提取 将离心收集的菌体,用菌体预处理缓冲液处理后加入蜗牛酶缓冲液,再加入原生质体裂解液和玻璃珠(425~600 μm)冰上涡旋破壁,破壁后差速离心法提取线粒体【11,12】,线粒体提取液悬浮,4 ℃保存待用。对所提取的线粒体马上进行稳定性与完整性测试,只有在4 ℃条件下,2 h内保持结构的完整性以及生理稳定性的离体线粒体,才可用于后续实验。
2.2.3 不同浓度乙酸胁迫酵母细胞 将离心收集的菌体,用50 mmol/L Tris缓冲液(pH 7.5)洗2~3次,在等体积、终浓度分别为0,50,100和200 mmol/L乙酸中进行处理,在29 ℃以100 r/min缓慢摇60 min,离心去掉处理液,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。
2.2.4 高浓度乙酸胁迫酵母细胞后不同时间点线粒体的提取
将离心收集的菌体,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,在终浓度为200 mmol/L乙酸中进行处理,在29 ℃以100 r/min缓慢摇,分别在0,30,60和90 min时间点取样,离心去掉上清液,50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。
2.3 乙酸胁迫离体线粒体
将离心收集的酵母细胞,用50 mmol/L Tris缓冲液(pH 7.5)洗3次,称湿重,提取酵母线粒体。提取后的酵母线粒体,在4 ℃条件下,终浓度为20 mmol/L 乙酸中进行处理,不时摇动离心管使线粒体始终悬浮于处理液中,分别在0,15,30,45,60,75和90 min时间点取样,离心去掉处理液,线粒体悬浮液洗涤3次后悬浮,4 ℃保存备用。
2.4 凋亡细胞DAPI染色
细胞凋亡DAPI染色按试剂盒说明书步骤进行(南京凯基生物科技发展有限公司)。离心收集乙酸处理后的细胞,加500 μL DAPI工作液洗1次,再加500 μL DAPI工作液重悬细胞,37 ℃染色15 min,离心收集细胞弃去工作液,加入Buffer A重悬细胞,滴加于载玻片上,荧光显微镜以340/380 nm紫外光激发,镜检、拍照。
2.5 线粒体生理生化活性测定
参照文献\
图4是200 mmol/L乙酸胁迫酵母细胞不同时间后提取其线粒体的拉曼光谱及特征峰强度变化趋势图。图中显示,归属于核酸的谱峰(1081和1301 cm),蛋白质的谱峰(872,1445,1604和1657 cm),脂类的谱峰(1125,1301,1445和1657 cm),Cyt c的特征峰(750和1125 cm)及线粒体呼吸特征峰(1604 cm)均随着胁迫时间的增加而降低。所以,200 mmol/L乙酸胁迫下,酵母细胞线粒体内的核酸、蛋白质、脂类、Cyt c的谱峰强度变化和时间存在依赖关系。
3.4 乙酸胁迫酵母细胞后其线粒体生理生化指标
图5是200 mmol/L乙酸胁迫酵母细胞不同时间后,在不同时间点提取其线粒体后所测定的的生理生化指标变化趋势。图5A是乙酸胁迫细胞后其线粒体在不同时间点的呼吸率(RCR)与磷氧比(P/O)值,RCR和P/O反映线粒体氧化磷酸化的偶联程度,图5A显示,随着胁迫时间的延长RCR和P/O均呈下降趋势,说明线粒体的氧化磷酸化偶联程度降低,功能受损【23】,呼吸下降,与图4中呼吸特征峰1604 cm
的变化相似。图5B是乙酸胁迫细胞后其线粒体在不同时间点的丙二醛(MDA)和Cyt c含量变化趋势图。MDA是膜脂过氧化的一种终产物,而且,MDA还具有较强的细胞毒素,对线粒体的呼吸功能具有显著的抑制作用【24】,图5B显示,随着乙酸胁迫时间的延长,MDA含量增加,说明线粒体膜脂过氧化程度加深。Cyt c是存在于膜间隙的水溶性蛋白质,正常情况下不能自由的通过线粒体外膜,当线粒体外膜通透性增加时,会被释放到胞浆中【25,26】;随着乙酸胁迫时间的延长,Cyt c含量降低,说明线粒体外膜受到破坏。图5中的生理生化指标与图4脂类、Cyt c、呼吸的拉曼峰强度变化基本一致。
当细胞受到凋亡信号的刺激时,可导致线粒体跨膜电位降低,外膜破裂,促使线粒体内各种凋亡诱导因子的释放,诱导因子的释放可引起线粒体内蛋白质含量的降低。而线粒体跨膜电位的降低,可使氧化磷酸化过程解偶联,大量的ROS产生,ATP的水解大于合成,造成ATP浓度迅速降低,胞质ADP和膜上肌酸磷酸酯浓度增高,影响线粒体的呼吸作用【27】。线粒体中的线粒体DNA(mtDNA),裸露于基质中,缺乏组合蛋白的保护,最易受到伤害,而且催化mtDNA复制的DNA聚合酶Y不具有校正功能,同时还缺乏有效的修复酶,所以mtDNA一旦受到损伤不易被修复,造成呼吸链功能受损,进一步积累ROS【28】,而线粒体内外膜的破裂可使一些受损伤的mtDNA扩散到胞浆中,引起核酸含量的降低。Cytc从破裂的线粒体中释放出来,导致线粒体呼吸链功能出现异常,引起ATP的减少,影响线粒体的呼吸作用【27】。
3.5 乙酸胁迫酵母离体线粒体拉曼光谱
图6是提取酵母线粒体后,用20 mmol/L乙酸直接胁迫离体线粒体不同时间的拉曼光谱及特征峰强度变化趋势图。结果显示,归属于核酸的谱峰(1081和1301 cm
),蛋白质的谱峰(872,1445,1604和1657 cm
),脂类的谱峰(1125,1301,1445和1657 cm
),Cyt c的特征峰(1125 cm
)及线粒体呼吸特征峰(1604 cm
)均随着胁迫时间的延长而降低,与乙酸直接胁迫细胞后,提取线粒体测定其光谱的变化趋势一致。提示乙酸直接胁迫细胞后,乙酸进到胞内可能直接作用于线粒体,造成生物大分子的流失。
图6 20 mmol/L乙酸胁迫酵母离体线粒体不同时间拉曼光谱图(a)及主要特征峰的强度变化趋势(b, c)
Fig.6 Raman spectra of yeast mitochondria in vitro induced with 20 mmol/L of acetic acid in different times (a) and the trends of major band intensities (b and c)
3.6 乙酸胁迫酵母离体线粒体生理生化指标
图7是20 mmol/L乙酸胁迫酵母离体线粒体后,不同时间点的生理生化指标。呼吸率、磷氧比(图7a)和Cyt c含量(图7b)随着胁迫时间的延长而下降,与图6中呼吸特征峰1604 cm
和Cyt c特征峰1125 cm
的变化相似。MDA的含量(图7b)随着乙酸胁迫时间的延长而上升,与图6中的拉曼谱峰变化趋势相似。这些生理生化指标与图5结果一致。
图7 20 mmol/L乙酸胁迫酵母离体线粒体后其不同时间点的生理生化指标。(a)线粒体呼吸率(RCR)以及磷氧比(P/O),(b)MDA含量以及Cyt c含量。
Fig.7 Changes of RCR (a), P/O (a), MDA content (b),Cyt c concentration (b) of yeast mitochondria in vitro induced with 20 mmol/L of acetic acid in different times
4 结 论
乙酸胁迫酵母细胞后提取线粒体,以及乙酸直接胁迫离体线粒体,归属核酸、蛋白质、脂类、Cyt c、线粒体呼吸特征峰强度均随着胁迫程度的加深而降低。表明在乙酸胁迫酵母细胞过程中,乙酸进入到细胞内可能直接作用于线粒体,导致线粒体膜脂质过氧化程度加深,线粒体内的核酸、蛋白质、脂类、Cyt c含量的降低,呼吸功能衰竭,出现依赖于线粒体途径的细胞凋亡现象。LTRS可以作为一种非入侵性分析线粒体的有用工具。
References
1 LI Xue-Yan, ZHAO Hua. Liquor Making, 2001, 28(6): 58-60
李雪雁, 赵 华. 酿酒, 2001, 28(6): 58-60
2 WANG Xing-Wen, QIU Xing-Tian, JI Geng-Sheng, YONG Qiang, YU Shi-Yuan. Acta Agriculturae Universitatis Jiangxiensis, 2007, 29(5): 834-836
王杏文, 邱兴天, 季更生, 勇 强, 余世袁. 江西农业大学学报, 2007, 29(5): 834-836
3 Ludovico P, Sousa M J, Silva M T, Leao C, Corte-Real M. Microbiology, 2001, 147(9): 2409-2415
4 Ludovico P, Rodrigues F, Almeida A, Silva M T, Barrientos A, Corte-Real M. Mol. Biol. Cell, 2002, 13(8): 2598-2606
5 Guaragnella N, Bobba A, Passarella S, Marra E, Giannattasio S. FEBS Lett., 2010, 584(1): 224-228
6 Guaragnella N, Pereira C, Sousa M J, Antonacci L, Passarella S, Corte-Real M, Marra E, Giannattasio S. FEBS Lett., 2006, 580(30): 6880-6884
7 Kitaqaki H, Araki Y, Funato K, Shimoi H. FEBS Lett., 2007, 581(16): 2935-2942
8 ZHOU Bing, LU Ming-Qian, ZHAO Li-Wei, HUANG Shu-Shi, CHEN Li-Mei. Chinese J. Anal. Chem., 2013, 41(12): 1789-1794
周 冰, 卢明倩, 赵丽伟, 黄庶识, 陈丽梅. 分析化学, 2013, 41(12): 1789-1794
9 WANG Yan-Jun, YAO Hui-Lu, WANG Gui-Wen, WANG Yun, FENG Fu-Mei. Spectroscopy and Spectral Analysis, 2009, 29(7): 1881-1883
王雁军, 姚辉璐, 王桂文, 汪 蕴, 丰美福. 光谱学与光谱分析, 2009, 29(7): 1881-1883
10 Tang H Y, Yao L H, WANG G W, Wang Y, Li Y Q, Feng M F. Opt. Express, 2007, 15(20): 12708-12716
11 JIN Jian-Ling, GAO Dong, SUN Zhong-Dong. Hereditas, 1996, 18(2): 46-48
金建玲, 高 东, 孙忠东. 遗传, 1996, 18(2): 46-48
12 ZHAO Hong-Yu, LI Jun, ZHAO Yue, WANG Xin, CAI Lu. Food Science, 2011, 32(9): 170-173
赵宏宇, 李 珺, 赵 玥, 王 馨, 蔡 禄. 食品科学, 2011, 32(9): 170-173
13 DONG Zhuo-Ya. Journal of Anhui Agricultural Sciences, 2012, 40(26): 12805-12807
董卓娅. 安徽农业科学, 2012, 40(26): 12805-12807
14 ZHANG Jun-Tian, DU Guan-Hua. Modern Experimental Methods in Pharmacology. Beijing: Peking Union Medical College Press, 2012: 1228-1229
张均田, 杜冠华. 现代药理实验方法. 北京: 中国协和医科大学联合出版社, 1998: 1228-1229
15 Yang S, Tan T M C, Wee A, Leow C K. Cell. Mol. Life Sci., 2004, 2(61): 220-229
16 LU Ming-Qian, DONG Rong, WEN Shun-Hua, ZHANG Wei, WANG Qiao-Zhen, HUANG Shu-Shi, CHEN Li-Mei. Chinese J. Anal. Chem., 2012, 40(12): 1845-1851
卢明倩, 董 蓉, 温顺华, 张 韦, 王巧贞, 黄庶识, 陈丽梅. 分析化学, 2012, 40(12): 1845-1851
17 Shetty G, Kendall C, Shepherd N, Stone N, Barr H. Br. J. Cancer, 2006, 94(10): 1460-1464
18 Notingher I. Sens., 2007, 7(8): 1343-1358
19 XU Yi-Ming. Raman Spectroscopy in Application of Structure Biology. Beijing: Chemical industry press, 2005: 11-114
许以明. 拉曼光谱及其在结构生物学中的应用. 北京: 化学工业出版社, 2005: 11-141
20 Onogi C, Hamaguchi H. Chem.Lett., 2010, 39(3): 270-271
21 Palmqvist E, Grage H, Meinander N Q, Hahn-Hgerdal B. Biotechnol.Bioeng., 1999, 63(1): 46-55
22 PAN Jin-Quan, LIU Yun. Biotechnology, 2002, 12(1): 45-47
潘进权, 刘 耘. 生物技术, 2002, 12(1): 45-47
23 ZHANG Lei, CHEN Shun-Zhi, LIU Shu-Sen. Modern Preventive Medicing, 2008, 35(7): 1348-1352
张 蕾, 陈顺志, 刘树森. 现代预防医学, 2008, 35(7): 1348-1352
24 LONG Jian-Gang, WANG Xue-Min, GAO Hong-Xiang, LIU Chang-Sheng, LIU Zhi, MIU Ming-Yong, LIU Jian-Kang. Academic Journal of Second Military Medical University, 2005, 26(10): 1131-1135
龙建纲, 王学敏, 高宏翔, 刘昌盛, 刘 志, 缪明永, 刘健康. 第二军医大学学报, 2005, 26(10): 1131-1135
25 ZHANG Wen-Hua, ZHOU Lu, XU Shu-Jun, CHEN Teng, JIA De-Ze, ZHOU Mao-De, WU Cheng-Yun. Journal of Shandong University(Health Sciences), 2007, 45(12): 1193-1196
张文华, 周 璐, 徐淑军, 陈 腾, 贾德泽, 周茂德, 吴承运. 山东大学学报(医学版), 2007, 45(12): 1193-1196
26 LAI Gui-Hua, WANG Xun-Cui, LI Qing-Lin. Journal of Anhui TCM College, 2013, 32(4): 61-64
赖桂华, 王训翠, 李庆林. 安徽中医学院学报, 2013, 32(4): 61-64
27 Gottlieb E, Armour S M, Thompson C B. PNAS, 2002, 99(20): 12801-12806
28 WU Lan-Fang, YANG Ai-Zhen, LIU He, WANG You-Nian. Chinese Agricultural Science Bulletin, 2010, 26(8): 63-68
吴兰芳, 杨爱珍, 刘 和, 王有年. 中国农学通报, 2010, 26(8): 63-68

