邓文静 周颖 林秀欣 余更生
【摘要】 目的 观察程序性死亡受体1(PD-1)单克隆抗体(单抗)Pembrolizumab治疗晚期肺癌的疗效和毒副反应。方法 28例晚期肺癌患者, 均接受PD-1单抗Pembrolizumab治疗, 评价其近期疗效和毒副反应发生情况。结果 28例患者中, 3例患者于治疗1个月内因原发肿瘤进展、病情加重而死亡。其余25例患者, 完全缓解1例、部分缓解4例、疾病稳定14例、疾病进展6例, 客观反应率20.0%(5/25), 疾病控制率76.0%(19/25)。可评价疗效的25例患者中位无进展生存期(PFS)为5.1个月, 95%CI=(2.9, 7.4)。28例患者常见的不良反应为疲乏5例(17.9%)、发热4例(14.3%)、免疫相关性肺炎6例(21.4%), 其次为甲状腺功能减退3例(10.7%)、皮疹2例(7.1%)、腹泻2例(7.1%)、甲状腺功能亢进1例(3.6%)、心脏毒性1例(3.6%)。结论 PD-1单抗Pembrolizumab对晚期肺癌疗效可, 毒副作用可耐受。
【关键词】 程序性死亡受体1;Pembrolizumab;晚期肺癌
DOI:10.14163/j.cnki.11-5547/r.2020.03.004
【Abstract】 Objective? ?To observe the efficacy and toxic and side effect of programmed death 1 (PD-1) monoclonal antibody Pembrolizumab in advanced lung cancer. Methods? ?28 patients with advanced lung cancer were treated with PD-1 monoclonal antibody pembrolizumab, and their short-term efficacy and toxic and side effects were evaluated. Results? ?Among the 28 patients, 3 cases died of primary tumor progression and aggravation within 1 month after treatment. Among the other 25 patients, there were 1 case of complete remission, 4 cases of partial remission, 14 cases of disease stabilization, 6 cases of disease progression. The objective response rate was 20.0% (5 / 25), and the disease control rate was 76.0% (19 / 25). Median progression free survival (PFS) was?5.1 months and 95%CI=(2.9, 7.4) in 25 patients. The common adverse reactions were fatigue in 5 cases (17.9%), fever in 4 cases (14.3%), immune-related pneumonia in 6 cases (21.4%), hypothyroidism in 3 cases (10.7%), rash in 2 cases (7.1%), diarrhea in 2 cases (7.1%), hyperthyroidism in 1 case (3.6%) and cardiotoxicity in 1 case (3.6%). Conclusion? ?PD-1 monoclonal antibody Pembrolizumab shows good efficacy on advanced lung cancer, and the toxic and side effects are tolerable.
【Key words】 Programmed death 1; Pembrolizumab; Advanced lung cancer
肿瘤免疫治疗是机体通过主动或被动方式产生肿瘤特异性免疫应答, 恢复或增强机体免疫系统活性, 达到抑制和杀伤肿瘤细胞的治疗方法。肿瘤免疫治疗主要包括免疫检测点阻断、过继性细胞输注、肿瘤疫苗等。随着对肿瘤免疫治疗的深入研究, 和肿瘤发生发展密切相关的各种信号通路也越来越清晰。PD-1及其配体(PD-L1)信号通路是其中重要一种, 此通路激活后可对T细胞功能产生负向的免疫调节, 通过抑制肿瘤特异性CD8+ T细胞活性, 使肿瘤细胞发生免疫逃逸。免疫检查点抑制剂的主要作用机制是增强T淋巴细胞的增殖、迁移及细胞杀伤活性, 尤其是T细胞的肿瘤浸润活性。近年来研究较多的免疫检查点抑制剂主要是单克隆抗体, 如抗PD-1/PD-L1抗体, 在多种恶性肿瘤的治疗中发挥重要作用。国外研究发现, PD-1单抗对多种恶性肿瘤均具有较好的疗效, 包括非小细胞肺癌、恶性黑色素瘤、肾细胞癌、尿路上皮细胞癌、头颈鳞状细胞癌、胃癌、肝细胞癌、卵巢癌、三阴性乳腺癌等[1]。本研究分析了PD-1单抗Pembrolizumab治疗28例晚期肺癌的疗效及安全性。现将研究结果报告如下。
1 资料与方法
1. 1 一般资料 选取2017年1月~2018年12月在江门市中心医院肿瘤科诊断为晚期肺癌并接受PD-1单抗Pembrolizumab治疗的28例患者为研究对象, 患者均经组织学或细胞学病理检查确诊为晚期肺癌, 且均经CT或磁共振成像(MRI)检查证实有可评价的客观病灶。28例患者中位年龄56岁, 其中男18例, 女10例;有吸烟史或正在吸烟12例,?无吸烟史16例;腺癌13例、鳞癌12例、小细胞癌2例、腺鳞癌1例;美国东部肿瘤合作组(ECOG)身体体能活动状况评分0~1分21例, 2~3分7例;既往行化療24例、肺部及纵隔放疗12例、靶向治疗7例;一线治疗4例、二线治疗9例、三线及以上治疗15例;PD-L1表达<1% 2例、1%~50% 6例、>50% 1例、未行检测19例。
1. 2 治疗方法 给予PD-1单抗Pembrolizumab (美国默沙东公司) 2 mg/kg静脉滴注, 每3周1次。
1. 3 观察指标及判定标准 评价患者近期疗效及毒副反应发生情况。近期疗效参照RECIST 1.1标准分为完全缓解、部分缓解、疾病稳定和疾病进展。客观反应率=(完全缓解+部分缓解)/总例数×100%, 疾病控制率=(完全缓解+部分缓解+疾病稳定)/总例数×100%。PFS指患者从开始应用PD-1单抗Pembrolizumab至出现疾病进展的时间。截止随访日期未出现疾病进展或失访, 则定义为删失数据。不良反应参照美国国家癌症研究所(NCI)制定的不良反应标准进行评估, 主要包括疲乏、发热、皮疹、腹泻、甲状腺功能减退、甲状腺功能亢进、免疫相关性肺炎、心脏毒性。
2 结果
2. 1 近期疗效 28例患者中, 3例患者于治疗1个月内因原发肿瘤进展、病情加重而死亡。其余25例患者, 完全緩解1例、部分缓解4例、疾病稳定14例、疾病进展6例, 客观反应率20.0%(5/25), 疾病控制率76.0%(19/25)。
2. 2 中位PFS 可评价疗效的25例患者中位PFS为5.1个月, 95%CI=(2.9, 7.4)。
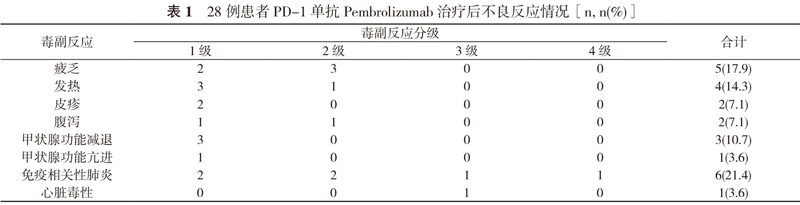
2. 3 毒副反应 28例患者常见的不良反应为疲乏5例(17.9%)、发热4例(14.3%)、免疫相关性肺炎6例(21.4%), 其次为甲状腺功能减退3例(10.7%)、皮疹2例(7.1%)、腹泻2例(7.1%)、甲状腺功能亢进1例(3.6%)、心脏毒性1例(3.6%)。见表1。
3 讨论
目前免疫治疗是全世界研究的热点及焦点, 它是恶性肿瘤继放化疗、手术等传统治疗和分子靶向治疗后的又一治疗手段。免疫检查点抑制剂(immune checkpoint inhibitors, ICI)近年来在晚期恶性肿瘤治疗中发挥重要作用。传统的放化疗是直接杀灭肿瘤细胞, 而ICI是针对机体的免疫系统, 干扰肿瘤的免疫耐受及逃逸, 恢复效应T细胞特异性识别和杀伤肿瘤细胞的功能。PD-1/PD-L1通路是目前临床应用较多的ICI所作用的信号通路之一, 主要的PD-1/PD-L1抑制剂Nivolumab、Pembrolizumab及Atezolizumab等, 均已获得美国食品药品监督管理局的批准, 被证实在非小细胞肺癌、黑色素瘤、淋巴瘤、肾癌、胃癌、结直肠癌及肝癌等多种肿瘤中具有明显疗效[2]。
基于2/3期随机试验(KEYNOTE-010)的研究结果, 美国食品药品监督管理局(FDA)批准Pembrolizumab二线治疗PD-L1表达≥1%的转移性非小细胞肺癌。Herbst等[3]研究结果显示, 对于 PD-L1表达为1%~50%的既往含铂双药化疗后进展的患者, Pembrolizumab 2 mg/kg治疗组的中位PFS为3.9个月, 中位总生存期 (overall survival, OS)为10.4个月, 客观反应率为18%, Pembrolizumab 10 mg/kg治疗组的PFS为4.0个月, OS为12.7个月, 客观反应率为18%。两个剂量组间疗效差异无统计学意义(P>0.05)。Ott等[4]研究显示Pembrolizumab用于PD-L1表达≥1%的经治小细胞肺癌(SCLC)的客观缓解率为33%。本研究中, Pembrolizumab 的治疗剂量为2 mg/kg, 25例可评价疗效的转移性肺癌(非小细胞肺癌23例, 小细胞肺癌2例), 除1例患者为一线治疗外, 其余均为二线及二线以上治疗, 结果显示客观反应率为20.0%, 疾病控制率为76.0%, 中位PFS为5.1个月。
Naidoo等[5]研究结果显示Pembrolizumab单药治疗的不良反应主要为疲乏、皮疹, 分别占总不良反应的19%~35%、8%~24%。Reck等[6]研究结果显示 Pembrolizumab一线治疗晚期NSCLC免疫相关毒副反应发生率为29.2%, 其中免疫相关性肺炎的发生率为5.8%。本研究中, Pembrolizumab的副作用主要是疲乏、免疫相关性肺炎及发热。美国临床肿瘤协会(ASCO)和美国国家综合癌症网络(NCCN)指南提及了既往胸部放疗及吸烟对于免疫相关性肺炎发生的影响。Hwang等[7]纳入164例患者进行回顾性分析, 发现既往接受胸部放疗患者(73例)和未接受胸部放疗患者(91例)发生所有级别肺炎的比例分别为8.2%和5.5%, ≥2级肺炎的比率分别为4.1%和3.3%;而Shaverdian 等[8]研究发现, Pembrolizumab治疗后, 曾有胸部放疗史患者和无胸部放疗史患者发生治疗相关肺损伤比例分别为13%和1%。Naidoo等[9]研究发现在吸烟和未吸烟者中均有发生免疫相关性肺炎, 但迄今为止, 并没有研究比较吸烟人群和未吸烟人群的肺炎发生率。本研究中免疫相关性肺炎的发生率为21.4%(6/28), 6例考虑免疫相关性肺炎患者中, 5例有肺部放疗史, 提示免疫相关性肺炎可能与胸部放疗史有相关性;但仅2例有吸烟史, 未能支持吸烟者免疫相关性肺炎发生率高, 但本研究中, 样本量小, 值得进一步大样本的研究。心脏毒性属于罕见的免疫相关毒性, 包括心肌炎、心包炎、心律失常及心力衰竭等。
Asnani等[10]研究报道称, 终末期体力状态评分(performance status, PS)高或有感染等严重并发症的患者疗效欠佳, 可能与这部分患者的免疫系统不能对肿瘤产生相应的免疫应答有关。本研究中, 有3例患者于治疗1个月内因原发肿瘤进展、病情加重而死亡, 提示一般情况差的患者免疫治疗疗效欠佳。
Brody等[11]研究显示PD-L1高表达的转移性非小细胞肺癌(metastatic non-small cell lung cancer, mNSCLC)患者更能从抗PD-1治疗中获益。2018年6月ASCO会议上Gilberto Lopes报道了KEYNOTE-042的研究结果, 显示对PD-L1≥50%非小细胞肺癌患者, Pembrolizumab单药一线治疗能降低死亡风险31%, 而对于1%≤PD-L1<50%患者, 降低死亡风险8%。在不同的研究中, 小细胞肺癌肿瘤细胞PD-L1表达阳性的预测价值有所不同, 但小细胞肺癌具有较高的肿瘤突变负荷(TMB)。Antonia等[12]研究结果发现, 高TMB患者的客观反应率、PFS均高于低/中等TMB患者。
綜上所述, PD-1单抗Pembrolizumab是治疗晚期肺癌的一个重要手段, 但其疗效预测指标、不良反应及最佳应用模式值得进一步研究。
参考文献
[1] Rajan A, Kim C, Heery CR, et al. Nivolumab, anti-programmed death-1(PD-1) monoclonal antibody immunotherapy: role in advanced cancers. Hum Vaccin Immunother, 2016, 12(9):2219-2231.
[2] Khagi Y, Kurzrock R, Patel SP. Next generation predictive biomarkers for immune checkpoint inhibition. Cancer Metastasis Rev, 2017, 36(1):179-190.
[3] Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): A randomised controlled trial. Lancet, 2016, 387(10027):1540-1550.
[4] Ott PA, Elez E, Hiret S, et al. Pembrolizumab in Patients With Extensive-Stage Small-Cell Lung Cancer: Results From the Phase Ib KEYNOTE-028 Study. J Clin Oncol, 2017, 35(34):3823-3829.
[5] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1immune checkpoint antibodies. Ann Oncol, 2015, 26(12): 2375-2391.
[6] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med, 2016, 375(19):1823-1833.
[7] Hwang WL, Niemierko A, Hwang KL, et al. Clinical Outcomes in Patients With Metastatic Lung Cancer Treated With PD-1/PD-L1 Inhibitors and Thoracic Radiotherapy. JAMA Oncol, 2018, 4(2):253-255.
[8] Shaverdian N, Lisberg AE, Bornazyan K, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial. Lancet Oncol, 2017, 18(7):895-903.
[9] Naidoo J, Wang X, Woo KM, et al. Pneumonitis in Patients Treated With Anti-Programmed Death-1/Programmed Death Ligand 1 Therapy. J Clin Oncol, 2017, 35(7):709-717.
[10] Asnani A. Cardiotoxicity of Immunotherapy: Incidence, Diagnosis, and Management. Curr Oncol Rep, 2018, 20(6):44-50.
[11] Brody R, Zhang Y, Ballas M, et al. PD-L1 expression inadvanced NSCLC: insights into risk stratification andtreatment selection from a systematic literature review. Lung Cancer, 2017(112):200-215.
[12] Antonia SJ, López-Martin JA, Bendell J, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol, 2016, 17(7):883-895.
[收稿日期:2019-06-05]
- 黄芪中药制剂治疗糖尿病心肌病疗效的系统评价和Meta分析
- 从肝论治方药治疗2型糖尿病有效性和安全性的系统评价
- 肝阴虚证证候特点及辨证用药规律的文献研究
- 肾茶黄酮通过ERK/CT-1通路治疗急性肾衰模型鼠氧化应激的实验研究
- 糖肾煎对2型糖尿病肾病大鼠的肾保护实验研究
- 紫檀芪对博来霉素诱导的肺纤维化大鼠上皮间质转化的影响
- 益气化瘀散结方对胃癌SGC-7901细胞PI3K/AKt/Mtor信号通路的影响
- 基于网络药理学探讨加味过敏煎治疗荨麻疹的作用机制
- 中草药种植品质知识图谱的构建
- 2020中国国际服务贸易交易会康养旅游国际论坛在京举办
- 投稿须知:关于计量单位、统计符号、缩略语
- 聚焦肿瘤中西医药物的“精准配伍”
- 中医人张伯礼接受表彰
- 世界中联专家应邀向俄罗斯公众院介绍中医药抗击新冠肺炎的作用
- 基于“肺与大肠相表里”探析“通腑理肺法”对慢性功能性便秘的治疗进展
- 基于回顾性分析方法探索评价古代临床医家之方法研究
- 中成药欧盟注册分析
- 重症肺炎合并应激性溃疡出血的中医证候研究
- 先秦两汉简帛医书“补益剂”
- 基于文献可视化软件的中药治疗糖尿病足知识图谱分析
- 活动期类风湿关节炎中医证型与凝血/纤溶指标的相关性研究
- 电针辅助中药治疗子宫内膜异位症对肿瘤标志物水平的影响
- 隔药灸神阙八阵穴对术后粘连性肠梗阻患者疗效及炎性反应因子的影响
- 王维英治疗过敏性紫癜的临床经验浅析
- 舒肝明目汤于眼科病应用中所体现的异病同治思想
- seventeen
- seventeens
- seventeenth
- seventh
- sevenths
- seventh²
- seventh¹
- seventies
- seventieth
- seventy
- seventyfold
- seventyish
- sever
- severability
- several
- severalize
- severally
- severals
- severance
- severances
- severation
- prop sth up
- prop sth ↔ up
- propublication
- propublicity
- 投解
- 投詩賦
- 投诉
- 投诉率
- 投诉电话
- 投诚
- 投诚归附
- 投诚,归顺
- 投诸四裔
- 投谒
- 投谗
- 投资
- 投资主体
- 投资于知识,总能给出最高的利息
- 投资基金
- 投资少、赢利大
- 投资摩擦
- 投资气候
- 投资环境
- 投资移民
- 投资结构
- 投资者
- 投资资讯
- 投资银行
- 投资额