史文倩 黄花荣
【关键词】 Toll 样受体4;信号传导通路;哮喘
支气管哮喘是常见的、反复发作的气道免疫炎症性疾病,往往由多种因素所诱发,表现为气道的高反应性、发作性气道阻塞、肺功能减退等[1]。哮喘是由复杂的基因-免疫-环境等因素相互作用引起的[2]。Toll样受体(TLR)在炎症性和免疫性疾病中扮演着重要的角色,TLR通过固有免疫病原模式识别多种免疫细胞,启动非特异性免疫应答以消除病原体[3]。其中TLR4与哮喘的发生发展密切相关[4]。有研究表明,TLR能够引起炎症因子释放,抑制TLR4信号通路可有效降低TLR4相关炎性细胞因子的表达,这为哮喘的治疗提供了新的思路[5]。本文就TLR4信号传导通路的作用机制、TLR4信号转导通路与哮喘发病机制、靶向TLR4治疗哮喘的研究进展进行综述。
一、TLR4结构与功能
TLR属于模式识别受体(PRR),能够直接识别外来病原体及其产物或宿主畸变和衰老凋亡细胞某些共有特定模式分子结构。目前,在哺乳动物中发现了14种TLR,其中10种亚型在人类中表达,根据其分布部位可以分为胞膜型PRR和内体膜型PRR[6]。胞膜型PRR包括TLR1、TLR2、TLR4、TLR5、TLR6和TLR10,它们分布在细胞膜表面,主要识别脂质和蛋白质;内体膜型PRR包括TLR3、TLR7、TLR8和TLR9,它们分布在细胞器膜上,主要识别核酸。
1997年发现的TLR4是首个与髓样分化因子2(MD-2)、CD14、脂质结合蛋白(LBP)和放射性保护性105kDa蛋白(RP105)等多种共同受体同时存在的TLR成员[7]。TLR4为Ⅰ型跨膜糖蛋白,由胞内区、胞外区和跨膜区3部分组成。TLR4的N端,即胞外区包含大约16~28个亮氨酸富集重复序列(LRR),主要用来识别外源性病原体相关模式分子(PAMP)和内源性损伤相关分子模式(DAMP)。TLR4的C端,即胞内区包含一个结构相对保守的Toll/IL-1受体(TIR)结构域,负责起始胞内信号传导,引发下游适配器蛋白的招募[8-9]。
二、TLR4信号传导通路与生物学作用
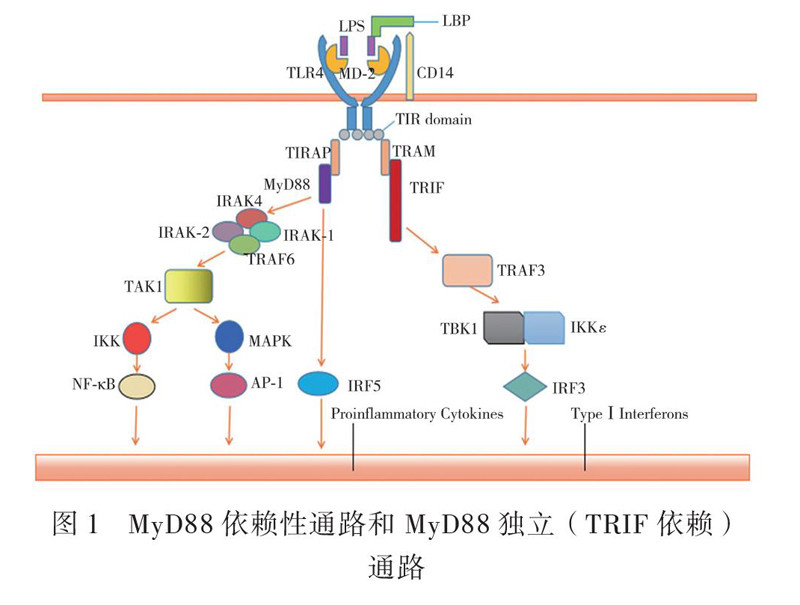
TLR4信号传导分为MyD88依赖和MyD88独立(TRIF依赖)通路。MyD88依赖通路负责促炎细胞因子的表达,而MyD88独立通路介导Ⅰ型IFN和IFN诱导基因的诱导[10]。
1. MyD88依赖通路
革兰阴性菌细胞壁外膜的脂多糖(LPS)是TLR4的特异性配体[11]。单纯转染TLR4不足以识别LPS,并且配体诱导的活化需要TLR4与细胞表面MD-2相结合[12]。MD-2与LPS相互作用,然后与TLR4的细胞外结构域非共价结合,形成TLR4/MD-2受体复合物[13]。LBP和CD14是增强LPS传感的辅助分子,LBP能够从聚集体中提取LPS单体并将其转移到CD14中,CD14受体通过膜结合形式结合单体LPS并将其转移到MD-2,促进六聚物复合物(TLR4/MD-2/LPS)2的形成,从而诱导含有TIR结构域的适配器蛋白的募集[14]。这些适配器通过TLR4细胞质尾部的TIR结构域与适配器上的TIR结构域之间的同质相互作用与TLR4簇相关联。
在LPS刺激下,MyD88依次募集并激活IL-1R受体相关激酶4(IRAK-4)、IRAK-1、TNF受体相关因子6(TRAF6)[15]。IRAK-4不仅负责招募、激活IRAK-1,还负责降解IRAK-1,IRAK-2也在LPS/TLR4信号传递中起作用[16-17]。TRAF6与泛素结合酶13(UBC13)、泛素结合酶E2变异体1异构体A(UEV1A)形成复合物,激活转化生长因子-β活化的蛋白激酶1(TAK1),然后TAK1激活下游IκB激酶(IKK)和丝裂原活化蛋白激酶(MAPK)通路。IKKα、IKKβ、IKKγ形成复合物催化IκB蛋白磷酸化,这种磷酸化导致IκB蛋白的降解和随后转录因子NF-κB的易位,进而引起IL-6、IL-12p40、TNF-α等多种炎症因子的表达[18]。下游MAPK途径的激活导致另一种转录因子AP-1的诱导,该因子在促炎细胞因子的表达中同样发挥了作用[19]。此外,IκBε和IFN调节因子5(IRF5)也是MyD88通路下游的2个重要因子。在LPS刺激下,缺乏IκBε的巨噬细胞对IL-6的表达有缺陷,而对TNF-α的表达正常。在IL-6的启动子区,IκBε可能与NF-κBp50亚基一起发挥作用[20]。以上就是TLR4的MyD88依赖通路,见图1。
2. MyD88独立(TRIF依赖)通路
该通路的激活发生在TLR4-MD2复合物内化后的内小体室。其激活涉及到TRIF相关适配器分子(TRAM)和含TIR结构域适配器诱导IFN-β(TRIF)的募集,TNF受体相关因子3(TRAF3)的激活,以及由TANK结合激酶1(TBK)和IKKε介导的IFN调节因子3(IRF3)核易位的诱导[21-22]。其中IRF3转录因子能够促进Ⅰ型IFN的产生,见图1。
3. TLR4信号传导通路触发因素
3.TLR4信号传导通路觸发因素除了识别外源性微生物PAMP外,TLR4还能识别内源性DAMP,TLR4的细胞内触发因素包括高迁移率族蛋白B1(HMGB1)和细胞热休克蛋白等,其中HMGB1与哮喘密切相关[23]。HMGB1是一种非组蛋白且普遍存在的染色体蛋白,在活性染色质中富集,是HMGB家族的一部分,由人的HMGB1基因(13q12)编码[24]。HMGB1可与TLR4结合激活NF-κB引起下游的炎症介质释放,有研究表明,阻断HMGB1活性能通过抑制气道炎症和调节肺成纤维细胞表型和激活来逆转气道重塑[25]。
4.TLR4参与载脂蛋白E(APOE)信号通路
APOE的主要功能是促进受体介导的内吞和脂蛋白颗粒(例如极低密度脂蛋白和乳糜微粒)及胆固醇向细胞内的转运,此外APOE还具有促炎和抗炎作用,这取决于APOE的浓度。在鼠螨引起的哮喘小鼠模型中,APOE基因敲除小鼠表现出增强的气道反应性和杯状细胞增生[26]。与健康受试者及COPD患者相比,哮喘患者血浆中的APOE降低,IL-33升高[27]。研究证明高水平的APOE信号通过TLR4激活TAK1和IκKβ,IκKβ磷酸化NF-κBp65和TPL2,进而磷酸化c-Jun氨基末端激酶(JNK),从而诱导人哮喘小气道上皮细胞(SAEC)分泌C-X-C基序趋化因子配体5(CXCL5)促进气道炎症[28]。
三、TLR4信号传导通路与哮喘发病机制
1. TLR4与“卫生假说”
Strachan提出了“卫生假说”,该假说提出儿童期减少接触传染性微生物会导致后期过敏性疾病风险增加。病原微生物能够促进免疫系统早期成熟,通过刺激1型辅助性T淋巴细胞(Th1)成熟,抑制Th2极化,最终降低IgE水平。相反,免疫成熟过程中的“干净”环境可能导致Th2持续存在。接触内毒素可能为“卫生假说”提供一种统一的机制。有研究表明,房屋灰尘和床垫灰尘中较高的内毒素水平与变态反应致敏和特应性哮喘的风险较低有关[29]。PRR识别内毒素,并通过由LPS、CD14、MD-2和TLR4形成的内毒素受体复合物激活先天免疫系统。这说明TLR4与“卫生假说”密切相关。
2. HMGB1与哮喘密切相关
2.HMGB1与哮喘密切相关HMGB1是一种高度保守的核蛋白,既可以由单核细胞、巨噬细胞和其他免疫细胞主动释放到细胞外,也可从受损的坏死组织细胞中被动释放,以促进多种炎症因子分泌[30]。此外,HMGB1还具有细胞外活性,即HMGB1能在内源性损伤相关分子模式中起作用,通过与晚期糖基化终产物受体(RAGE)和TLR相互作用,调节参与磷酸化和糖基化终产物合成的受体,这些受体导致某些细胞因子如TNF-α、IL-4和IL-6的增加[31]。研究表明HMGB1与RAGE、TLR2和TLR4的相互作用会激活MAPK和NF-κB的细胞内信号,引起促炎性细胞因子的激活和释放[32]。
3. TLR4基因多态性与哮喘发生的风险
大量研究表明TLR2、TLR4和TLR9与哮喘或特应性疾病的发病机制有关[33]。TLR4多态性可以改变儿童的先天免疫反应,并可能是哮喘发展的重要决定因素。CD14通过促进LPS向TLR4的表达促进免疫激活,这会触发IL-12和IL-18的信号传导以及IFN产生。研究表明该反应受遗传控制,由Asp299Gly(核苷酸取代896A>G)组成的TLR4基因(染色体9q32-33)中的单核苷酸多态性(SNP)与吸入内毒素攻击的反应性低下,气道上皮中TLR4的密度降低以及炎癥细胞因子对内毒素的反应减少有关[34]。这种多态性改变了受体对内毒素的反应,这是哮喘的重要诱因。
北美的研究者检测了TLR4在哮喘中的多态性,在研究中对TLR4基因进行了筛选,共发现了29个SNP[35]。TLR4Asp299Gly等位基因与较高的革兰阴性菌感染发生率有关,这可能有助于特应性儿童哮喘的发展[36]。TLR4Asp299Gly多态性还与儿童外周血单核细胞(PBMC)降低LPS诱导的IL-12(p70)和IL-10反应有关[37]。在携带TLR4Asp299Gly等位基因的人群中,特应性疾病的严重性升高,这表明TLR4Asp299Gly多态性导致先天免疫系统的反应降低,由此可见TLR4基因多态性与哮喘患者的特应性严重程度呈正相关[38]。除此之外,TLR2中的rs3804099和TLR4中的rs4986791也会导致罹患哮喘的风险增加[39]。
4.靶向TLR4及其信号通路治疗哮喘的价值
目前哮喘治疗的目的是尽量减少药物不良反应,并实现良好的哮喘控制,然而对于重症哮喘患者,目前还没有最佳治疗方法。免疫性疾病的抗免疫治疗已由广泛的抗炎治疗转为靶点治疗,TLR4及其信号通路为哮喘的治疗提供了多个新的潜在治疗靶点,如TLR4拮抗剂、抗LPS多肽、抗HMGB1抗体等。
将TLR4拮抗剂TAK-242注入卵清白蛋白(OVA)诱导的小鼠腹腔内发现,TAK-242能够降低小鼠鼻灌洗液中Th2细胞因子的水平,减少支气管肺泡灌洗液中的嗜酸性粒细胞和肺中Th2的数量[40]。沙格列汀是一种二肽基肽酶4抑制剂,已被广泛应用于治疗2型糖尿病。研究发现沙格列汀可以通过抑制TLR4/活性氧簇/NF-κB信号通路有效减轻OVA诱发哮喘小鼠的气道炎症,降低小鼠肺组织中的氧化应激以及NF-κB和TLR4的水平,这表明沙格列汀可能成为有效治疗急性过敏性哮喘的潜在药物[41]。白藜芦醇是存在于葡萄皮、浆果和坚果中的一种植物多酚物质[42]。白藜芦醇的有益作用已在肺纤维化、COPD、肺动脉高压和其他肺部疾病中得到证实[43-44]。有研究表明,大剂量的白藜芦醇通过抑制HMGB1/TLR4/NFκB途径释放的炎性细胞因子,减轻哮喘诱导的气道炎症和气道重塑,这为白藜芦醇作为潜在的新型哮喘治疗方法提供了证据[45]。丹皮酚降低了小鼠TLR4的表达和NFκB的核易位,以及哮喘模型中p38丝裂原活化蛋白激酶(p38MAPK)和细胞外调节蛋白激酶(ERK)的磷酸化水平,通过抑制TLR4/NFκB和MAPK信号通路改善OVA诱导的哮喘[46]。抗HMGB1抗体能够减少邻苯二甲酸二异壬酯诱导的哮喘小鼠的Th2细胞因子、炎性细胞积累、黏蛋白产生,减轻气道高反应性及肺组织损伤[47]。
四、结语
TLR4信号传导通路作为机体免疫功能的一部分,与炎症性和免疫性疾病的发生发展密不可分,在支气管哮喘的发生发展中起着重要的作用。TLR4信号传导通路存在多个治疗哮喘的潜在靶点,针对TLR4信号传导通路靶点的靶向治疗,为哮喘的治疗提供了一个新的研究方向,有着良好的研究前景。CC趋化因子受体5(CCR5)能够调控T细胞和单核细胞/巨噬细胞系的迁移、增殖与免疫功能,但其与TLR4信号传导通路的关系未见相关报道[48]。笔者课题组先前发现在哮喘小鼠体内应用CCR5第二胞外环的拮抗短肽能有效减轻哮喘小鼠肺组织的炎症程度,抑制TNF-α的表达[49]。TLR4信号传导通路的激活能引起TNF-α、IL-4和IL-6等炎性细胞因子的释放,CCR5拮抗剂是否能够调控TLR4信号传导通路缓解哮喘炎症反应值得进一步探究。
- 对龙门石窟中音乐图像资料的分析与研究
- 千年编钟的上下求索之路
- 声乐演唱与钢琴伴奏的配合问题探析
- 藏族歌曲的演唱风格及演唱技巧
- 论发展群众文化舞蹈辅导的方式创新
- 浅谈新时期舞蹈编导素质的提升
- 中国舞蹈编导中编舞技法的有效途径
- 论湘西地区苗族仪式性舞蹈的文化特征
- 湖北土家族民间舞“滚龙连厢”在学院派民间舞表演中的动律及技巧性
- 浅析“导引术”在现代舞训练中的运用
- 以“安塞腰鼓”为例探讨民间舞蹈的艺术传承
- 蒙古博歌舞与草原文化大传统的关系阐释
- 翻译服务译文质量管理中提升客户满意度的策略研究
- 《了不起的盖茨比》的盖茨比形象分析
- 《过故人庄》索隐
- 新媒体语境下互联网短视频的传播优势分析
- 农村生态卫生间设计研究
- 李叔同已有研究综述
- 论当代小说影像化叙事的听觉化特征
- 关于太和县书画产业化发展的思考
- 谈大型晚会策划与统筹
- “诗界革命”:中国文化的自省与自救
- 置身于重重阻碍下的黑暗
- 《万叶集》中秋季冬季的节日文化与审美阐释
- 《熵》:城市书写理论下的“熵化空间”
- runners-up
- runner-up
- runner up
- runner-ups
- runnier
- runniest
- runniness
- running
- running commentary
- runningcost
- running cost
- running costs
- running down
- runningly
- running off
- running out
- non-musical
- nonmusical
- nonmusically
- nonmusicalness
- nonmusicalnesses
- nonmusician
- nonmusicians
- non-muslim
- non-muslims
- 可就
- 可就近取法
- 可展曲面
- 可巧
- 可幡
- 可庆的时运
- 可式
- 可得
- 可心
- 可心如意
- 可念
- 可怒而不怒,奸臣乃作;可杀而不杀,大贼乃发
- 可怕
- 可怕 可憎 可笑
- 可怕的梦
- 可怕的气势
- 可怕的遭遇
- 可怕难办的事
- 可怜
- 可怜不得
- 可怜亦复可笑
- 可怜兮兮
- 可怜天下父母心
- 可怜宵
- 可怜巴巴