王凤
《普通高中化学课程标准(2017年版)》重视开展“素养为本”的教学,倡导真实问题情境的创设.情境下设置问题,不仅仅是为了引入问题,激发学生的学习兴趣,更重要的是要立足素质教育,发挥情境的作用,追求知识背后的价值,同时实现教学方法的改革与创新,积极落实新课程理念.
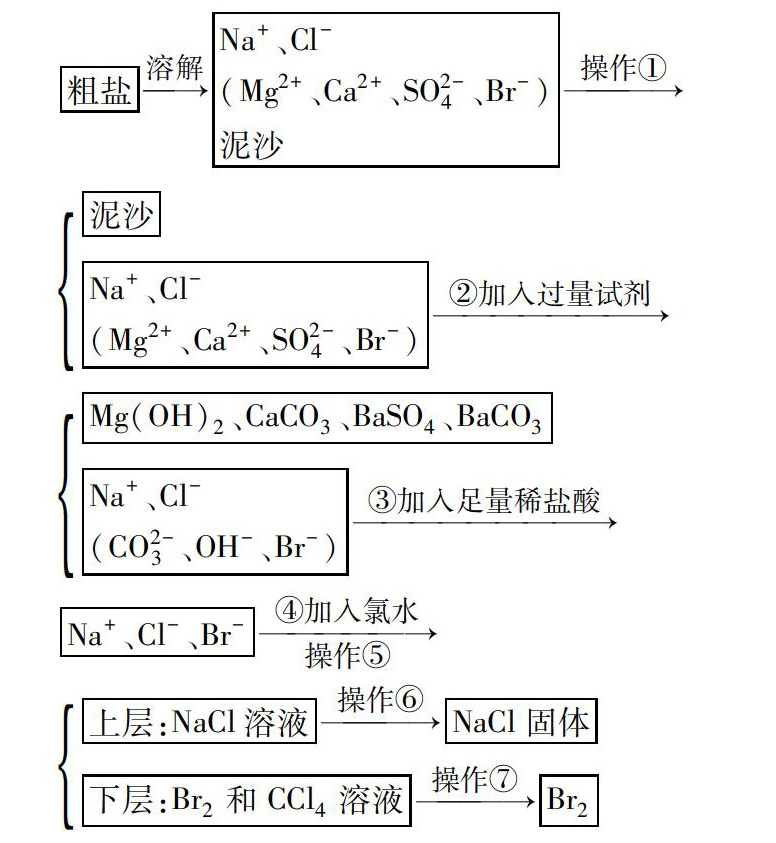
听了一節高一复习化学课,题目是《物质的分离与提纯》,副标题是“从海水到食盐有多远”.具体流程如下:
1.投影展示生产链
粗盐溶解
Na+、Cl-(Mg2+、Ca2+、SO2-4、Br-)泥沙操作①
泥沙Na+、Cl-(Mg2+、Ca2+、SO2-4、Br-)②加入过量试剂
Mg(OH)2、CaCO3、BaSO4、BaCO3
Na+、Cl-(CO2-3、OH-、Br-)③加入足量稀盐酸
Na+、Cl-、Br-④加入氯水操作⑤
上层:NaCl溶液操作⑥NaCl固体
下层:Br2和CCl4溶液操作⑦Br2
2.设置问题:
流程图中的操作①为,该操作中用到的玻璃仪器有;②中加入的试剂及滴加顺序;操作⑤为,萃取剂选择条件,分液注意事项;操作⑥为,该操作的依据;操作⑦为该操作中用到的仪器有,注意事项.
3.问题的解决(略).
一、问题的提出
这节课设计的意图是以海水中提取食盐为情景,复习涉及的操作,巩固知识的同时,发展学生的素养,符合新课程的理念.但问题是新课程理念倡导的是真实的问题情境,这就出现了下面的问题:
(1)副标题是“从海水到食盐有多远”,但整个流程图展示的是实验室进行的粗盐提纯.
(2)工业上真的是用氯水置换出Br-,再用CCl4萃取,蒸馏得到Br2吗?
二、问题的分析
很显然,副标题与整个流程设计不匹配,应改成“实验室内粗盐提纯的方法”.关于工业上制备溴,苏教版《必修一》是这样描述的:“从海水中提取溴,通常是将氯气通入提取粗食盐后的母液中,将溶液中的溴离子转化为溴单质.生成的溴单质仍然溶解在水中,鼓入热空气或水蒸气,使溴从溶液中挥发出来,冷凝后得到粗溴,精制粗溴可得到高纯度的溴单质”.从这段话中明显看出,工业上制备溴用的是提取粗食盐后的母液,不是粗盐精制过程中得到的溶液.关于如何进行溴单质的制备,不可能用CCl4萃取溴水,再蒸馏,主要原因是CCl4有毒,是致癌物质,易挥发,污染大,成本高.那工业上是如何进行粗溴的提纯呢?一般的制取精溴工艺为:将吹出工序得到的氢溴酸富集液经氧化、蒸馏后得到粗溴,粗溴冷却后进入精馏塔,然后用蒸汽进行多次精馏提纯,再经冷却和分离制取精溴.
三、教学反思
真实情境是指在真实世界中捕获的与学生生活环境、知识背景相关的,有社会现实意义的物质或现象.选择学生身边熟知的真实情境,开展以化学实验为主的多种探究活动,是推动学生主动走近核心素养的重要途径,值得广大化学教师孜孜追求.真实情境蕴藏的化学知识源于教材,教学的落点也是回归教材,但教学的价值是超越教材的.有的教师由于自身对真实情境的理解不够,甚至会传递给学生错误的知识.例如,在讲解原电池时,教师常用这则故事:格林太太镶有两颗假牙,第一颗是黄金的,第二颗是不锈钢的.令人百思不解的是,自从镶上假牙后,格林太太经常头疼,夜间失眠,讨论是什么原因?结论是:金和不锈钢用作假牙材料,因两种金属的活泼性不同,在口腔中可形成原电池反应而导致头疼,心情烦躁等,如治疗该疾病,应用不能形成原电池反应的材质用作假牙材料.事实果真如此吗?唾液的酸性极弱,形成不了原电池,即使有电流产生,也是极其微弱的,也不可能产生上述问题,所以这个情境是虚假的.像这样,有些教师为了课堂需要,不合实际地自设情境,必然不利于引导学生正确理解知识与社会的关系,因此,实际教学中教师必须正确树立科学教育观念.
- 生物教学OES课堂教学模式探究
- 陶行知教育理念下的美术教学策略探究
- 农村学校信息技术教学中的机器人教学探研
- 高中化学教学中学生环保意识的强化研究
- 试论高效科学课堂打造的“三板斧”
- 高中英语任务型写作教学探究
- 数学课堂分层差异教学路径探讨
- 英语核心素养视域下绘本教学法的运用探究
- 基于以趣引路的数学教学策略探讨
- 数学新授课自主课堂教学模式的构建探析
- 中学语文写作教学策略漫谈
- 中小学疫情防控期间居家劳动教育实践研究
- 初中计算机教学中的问题及其对策探讨
- 诗歌教学的有效策略探研
- 农村幼儿早期阅读能力培养策略探研
- 物理实验教学中学生观察与思维能力培养探研
- 新课标下英语互动式课堂实施策略研究
- 追寻思维生长的英语复习课堂探究
- 高中化学教学中学生阅读障碍的原因与对策研究
- 文化品格素养在英语教学中的渗透例谈
- 高中英语阅读教学改进策略的思考
- 基于核心素养的学生自主发展能力培养探赜
- 生本理念下学生空间观念的培养探索
- 类比在数学教学中的应用探微
- 学生古诗词阅读能力培养刍探
- ransomers
- ransoming
- ransomless
- ransoms
- ransoms'
- rant
- ranted
- ranters
- ran-through
- ranting
- rantingly
- rants
- ranty
- ran-up
- rap
- rapable
- rape
- rapeable
- raped
- raper
- raper's
- rapers
- rapes
- rape²
- rape¹
- 雅书
- 雅事
- 雅亮
- 雅人
- 雅人名士清谈的场所
- 雅人深致
- 雅什
- 雅令
- 雅以为美
- 雅会
- 雅伟
- 雅体
- 雅俏
- 雅俗
- 雅俗共赏
- 雅俗通十五音
- 雅信
- 雅克萨
- 雅克萨之战
- 雅兴
- 雅典
- 雅典卫城
- 雅典娜
- 雅典海军之父
- 雅典的第一公民