摘要:按人教版化学教材中铝的燃烧、铁的吸氧腐蚀等实验步骤完成实验,现象不够明显。本探究实验从化学反应原理出发,以钠、铝、铁与氧气反应为例,通过增大反应物接触面积、增大反应物浓度以及升高温度等改进措施,促使化学反应速率加快,反应现象更明显,便于学生观察和理解,提高了教学效果。
关键词:钠、铝、铁与氧气反应;实验改进;实验探究
文章编号:1005–6629(2015)8–0046–02 中图分类号:G633.8 文献标识码:B
宋心琦教授主编的人民教育出版社出版的化学教材《化学1》(必修)中加热铝箔的实验[1],因为铝极易与氧气反应,形成氧化膜保护了内层的铝,使得铝与氧气的进一步反应难以进行,学生对比初中铁在氧气中燃烧的实验,易形成铁比铝活泼的错误印象。《化学反应原理》(选修4)中铁的吸氧腐蚀实验[2],由于试管中氧气含量较少,反应速度较慢,在短时间内很难看到明显现象,若教师在课堂演示会占用较长时间,影响教学效果。针对以上部分金属与氧气反应的速率较慢问题,本文从化学反应原理角度出发,以增大铝、铁等金属的表面积,增加氧气浓度,适当提高反应温度等措施,改进教材中相关实验。
1 扇风点火——钠的燃烧
1.1 实验用品
钠;镊子、玻璃片、滤纸、小刀、硬质玻璃管、酒精灯、铁架台、硬纸板
1.2 实验过程
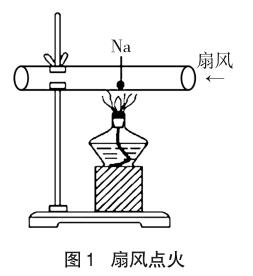
①将两端开口的硬质玻璃管水平固定在铁架台上,如图1所示。②用镊子取出一小块钠,放在玻璃片上,用滤纸吸干表面的煤油,再用小刀迅速地切掉钠表面的氧化层,取一小粒放入硬质玻璃管内。③点燃酒精灯并加热硬质玻璃管,当看到钠变成银白色小球时,熄灭酒精灯,再用硬纸板对着硬质玻璃管管口扇风。
现象:熄灭酒精灯后,用硬纸板扇风,钠剧烈燃烧,呈现黄色火焰,并且扇风的力度不同,黄色火焰的大小也不同,最后生成淡黄色固体。
解释:对硬质玻璃管管口扇风,加快玻璃管内空气流动,提高了钠与氧气反应的速率,使反应现象更剧烈。
1.3 实验设计意图
钠的燃烧实验速率本身较快,但相较于人教版《化学1》第47页实验3-2[3],“扇风点火”的实验设计可加深学生对钠与氧气反应的感性认识,同时又增强了实验的趣味性。
2 铝的燃烧
2.1 实验用品
铝粉;药匙、滤纸、坩埚钳、酒精灯、含氧气的集气瓶
2.2 实验过程
实验1:①用药匙取铝粉少许置于燃着的酒精灯上方,两者要相隔适当距离。②用另一只手轻拍持药匙的手的手腕,使极少量的铝粉落在酒精灯的火焰上。
现象:酒精灯火焰变大,铝粉剧烈燃烧,发出耀眼的白光。
解释:铝粉与空气的接触面积大,酒精灯外焰温度高,铝与空气中氧气剧烈反应。
实验2:①先将铝粉与适量的胶水混合,均匀涂在滤纸上,晾干备用。②再将晾干的滤纸剪成条状,制成含铝粉的滤纸条,如图2所示。③用坩埚钳夹取滤纸条,在酒精灯上点燃后伸入含氧气的集气瓶中。

现象:剧烈燃烧,发出耀眼的白光。
解释:集气瓶中氧气浓度高,铝粉与氧气的接触面积大,铝与瓶中氧气剧烈反应。
2.3 实验设计意图
铝粉和滤纸是实验室常规用品,只需简单加工就能使用,并且增强了实验效果;使用含铝粉的滤纸条,相比人教版化学1第48页实验[4],其实验现象给学生感官刺激更强烈。
3 铁的吸氧腐蚀
3.1 实验用品
铁粉、石蕊溶液、饱和食盐水、H2O2溶液、MnO2;具支试管、自制细U型导管、止水夹等
3.2 实验过程
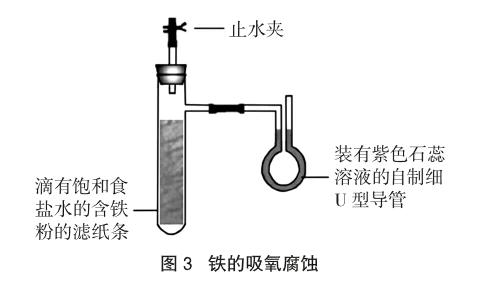
①按图3组装好仪器[5]。关闭止水夹,向自制细U型导管中加入紫色石蕊溶液,至U型导管右端液面高于左端,观察一段时间后两端液面高度差保持不变,表明装置气密性良好。②将滴有饱和食盐水的含铁粉的滤纸条(制作方法与图2所示一致)放入具支试管中。③打开止水夹,调节U型导管两端液面相平,再关闭止水夹,观察现象。④另取一支具支试管,收集一试管氧气(可用H2O2溶液和MnO2反应制取),将滴有饱和食盐水的含铁粉的滤纸条放入具支试管中,组装好仪器。⑤重复操作③,再观察现象。⑥重复操作③可多次观察现象。
现象:用空气实验,可看到U型管左端液面升高,右端液面下降,短时间内两端有明显液面差;用氧气实验,相同时间内U型管两端液面差比前者大;几分钟后,两实验的滤纸条上都有红褐色的物质产生,都说明了铁吸氧腐蚀的发生。
解释:铁与试管中的氧气发生了吸氧腐蚀反应,减小了试管内气体压强,大气压将U型导管右端的石蕊溶液压到左端,形成液面差。
3.3 实验设计意图
使用自制的细U型导管及紫色石蕊溶液,相比人教版《化学反应原理》第85页实验[6],液面的升降现象对比明显,便于观察。而且只需要打开止水夹调节液面重新相平,便可多次重复实验,实用性强;用氧气和空气做对比实验,液面差变化快慢和高低不一样,充分说明氧气参与了电极反应;铁粉表面积大,增大了铁与氧气的接触面积,氧气浓度的增大,均加快了铁吸氧腐蚀的速率,实验可在短时间内完成。
以上几个改进实验中,将金属箔片等制成粉末状,增大了金属与氧气的接触面积;加快空气对流或直接增加氧气的浓度,增加了单位体积内活化分子的数目[7];升高温度,加快了反应物分子的运动,同时增加了活化分子的百分数[8]。这些措施都在一定程度上增加了单位时间、单位体积内反应物分子的有效碰撞的频率[9],导致反应速率加快。
综上所述,利用身边廉价易得材料,应用化学知识,对教材实验做合理改进,在满足实验的准确性和安全性的同时,又提高了实验的效率和趣味性,是一种不错的尝试。
参考文献:
[1][3][4]宋心琦主编.普通高中课程标准实验教科书·化学1(必修)(第三版)[M].北京:人民教育出版社,2007:47~48.
[2][6]宋心琦主编.普通高中课程标准实验教科书·化学反应原理(选修4)(第三版)[M].北京:人民教育出版社,2007:85.
[5]孙旭.新课程高中化学实验全解[M].武汉:湖北教育出版社,2014:158~160.
[7][8][9]曹锡章等.无机化学(上册)(第三版)[M].北京:高等教育出版社,1994:287~295.
- 教科研助力我成长
- 三级导师制
- 小学数学应用问题模型构建的实践与探索
- 扎实推进教育科学研究 优先服务学校内涵发展
- “基础教育治理现代化”专题座谈会综述
- 治理的意蕴:转变教育发展范式
- 构建文化育人的德育工作新体系
- 困境中挣扎的小学体育
- 探寻递进式音乐欣赏活动的有效策略
- 《艺术课程标准(修订稿)》述评
- 集群模式推进区域教育治理现代化
- 创新教育治理机制 促进县域农村教育发展
- 八项改革综合推动学校治理能力现代化建设
- 校长应坚持听课评课
- 科技特色:学校文化建设的选择与建构
- 抓实抓好学校三项基础管理
- 依法办学 规范管理 加快现代学校建设进程
- 完善激励机制 加强教师队伍建设
- 践行开放式教育培养品学兼优学生
- 学生课堂“插话”有感
- 对话雷夫 感悟教育
- 班主任要有爱心 更要有智慧
- 构建问题导学型课堂 实现教育本质转变
- 摭谈建构庄义学习理论对历史教学的指导作用
- 小组合作学习:实现课堂高效的重要手段
- gauzy
- gave
- gave-in
- gave-off
- gave out
- gave-out
- gave up
- gawk
- gawked
- gawker
- gawkers
- gawkier
- gawkies
- gawkiest
- gawkily
- gawkiness
- gawkinesses
- gawking
- gawks
- gawky
- gawp
- gawped
- gawper
- gawpers
- gawping
- 没个头儿
- 没个深浅
- 没个满的日子
- 没个痕迹
- 没主心骨
- 没主见
- 没主见,附合他人
- 没主见,随大流
- 没了主心骨
- 没了去向
- 没了头的苍蝇——乱撞一气
- 没了对儿
- 没了帮腔的
- 没了捆儿
- 没了期
- 没了气了
- 没了气儿
- 没了王屠,连毛吃猪
- 没了缨儿
- 没了缨(影)儿
- 没了缨(影)儿了
- 没了鱼儿,就想虾儿
- 没事
- 没事不找事,有事不怕事
- 没事不登三宝殿