摘要:为完善教材中乙醇催化氧化的实验方法,在对一种改进方法实践的基础上,探究了实验中无水CuSO4的制备、催化剂铜丝的选择、乙醇与无水CuSO4的最佳加入量等问题。同时为了优化实验,对其冷凝方式和加热仪器也进行了改进。
关键词:乙醇催化氧化;无水CuSO4制备;冷凝方式;加热仪器;实验探究
文章编号:1005–6629(2017)3–0077–03 中图分类号:G633.8 文献标识码:B
乙醇的催化氧化反应是人教版必修二第三章第三节“生活中两种常见的有机物”中的重要内容[1]。为了让学生在学习这一部分内容时,能对反应现象和产物有更直观的观察和认知,在进行这部分内容的教学设计之初,笔者就查阅了大量有关该实验的文章,了解了很多乙醇催化氧化的实验方法。其中一篇在《化学教学》2014年第10期上发表的“乙醇催化氧化反应实验的再改进”的文章[2]引人关注,该文主要围绕以下三点对教材实验进行了改进:(1)使用无水CuSO4,利用白色无水CuSO4遇水变蓝的特性,说明反应有水生成。(2)减少乙醇用量,利用炽热铜丝接触少量乙醇产生的乙醇蒸气在铜丝表面发生反应,使产生的刺激性气味更加明显。(3)使用橡皮塞塞住试管,减少了生成物逸出[3]。文中装置如图1所示。
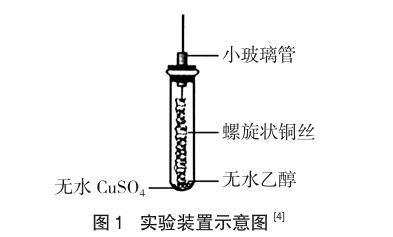
认真阅读分析后认为:上述的实验改进方法很好,若将其运用到实际教学中,将能有效地完善教材中演示实验方法的不足。
在这一动机的驱动下,对该文所提的实验方法进行了实践。按照文章中所描述的实验过程,为了能达到该实验的最佳效果,进行了反复多次实验。经历了不断地遇到问题、探究问题、解决问题及实验的优化改进等过程后,更加深了对该实验的理解,现将实验过程中出现的问题及一些具体做法描述如下。
1 无水CuSO4的制备
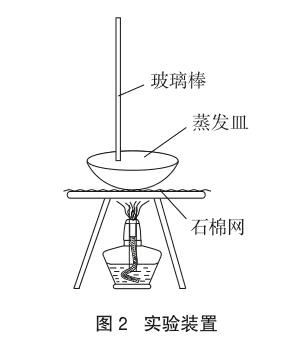
实验中需要利用CuSO4·5H2O加热制取白色无水CuSO4。实验之初,用蒸发皿加入CuSO4·5H2O,直接在酒精灯上加热。加热一段时间后,发现得到的无水CuSO4颜色并不是像我们平时熟知的白色,而是有一些偏灰色,并且在加热的过程中,还产生了刺激性的气味。查阅相关资料,得知CuSO4·5H2O加热至650℃时,可分解为CuO和SO3气体。了解了这个原因后,再次实验时,对之前的制取方法做了一些调整:为了降低蒸发皿的受热温度,先加上石棉网,再将蒸发皿放在石棉网上进行加热(如图2所示)。为了防止蒸发皿底部的CuSO4·5H2O分解产生水时结块,确保所有的CuSO4·5H2O能够均匀地受热分解,在加热过程中,还要用玻璃棒不停地进行搅拌,通过这样处理后,基本上得到了白色的无水CuSO4。
2 催化剂铜丝的选取
由于多次实验均未得到文章中所描述的无水CuSO4明显变蓝的现象,估计是因为水的产生量过少,才导致了这一现象不明显。实验中的水是由乙醇与氧化铜发生氧化还原反应产生的,如果在反应时能提高乙醇与氧化铜的接触面积,可能会增加水的产生量。接下来在具体操作中,从增加铜丝匝数和选择不同粗细的铜丝展开了实验。
通过多次对比实验,发现利用物理电学实验中使用的漆包线效果最好。将其绑在一根带橡皮塞的铁丝上,螺旋缠绕到大约7cm长,再依次按照文章中描述的方法进行实验,经过了3次重复实验后,无水CuSO4外围终于出现了明显的变蓝现象。需要注意的是,在使用漆包线做实验时,由于其外层有绝缘漆,在进行实验前需加热燃烧除尽。
3 乙醇与无水CuSO4的最佳加入量
在多次的实验摸索中,发现无水CuSO4加入量为1小药匙(大约1克),刚好覆盖住试管的底部[5],乙醇的使用量如作者所描述,以10滴(0.5mL)为宜[6]。在滴加过程中,将乙醇尽量滴至试管底部无水CuSO4的中心位置,保持周边无水CuSO4干燥,当冷凝水沿试管壁流向试管底部时,周边无水CuSO4变蓝与中间白色的CuSO4能够形成强烈的对比效果。
按照该文的实验改进方法,通过反复的实验探究,终于较为明显地做出了文中描述的实验现象[7]。具体现象如下:铜丝自下而上迅速由黑变为红色,经过一段时间,试管温度降低,有液体冷凝回流至试管底部,底部白色的无水CuSO4边缘出现少量蓝色(若想得到更为明显的实验对比效果,则需要重复实验2~3次),打开橡皮塞,闻到了较为明显的刺激性气味。
4 实验的再改进
4.1 出现的问题
由于一味地寻求增加水的产生量,将铜丝匝数增加得比较多,因此产生了一些负面影响。铜丝量过大,加热时铜丝温度过高,加之该反应也是放热反应,两方面温度因素叠加,导致试管底部温度过高,使无水CuSO4和生成的水之间形成了一个高温区域,阻碍了水与无水CuSO4的结合。甚至在好几次实验过程中,还出现了由于试管内部温度过高,导致气体压强过大,将螺旋状铜丝上的橡皮塞冲出试管的情况。在实验中为了观察无水CuSO4变蓝,需要等试管内温度降低,由于进行的是空气中的热交换,因而导致实验等待时间过长,影响了教学任务的完成,在课堂教学的运用上存在一定的困难。
4.2 问题的处理
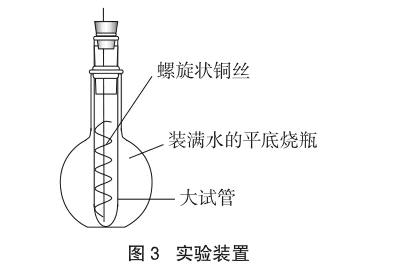
如何迅速地将反应后的试管温度降下来,从而缩短实验时间,就成为亟待解决的问题。一开始笔者用冷毛巾包裹在试管的上方,发现起到了一点作用,但效果不太好,而且由于毛巾的遮挡,不利于学生观察实验现象。进一步思考意识到,这个问题的实质就是如何快速将反应中产生的水冷凝,与无水CuSO4结合生成CuSO4·5H2O。按照常规冷凝方法思考,一是利用空气冷凝,显然效果不好;二是采用水冷凝管的冷凝原理,在热的气体周围营造一个冷水環境。受此启发,采用了将试管放入一个装满水的平底烧瓶中,再插入炽热铜丝的方法(装置如图3所示)。这个方法使用后,产生了非常明显的冷凝效果,实验时间明显缩短,且不需要多次反复进行,学生甚至可以看到试管壁上有水滴流下,试管底部的白色无水CuSO4迅速变蓝,试管内的乙醛气味也相当明显。
4.3 问题的再完善
随着冷凝效果的提升,问题又随之而来。由于冷凝过快,本身利用酒精灯加热的铜丝在未参与反应前温度就开始下降,直接影响了该反应的进程,甚至有好几次实验由于温度较低,出现了反应几乎不能发生的情况。一边是需要高温促进反应的发生,一边又需要在反应进行后迅速冷凝降低温度,这确实是一件非常矛盾的事情。如何在二者之间寻求一个平衡?一个偶然的机会,看到一位老师做的实验使用了三芯酒精灯来提高反应的温度,通过实际操作发现使用三芯酒精灯加热铜丝进行后续实验,不但加快了铜丝的加热速度,还能够有效地克服冷凝带来的负面影响,确保了实验开始所需温度,使实验的成功率和实验效果得到了进一步的提升。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学2[M].北京:人民教育出版社,2007:74~75.
[2][3][4][6][7]宋志贵.乙醇催化氧化反应实验的再改进[J].化学教学,2014,(10):50~51.
[5]潘虹,杜文敏,朱华英,刘怀乐.乙醇氧化反应实验的再认识[J].化学教学,2016,(5):58~60.
- 加强高校思想政治教育理论与实践研究
- 以“中国立场”推进比较思想政治教育学的发展
- 概率模型方法在积分计算中的运用
- 面向职业能力培养的高职英语教学路径分析
- 浅谈新工科信息与计算科学专业人才培养模式的创新创业管理保证体系
- 探讨推动在校大学生国际交流活动的策略
- 浅谈中国矿业大学银川学院工程管理自治区级特色专业建设及发展历程
- “大思政”视角下云南省高校思想政治理论课教学资源共建共享路径研究
- 贫困大学生就业指导意义、原则及策略分析
- PBL教学模式中茶文化与商务英语口语教学的融合
- 工程硕士培养加强工程伦理教育的几点思考
- 浅谈语文阅读教学凸显“语文味”的有效方法
- 基于“学习任务群”的群文阅读教学
- 春风化雨润物无声
- 初探信息化教学下中职学前心理学合作学习的有效性
- 二胎,“大宝”夺爱大战
- 转型背景下的中职教育资源承载力省思
- 跨文化视角下当代商务英语文化翻译策略
- 焙烤食品加工企业生产实际教学案例库建设的研究
- 探讨议大学生就业现状和就业指导机制改革
- 浅析GS重点工作管理系统的建设
- 《三次科技革命和经济全球化发展》教学反思
- 就业困难形势下考研利与弊的理性探究
- 辽宁省县域经济发展对人才结构需求的调查研究
- 阅读教学在小学语文教学中的有效性分析
- moneybroker
- money broker
- moneycentrebank
- money centre bank
- money doesn't grow on trees
- money down the drain
- moneyest
- moneyfund
- money fund
- moneygrubbing
- money is no object
- money launderer
- money laundering
- moneylaundering
- moneylender
- money loser
- moneyloser
- moneymaker
- moneymaking
- money management
- moneymanagement
- money manager
- moneymanager
- money market
- moneymarket
- 对教师的敬称
- 对数
- 对数函数
- 对数字
- 对数频标
- 对敲
- 对整个世界的根本看法
- 对整个局势没有关系或没有影响
- 对文
- 对文人咬文嚼字的讽刺语
- 对文会意
- 对文化和知识分子的摧残
- 对文字随意修改
- 对文章和作品进行多次精心的修改
- 对文章或人的评语
- 对文章或作品进行删改加工
- 对文艺作品或人的言论、行为非常赞赏
- 对新居落成的祝贺
- 对新环境不熟悉
- 对方
- 对方1
- 对方2
- 对方嘱托
- 对方寄来的书信或诗文
- 对方没有明说,心里已经领会