朱裕敏 刘荭 毛明光
摘要:神经坏死病毒(nervous necrosis virus,NNV)主要分布在地中海和太平洋西海岸,已在120多种鱼中被检测到,能引起鱼类病毒性神经坏死病(viral nervous necrosis,VNN),是对海水鱼类危害重大的病原之一。目前,随着神经坏死病毒的基因序列、类型、诊断和预防技术等方面研究的不断深入,其致病机理的报道也越来越多。本文概述了病毒附着、致病基因、细胞凋亡以及免疫逃避等几个方面的研究现状。
关键词:神经坏死病毒;致病机理;免疫逃避;凋亡
中图分类号:S941.419
20世纪80年代末,澳大利亚地区尖吻鲈(Lates calcarifer)幼鱼出现大量死亡现象,Glazebrook等[1]在死亡幼鱼的中枢神经中检测到一种不具囊膜的病毒,这是NNV的首次被报道;同时期,日本科学家Yoshikoshi和Inoue[2]在死亡的条石鲷(Oplegnathus fasciatus)幼鱼中也发现了同种病毒。从此NNV的神秘面纱逐渐被人们揭开,我国陈信忠等[3]、陈晓艳[4]已对NNV的基本概况进行综述。
NNV的暴发主要发生在鱼的早期生活史阶段,目前在成鱼中也有所报道。NNV感染的宿主范围从海水养殖鱼类延伸到淡水领域,逐渐蔓延至海洋无脊椎动物,其中大多数属于双壳类,头足类、腹足类和甲壳类动物也有发现[5]。大部分无脊椎动物只携带NNV,不发病,但在海水鱼类中会发生选择性暴发。受病毒感染后的宿主通常表现为:食欲不振;异常的游泳行为比如螺旋、旋转、循环游泳;简单病理解剖后可发现膀胱膨胀,脑组织出血,鱼鳔过度充气并呈现苍白色[6-7]。具体的临床症状会根据鱼的种类、发育阶段、疾病阶段以及环境温度等因素影响而有所差异。
NNV的致病机理一直是人们研究的重点和难点,也是有效防治NNV的前提。本文主要对NNV在宿主细胞表面的附着、NNV致病区域、NNV复制过程中抑制和诱导细胞凋亡的机制以及免疫逃避作用等相关内容进行綜述,以期为NNV致病机理的深入研究提供参考。
1神经坏死病毒(nervous necrosis virus,NNV)概述
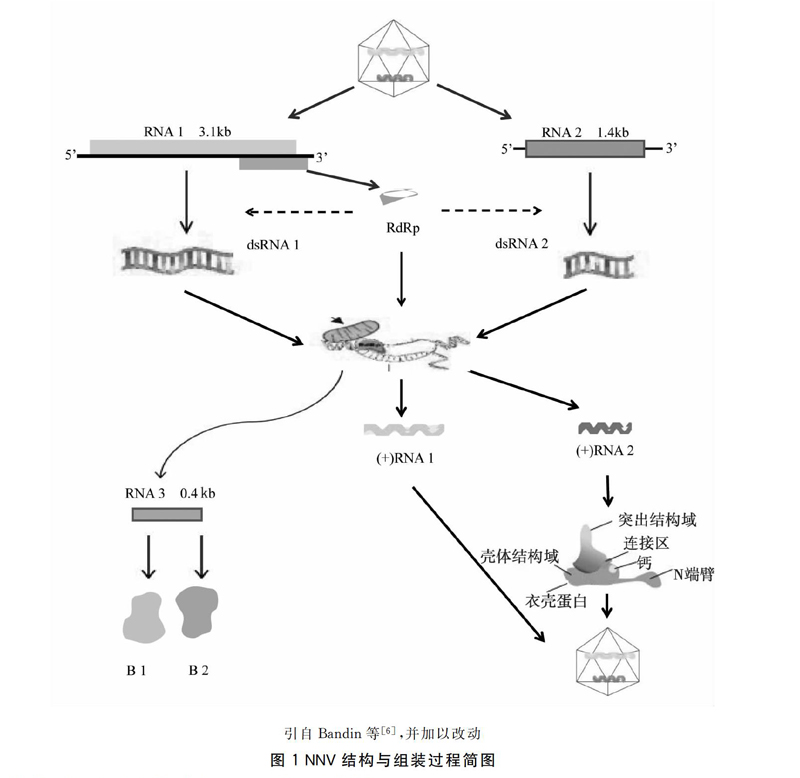
NNV是诺达病毒科中的一种。诺达病毒科可分为α诺达病毒属(Alphanodavirus)和β诺达病毒属(Betanodavirus),前者感染群体主要为昆虫,而后者主要感染鱼类。NNV属于β诺达病毒[8]。NNV是大小为25~30 nm的RNA病毒,是最小的动物病毒之一,呈球形或二十面体形态,未包裹单层蛋白[9]。如图1所示,NNV基因组是由两条被分割的线性正义、单链RNA片段(RNA1和RNA2)组成[10-11]。在病毒入侵细胞后,以RNA1(3.1 kb)为模板合成RNA聚合酶(RNA dependent RNA polymerase,RdRp),后期在细胞内完成病毒的转录与复制;RNA2(1.4 kb)编码病毒的结构蛋白—衣壳蛋白;RNA3(0.4 kb)仅存在于病毒感染细胞的过程中,作用于编码蛋白质B1和B2,是RNA1的亚基因组转录物,在病毒子中不存在[12-13]。
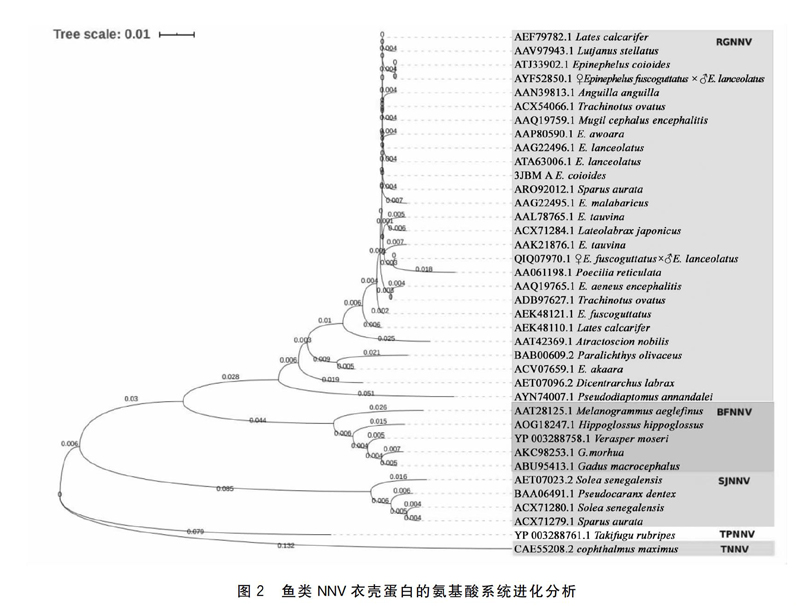
NNV主要危害病鱼的中枢神经系统,特别是脑和视网膜,所以又被称为空泡性脑-视网膜病(Vacuolating encephalopathy and retinopathy,VER)[14]。目前普遍以日本学家Nishizawa等[15]划分的分类系统为NNV分类的主要依据,根据RNA2中的T4区,可将NNV分为四种主要基因型:河鲀NNV(Tiger puffer NNV,TPNNV)、鲹NNV(Striped jack NNV,SJNNV)、鲆鲽NNV(Buffer flounder NNV,BFNNV)、赤点石斑鱼NNV(Red-spotted grouper NNV,RGNNV)[16-17]。另外,Johansen等[18]在大菱鲆中也发现了神经坏死病毒,即TNNV,为第五种基因型。根据不同种NNV的衣壳蛋白构建基因进化树如图2。
2神经坏死病毒的致病机理研究现状
2.1NNV的附着
病毒在细胞表面上的附着是病毒进入细胞并引发宿主细胞感染的首要条件,但NNV是如何附着并进入细胞的,仍是未解之谜。Liu等[19]研究发现,在经过衣霉素预处理的条纹月鳢细胞系(striped snakehead,SSN-1)上,龙胆石斑鱼(Epinephelus lanceolatus)NNV(DGNNV)颗粒与细胞的相互结合率显著降低。衣霉素能够抑制SSN-1细胞蛋白的N端糖基化,因此推测DGNNV可能附着在被感染细胞的N端糖基化的受体上。Chang等[20]利用免疫荧光染色、流式细胞术、免疫沉淀分析显示细胞表面存在热休克同源蛋白(heat shock cognate protein 70,HSC70),其与NNV衣壳蛋白之间具有相互作用。用HSC70抗血清预处理石斑鱼鳍条细胞系(Grouper fin cells,GF-1),感染后1 h的NNV的RNA2表达水平明显低于未处理的细胞。可以推断HSC70可能作为NNV受体参与了NNV病毒在细胞表面的复制。
2.2NNV致病的决定区
RNA2能够编码病毒的衣壳蛋白,而衣壳蛋白又是NNV唯一的结构蛋白,它们与病毒的致病机理有密不可分的关系。不同基因型NNV的RNA和编码蛋白的主要结构具有高度的相似性,但NNV仍存在明显的宿主特异性。
由于对NNV病毒的致病区域尚不了解,为了评价控制宿主特异性的病毒因子,日本学者Iwamoto等[21]构建了黄带鲹(Pseudocaranx dentex)NNV(SJNNV)和七带石斑鱼(Hyporthodus septemfasciatus)NNV(SGNNV)的嵌合病毒。实验依次交换重组了两种基因型病毒的RNA1和RNA2并转染至E-11细胞中,分别对其原始宿主鱼进行感染,探究其特异性。研究发现,七带石斑鱼被重组病毒(SJNNV的RNA1和SGNNV的RNA2)感染后,致死率可达100%,类似感染SGNNV,而黄带鲹不受影响。相反,黄带鲹接种重组病毒(SGNNV的RNA1和SJNNV 的RNA2)时,致死率也可达到100%。此结果表明,RNA2是NNV致病的决定基因。为准确鉴定具有宿主特异性的RNA2区域,Ito等[22]根据RNA2的不同核苷酸区域设计了嵌合病毒的进一步实验。实验采用构建的SJNNV和RGNNV的RNA2嵌合病毒分别感染它们的原始宿主鱼,来测试它们的传染性。实验发现保留了RNA2 T4区的嵌合病毒可以感染原始宿主,结果表明T4区具备控制宿主特异性的作用,也是决定基因RNA2的致病区域。
2.3NNV引起的细胞凋亡
病毒在入侵宿主细胞后为了达到增加病毒传播或破坏宿主原有免疫反应的目的,会通过多种途径诱导宿主细胞或免疫细胞凋亡。在NNV病毒诱导的凋亡机制中,由线粒体介导的宿主细胞凋亡坏死最为常见。另外,内质网通路也参与介导细胞凋亡。
2.3.1线粒体介导的细胞凋亡线粒体介导细胞凋亡的途径主要通过B2蛋白对Bcl-2蛋白家族的调节和触发氧化应激来实现,RNA2和其编码的衣壳蛋白也在引起线粒体介导的细胞凋亡中发挥了重要的作用。
由抗凋亡因子(Bcl-2、Bcl-xL、Mcl-1和A1等)和促凋亡因子(Bax、Bak、Bid和Bad等)共同构成的Bcl-2蛋白家族是调节细胞凋亡的关键因素,两种组成成分的比值决定细胞是否对近期凋亡刺激做出应答[23]。Bcl-2家族主要作用于线粒体外膜,维持线粒体膜电位(mitochondrial membrane potential,MMP)平衡和线粒体通透性转变孔(mitochondrial permeability transition pore,MPTP)的正常开放。在病毒感染的中后期,促凋亡因子Bax的表达量上调至原来的2.8倍,诱导MMP的丢失,并触发由线粒体介导的细胞凋亡[24]。研究发现,NNV的B2蛋白能通过特定的氨基酸信号41-50靶向结合线粒体,触发由活性氧(reactive oxygen species,ROS)过量产生引起的氧化应激[25],同时抑制线粒体复合物Ⅱ的产生导致ATP能量耗竭[26]。氧化应激产生的ROS最终通过改变线粒体形态和诱导MMP的丢失介导细胞死亡。B2蛋白靶向结合线粒体产生H2O2,诱导线粒体分裂因子Drp1从胞浆转移到线粒体上引起线粒体断裂和细胞死亡[27]。
RNA2编码病毒的衣壳蛋白在细胞凋亡以及细胞凋亡后坏死的过程中发挥了不可或缺的作用。RNA2诱导凋亡的早期引起磷脂酰丝氨酸(phosphatidylserine,PS)外化[28],中期引起細胞色素c(cytochrome c)的释放和MMP丢失[29]。后期大量产生用于病毒组装的衣壳蛋白,激活caspase家族的caspase-8和-3诱导宿主凋亡途径,最终导致细胞溶解和死亡[30-32]。细胞溶解有助于完成病毒脱落,完成病毒的生命周期。
2.3.2内质网介导的细胞凋亡病毒在复制的早期和中期会触发机体内质网应激反应。主要通过以下几种途径:ATF6和IRE1传感器被激活,随后上调伴侣蛋白BiP和GRP78[33];与下调的Bcl-2相关的PERK传感器被磷酸化和caspase-12被激活。除此之外,GRP78可以与线粒体膜紧密连接的蛋白A结合,增加病毒在体内的复制。最后,因为MMP丢失和PERK介导的Bcl-2表达量的下调,引起线粒体功能障碍触发坏死细胞死亡[34]。Lu等[35]证明了衣壳蛋白的过度表达也会触发ER的应激反应。在被感染的细胞的细胞核中,发现了病毒的衣壳蛋白。同时,BiP蛋白作为内质网的重要分子伴侣,在感染的GF-1细胞中与NNV衣壳蛋白共定位,这也可以证明BiP与病毒的衣壳蛋白之间存在一定关系。在一定程度上能够说明病毒的衣壳蛋白对引起内质网应激也存在一定作用,具体的过程仍需要深入探究。
2.3.3抑制细胞凋亡的机制宿主细胞为病毒提供了良好的复制空间,为了在宿主中更多的积累,病毒也会发挥抑制细胞凋亡的作用。许多病毒都能保护受感染的细胞抵抗早期坏死,它们可以通过抑制凋亡反应途径中的各种步骤来实现。在NNV感染的早期,B1蛋白通过阻碍MMP的丧失等过程提高受感染细胞的活力,帮助其对抗早期的细胞坏死并为病毒的复制提供条件,在宿主细胞的抗坏死的过程中发挥重要作用[36]。
2.4NNV的免疫逃避机制
免疫逃避是诱导免疫和阻碍免疫两者之间处于平衡状态的结果,在石斑鱼中发现NNV持续感染的情况,这被认为是病毒在发挥免疫逃避作用[37]。NNV主要依靠B2蛋白与宿主RNA进行对抗来执行免疫逃避[38]。NNV的B2蛋白能够结合病毒的RNA,从而避免Dicer酶的切割,阻断宿主RNA干扰,并且有助于病毒RNA1在宿主细胞中的不断积累[39]。
3展望
NNV目前依旧没有有效的治疗措施,但通过对NNV病毒致病机制的讨论,可以设计一些针对其致病性的治疗措施。由线粒体介导的凋亡过程可以被Bcl-2家族中的抗凋亡蛋白有效抑制,比如BclxL的过表达显著阻断由RGNNV死亡因子蛋白α和B2诱导的细胞死亡。这可以说明,抗凋亡蛋白具有治疗由NNV感染引起的疾病的潜力。除此之外,线粒体毒素BKA作为MPTP的抑制剂也参与调节凋亡的过程。它的治疗发生在感染的早期和中期,能够显著抑制MMP的丢失从而增强宿主细胞的活力、阻止线粒体细胞色素c的释放。
对NNV致病机理的深入探究可以帮助我们了解病毒与宿主之间的关系,进而更好地预防和治疗NNV。目前,对NNV复制机制、病毒检测等方面的内容研究相对透彻,但是在破译病毒复制过程中抑制和诱导细胞凋亡的机制、病毒RNA基因组在感染各个时期的致病机制和调控、阐明病毒的组装和病毒基因组包装以及成年鱼类宿主中的病毒无症状携带和潜伏期等方面,仍有许多工作要做。
参考文献:
[1] GLAZEBROOK J S,HEASMAN M P,DE BEER S W.Picorna-like viral particles associated with mass mortalities in larval barramundi,Lates calcarifer Bloch[J].Journal of Fish Diseases,1990,13(3):245-249.
[2] YOSHIKOSHI K,INOUE K.Viral nervous necrosis in hatchery-reared larvae and juveniles of Japanese parrotfish,Oplegnathus fasciatus (Temminck & Schlegel)[J].Journal of Fish Diseases,1990,13(1):69-77.
[3] 陈信忠,龚艳清.鱼类病毒性神经坏死病研究进展[J].生物技术通报,2006(S1):141-146.
[4] 陈晓艳.鱼类病毒性神经坏死病研究现状[J].动物医学进展,2005(5):17-21.
[5] BITCHAVA K,CHASSALEVRIS T,LAMPOU E,et al.Occurrence and molecular characterization of betanodaviruses in fish and invertebrates of the Greek territorial waters[J].Journal of Fish Diseases,2019,42(12):1-11.
[6] BANDIN I,SOUTO S.Betanodavirus and VER Disease: A 30-year Research Review[J].Pathogens,2020,9(2):1-49.
[7] GUO Y X,CHAN S W,KWANG J.Membrane association of greasy grouper nervous necrosis virus protein A and characterization of its mitochondrial localization targeting signal[J].Journal of virology,2004,78(12):6498-6508.
[8] Kim J O.Intracellular signaling pathway for host defense mechanisms against Piscine Nervous Necrosis Virus (NNV)[J].Journal of Life Science,2020,30(4):402-409.
[9] 陈文捷,刘晓丹,胡先勤,等.鱼类神经坏死病毒研究进展与发展趋势[J].水产学报,2014,38(9):1666-1672.
[10] 魏盟智,李亚军,安鑫龙,等.石斑鱼病毒性神经坏死病防治的研究现状[J].河北渔业,2020(5):51-53.
[11] SOUTO S,OLVEIRA J G,DOPAZO C P,et al.Modification of betanodavirus virulence by substitutions in the 3' terminal region of RNA2[J].Journal of General Virology,2018,99(9):1210-1220.
[12] 粟子丹,李晋,史成银.引起半滑舌鳎(Cynoglossus semilaevis Günther)鱼苗大规模死亡的神经坏死病毒病[J].渔业科学进展,2016,37(4):110-115.
[13] CHEN N C,YOSHIMURA M,GUAN H H,et al.Crystal structures of a piscine betanodavirus: Mechanisms of capsid assembly and viral infection[J].PLOS Pathogens,2015,11(10) :e1005203.
[14] MUNDAY B L,LANGDON J S,HYATT A,et al.Mass mortality associated with a viral-induced vacuolating encephalopathy and retinopathy of larval and juvenile barramundi,Lates calcarifer Bloch[J].Aquaculture,1992,103(3-4):197-211.
[15] NISHIZAWA T,FURUHASHI M,NAGAI T,et al.Genomic classification of fish nodaviruses by molecular phylogenetic analysis of the coat protein gene[J].Applied and environmental microbiology,1997,63(4):1633-1636.
[16] LAMPERT Y,BERZAK R,DAVIDOVICH N,et al.Indigenous versus Lessepsian Hosts: Nervous Necrosis Virus (NNV) in Eastern Mediterranean Sea Fish[J].Viruses,2020,12(4):1-9.
[17] 劉荭,史秀杰,高隆英,等.鱼病毒性神经坏死病病毒(VNNV)不同基因型鉴别方法的建立及在VNN检疫和监测中的应用[J].水产学报,2004,28(6):695-702.
[18] JOHANSEN R,SOMMERSET I,TRUD B,et al.Characterization of nodavirus and viral encephalopathy and retinopathy in farmed turbot,Scophthalmus maximus (L.)[J].Journal of Fish Diseases,2004,27(10):591-601.
[19] LIU W T,HSU C H,HONG Y R,et al.Early endocytosis pathways in SSN-1 cells infected by dragon grouper nervous necrosis virus[J].Journal of General Virology,2005,86(9):1107-1114.
[20] CHANG J S,CHI S C.GHSC70 is involved in the cellular entry of nervous necrosis virus[J].Journal of virology,2015,89(1):61-70.
[21] IWAMOTO T,OKINAKA Y,MISE K,et al.Identification of host-specificity determinants in betanodaviruses by using reassortants between striped jack nervous necrosis virus and sevenband grouper nervous necrosis virus[J].Journal of virology,2004,78(3):1256-1262.
[22] ITO Y,OKINAKA Y,MORI K,et al.Variable region of betanodavirus RNA2 is sufficient to determine host specificity[J].Diseases of aquatic organisms,2008,79(3):199-205.
[23] 梁凱,曹秉振.线粒体调控的细胞凋亡研究进展[J].生物医学工程与临床,2014,18(5):501-505.
[24] SU Y C,WU J L,HONG J R.Betanodavirus non-structural protein B2: A novel necrotic death factor that induces mitochondria-mediated cell death in fish cells[J].Virology,2009,385(1):143-154.
[25] CHANG C W,SU Y C,HER G M,et al.Betanodavirus induces oxidative stress-mediated cell death that prevented by anti-oxidants and zfcatalase in fish cells[J].Plos One,2011,6(10):e25853.
[26] SU Y C,HONG J R.Betanodavirus B2 causes ATP depletion-induced cell death via mitochondrial targeting and complex II inhibition in vitro and in vivo[J].The Journal of biological chemistry,2010,285(51):39801-39810.
[27] SU Y C,CHIU H W,HUNG J C,et al.Betanodavirus B2 protein induces hydrogen peroxide production,leading to Drp1-recruited mitochondrial fragmentation and cell death via mitochondrial targeting[J].Apoptosis,2014,19(10):1457-1470.
[28] CHEN S P,YANG H L,HER G M,et al.Betanodavirus induces phosphatidylserine exposure and loss of mitochondrial membrane potential in secondary necrotic cells,both of which are blocked by bongkrekic acid[J].Virology,2006,347(2):379-391.
[29] WU H C,CHIU C,WU J L,et al.Zebrafish anti-apoptotic protein zfBcl-x L can block betanodavirus protein a-induced mitochondria-mediated secondary necrosis cell death[J].Fish and Shellfish Immunology,2008,24(4):436-449.
[30] MAO M G,JIANG J L,JIANG Z Q,et al.Molecular characterization of caspase members and expression response to Nervous Necrosis Virus outbreak in Pacific cod[J].Fish and Shellfish Immunology,2018,74:559-566.
[31] LOW C F,NATAQAIN B S,CHEE H Y,et al.Betanodavirus: Dissection of the viral life cycle[J].Journal of fish diseases,2017,40(11):1489-1496.
[32] GUO Y X,WEI T,DALLMANN K,et al.Induction of caspase-dependent apoptosis by betanodaviruses GGNNV and demonstration of protein α as an apoptosis inducer[J].Virology,2003,308(1):74-82.
[33] OYADOMARI S,MORI M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death & Differentiation,2004,11(4):381-389.
[34] SU Y C,WU J L,HONG J R.Betanodavirus up-regulates chaperone GRP78 via ER stress: roles of GRP78 in viral replication and host mitochondria-mediated cell death[J].Apoptosis,2011,16(3):272-287.
[35] LU M W,NGOU F H,CHAO Y M,et al.Transcriptome characterization and gene expression of Epinephelus spp in endoplasmic reticulum stress-related pathway during betanodavirus infection in vitro[J].BMC Genomics,2012,13(1):1-12.
[36]? CHEN L J,SU Y C,HONG J R.Betanodavirus non-structural protein B1: A novel anti-necrotic death factor that modulates cell death in early replication cycle in fish cells[J].Virology,2009,385(2):444-454.
[37] CHEN Y M,WANG T Y,CHEN T Y.Immunity to betanodavirus infections of marine fish[J].Pergamon,2014,43(2)174-183.
[38] FENNER B J,THIAGARAJAN R,CHUA H K,et al.Betanodavirus B2 is an RNA interference antagonist that facilitates intracellular viral RNA accumulation[J].Journal of virology,2006,80(1) :85-94.
[39] FENNER B J,GOH W,KWANG J.Sequestration and protection of double-stranded RNA by the betanodavirus b2 protein[J].Journal of virology,2006,80(1):85-94.
Research progress on pathogenic mechanism of nevous necrosis virus in marine fish
ZHU Yumin1,LIU Hong2,MAO Mingguang1
(1.Key Laboratory of Mariculture & Stock Enhancement in North Chinas Sea,Ministry of Agriculture,Key Laboratory of Fish
Applied Biology and Aquaculture in North China,Liaoning Province,Dalian Ocean University,Dalian 116023,China;2.Shenzhen
Customs Animal and Plant Inspection and Quarantine Technology Center,Shenzhen 518045,China;3. Key laboratory of Utilization
and Conservation for Tropical Marine Bioresources,Ministry of Education, Hainan Tropical Ocean University, Sanya 572022,China)
Abstract:Nerve necrosis virus (NNV) is mainly distributed in the Mediterranean Sea and the west coast of the Pacific Ocean.It has been detected in more than 120 species of fish.It can cause viral nerve necrosis (VNN) in fish and is one of the most harmful pathogens to marine fish.At present,with the in-depth study of gene sequence,type,diagnosis and prevention technology of nerve necrosis virus,more and more reports about its pathogenic mechanism were reported.This paper summarized the research status of virus attachment,pathogenic genes,apoptosis and immune evasion.
Key words:nerve necrosis virus;pathogenesis;immune evasion;apoptosis
(收稿日期:2021-05-06)
基金项目:大连市支持高层次人才创新创业项目(2019RQ121);国家自然科学基金(31302202);辽宁省教育厅项目(JL201902);中国博士后基金(2016M602391)。
作者简介:朱裕敏(1998-),女,在读硕士研究生,研究方向:水产医学。E-mail:1277756179@qq.com。
通信作者:毛明光(1982-),男,副教授,研究方向:海洋生物學。E-mail: 41810096@ qq.com。
DOI:10.3969/j.issn.1004-6755.2021.06.006
- 系统功能语言学指导下的广告双关语标题及其翻译策略
- OntheTranslationofScenicSpots
- 浅析巴中市公示语英译中存在的问题及对策
- 散文英译也需“炼词”
- 菲茨杰拉德小说TheI.O.U.英译中翻译述评
- 从跨文化交际角度分析公示语过度翻译现象
- 浅析关联理论视域下的文化缺省与补偿翻译
- 浅析计算机辅助翻译工具Trados对现代翻译的影响
- 《红楼梦》第四十回杨宪益译本与霍克斯译本比较
- TheDifferencebetweenOrientalandOccidentalThinking PatternsinTranslation
- 跨文化语用学视角下的外宣翻译策略范
- 基于功能对等理论的科技英语翻译实践研究
- “外宣三贴近”原则指导下的翻译研究
- 符际翻译与文化传播:以古诗词剪纸为例
- ReviewofBeingMortal:MedicineandWhatMattersintheEnd
- GothicisminCharactersofWutheringHeights
- AStudyofTerminationStrategiesofParent—childConflictTalkinModernFamily
- ViolationsoftheTraditionalBioethicsinNeverLetMeGo
- AbriefanalysisabouttheactionmechanismofballetPilé
- 思维导图在初中英语词汇教学中的应用探究
- 思维导图在中考英语写作课中的研究
- 游戏教学在小学英语课堂中的运用尝试
- 音标教学,初中英语词汇教学的起点
- 精选英文绘本,感受阅读乐趣
- 初中英语写作常见问题分析与训练策略
- quotation marks
- quotation/quote
- quotations
- quotativeness
- quote
- quoted
- quoted company
- quotedcompany
- quotee
- quote/estimate/quotation
- quoter
- quoters
- quotes
- quote sb sth
- quote²
- quote¹
- quotient
- quotients
- quotient's
- quoting
- qur'an
- qur'anic
- quranic
- qwl
- r
- 不光彩的事迹
- 不光明正大
- 不光明正大的事
- 不光明磊落的事
- 不光滑
- 不光荣,不体面
- 不克
- 不克分身
- 不克自拔
- 不克自振
- 不免
- 不免虎口
- 不入佛门不受戒
- 不入兽穴,安得兽子
- 不入地狱,不知饿鬼变相
- 不入套
- 不入时宜不达时宜
- 不入流
- 不入眼
- 不入耳
- 不入虎穴 焉得虎子
- 不入虎穴,不得虎子
- 不入虎穴,焉得虎子
- 不入调
- 不入门