王惠哲 邓强 张有为 李淑菊 杨瑞环 曹明明

摘? ? 要:为了获得抗黑星病黄瓜种质,为分子设计育种提供抗源,利用与黄瓜抗黑星病基因紧密连锁的SSR标记CSWCTT02D对102份黄瓜种质资源进行基因型分析。结果表明,黄瓜种质间抗病基因的标记基因型存在遗传变异性,明确了102份种质抗黑星病基因的标记基因型,3份种质存在抗病标记(2.94%),1份种质为杂合型(0.98%),98份种质不存在抗病标记(96.08%);苗期人工接种鉴定有高度抗病种质4份(3.92%),高度感病种质98份(96.08%)。SSR分子检测结果与苗期人工接种基本一致,有2份材料与人工接种鉴定结果不符。‘南9436(华南型)接种为感病,标记为抗病;‘K92(华南型)接种为抗病,标记为感病,符合率达98.04 %。抗病材料选择应以人工接种结果为依据,因此初步鉴定出4份抗黑星病种质,分别为日本类型‘Q6和‘NINIA、华南型‘南9427和‘K92,病情指数均为0。该研究为华北型黄瓜抗黑星病品种的遗传改良奠定了技术与种质基础。
关键词:黄瓜; 黑星病; SSR鉴定; 抗病性
Identification of cucumber germplasm resistance to scab by SSR markers and artificial inoculation at seedling stage
WANG Huizhe, DENG Qiang, ZHANG Youwei, LI Shuju, YANG Ruihuan, CAO Mingming
(State Key Laboratory of Vegetable Germplasm Innovation / Tianjin Kernel Cucumber Research Institute, Tianjin 300192, China)
Abstract : In order to obtain cucumber germplasm resistant to scab, provide resistance sources for molecular design breeding, and finally breeding resistant varieties to control cucumber scab. In this study,SSR marker CSWCTT02D linked to scab-resistance gene was used to identify the marker genotypes of 102 cucumber germplasm resources. The results showed genetic variation of marker genotypes exists among different germplasm and within same germplasm as well. The marker genotypes of 102 germplasm were confirmed, 3 germplasm had disease resistance marker (2.94%), one germplasm was heterozygous (0.98%), and 98 germplasm had no disease resistance marker (96.08%). There were 4 highly resistant germplasm (3.92%) and 98 highly susceptible germplasm (96.08% ) identified by artificial inoculation at seedling stage. The results of SSR molecular detection were basically consistent with that of artificial inoculation at seedling stage, and 2 materials did not match the identification results of artificial inoculation. South ‘9436 was inoculated as susceptible and marked as resistant, ‘K92 was inoculated with disease resistance and marked as susceptible, with a coincidence rate of 98.04%. The selection of disease-resistant materials should be based on the results of artificial inoculation, so 4 resistant cucumber germplasm were preliminarily identified, namely ‘Q6, ‘Ninia, ‘Nan9427 and ‘K92, with disease indices of 0. This study laid technical and germplasm foundation for improving scab-resistance cucumber varieties of north China cucumber.
Key words: Cucumber; Cladosporium cucumerinum; SSR Markers, Disease resistance
黃瓜(Cucumis sativus L.)是一种世界性的重要蔬菜作物,在自然选择和栽培驯化过程中,形成了丰富多样的变异类型和地方品种。在黄瓜生产中,病害的发生越来越频繁,防治越来越艰难。选育抗病品种是控制黄瓜病害的最有效途径。
黄瓜黑星病[Cladosporium cucumerinum Ell. et Arth.]俗称“流胶病”,也叫“疮痂病”,是一种毁灭性病害。该病是我国保护地的重要病害之一,是一种低温病害,在保护地容易流行成灾,全生育期都可发生 [1-3]。Bailey和Burgess[4]于1934年首次报道黄瓜对黑星病的抗性由一对显性基因控制,并且至今没有黑星病菌生理小种分化的报道。天津科润黄瓜研究所张桂华等前期研究利用抗病和感病组合(Q6×Q12)的F2分离群体获得1个与抗黑星病相关基因遗传距离为4.83 cM的显性AFLP標记[5];后续又获得1个共显性SSR标记CSWCTT02D [6],位于第2染色体,与目标基因的遗传距离为3.1 cM。中国农业科学院康厚祥等于2011年以抗病自交系9110Gt和感病自交系9930构建的重组自交系、F2群体和回交群体为试材,也获得了2号染色体的相关SSR标记,并获得两个Indel标记,遗传距离分别为0.14、0.15 cM [7]。上述研究均表明黑星病抗性是由一个单显性基因控制,均获得了与抗黑星病相关基因紧密连锁的标记,但均未应用于为种质遗传改良而筛选可靠的抗病基因供体。天津科润黄瓜研究所前期获得的SSR标记CSWCTT02D为一共显性标记,以抗黑星病母本‘Q6和感黑星病父本‘F51及其F2代分离群体为试材开发获得,其中抗病带为246 bp,感病带为256 bp。笔者利用该标记对黄瓜主要种质资源进行抗病基因型分析,并与人工接种鉴定结果相比较,筛选出携带抗黑星病基因的抗源供体,旨在为华北型抗黑星病黄瓜品种遗传改良及抗病新品种选育奠定种质与技术基础。
1 材料与方法
1.1 材料
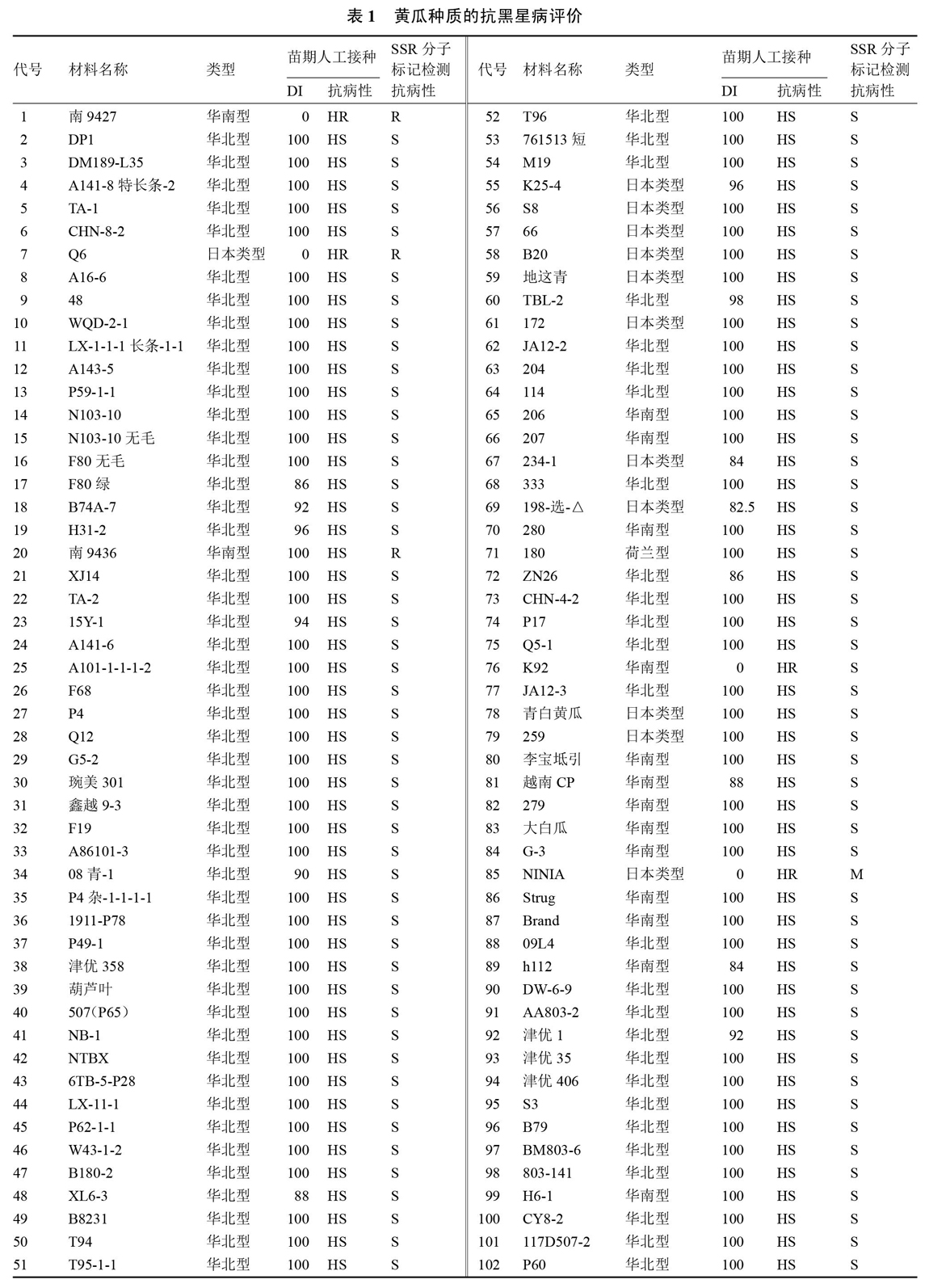
试验于2017年1月至2018年5月在天津科润黄瓜研究所植物病理实验室和分子检测室完成。102份黄瓜材料均为天津科润黄瓜研究所育种一室提供,材料名称如表1。其中,华北型74份,日本类型12份,华南型15份,荷兰型1份。黄瓜种子用0.1%升汞消毒10 min,清水冲洗干净后45~50 ℃温水浸种4~6 h后于30 ℃恒温箱内催芽,出芽后播于盛有灭菌蛭石的育苗盘内,放置于人工气候培养箱内育苗。
引物由上海生工生物工程有限公司合成,DNA提取试剂盒、Taq PCR Mix等试剂购自天津百奥泰科技发展有限公司。SSR标记CSWCTT02D 引物序列如下:
上游引物5'-CATCCTCATTCATGGCGGAGTGTG-3';
下游引物5'-GAATTTGTTAAAATTGTACATTAA-3'。
1.2 方法
1.2.1 DNA提取 供试品种各取5 株植株的叶片混合,采用CTAB法提取基因组DNA,并保存于冰箱- 20℃条件下备用。
1.2.2 SSR分析体系 PCR反应体系[6]为20 μL,黄瓜基因组DNA 20 ng、引物各50 ng、2×Taq PCR Mix 10 μL,ddH2O补足;反应条件为94 ℃预变性300 s,94 ℃变性30 s,55~58 ℃退火30 s,72 ℃延伸60 s,35个循环,再72 ℃延伸350 s。扩增产物在5%聚丙烯酰胺凝胶电泳分离,银染检测,条带记录和分析。
1.2.3 苗期人工接种鉴定方法 黄瓜黑星病菌采自辽宁沈阳发病黄瓜植株,分离纯化保存。将保存在PDA斜面上的病菌在PDA平板上扩繁,加少量无菌水洗下孢子,然后将孢子悬浮液加到预先铺好的PDA平面上,涂匀,于20 ℃温箱中培养7 d左右。无菌水洗下孢子后用玻璃棒充分搅拌,使孢子分散于水中,血球计数板计数后配成浓度为106·mL-1的悬浮液待用。黄瓜幼苗在人工培养箱中进行育苗,于第1真叶展开后,将幼苗放置于所内植保实验室。用手持喷雾器将孢子悬浮液均匀喷于叶面,以雾滴布满叶面但不流失为宜。空调控温,接种温度为20 ℃左右,接种后保湿24 h,以后夜间适当保湿。因黑星病抗病和感病发病症状为极端表现,102份黄瓜材料均为纯合自交系,所以试验中每材料只用10株即可代表其抗病性,于接种后5~7 d调查病情指数[7-13]。
1.2.4 抗性评价指标 按病情指数(DI)划分,高抗(HR)为0 病情指数(DI)=100×∑(各级植株数×级别值)/(调查总株数×最高级别值)。 2 结果与分析 2.1 种质间黑星病标记位点的遗传变异性 利用与黄瓜抗黑星病基因紧密连锁的SSR标记CSWCTT02D的引物,对102份黄瓜种质资源的基因组DNA进行了PCR扩增,结果如图1所示。从图1看出,该标记在种质资源间存在多态性,说明该标记存在鉴定抗黑星病种质的可能性。 对该引物扩增102份种质的多态性条带进行统计,结果如表1所示。从表1可以看出,黄瓜抗黑星病基因或者感黑星病基因的标记位点在102份种质间存在变异性。对于抗黑星病基因的标记基因型,可望利用标记辅助育种选择技术鉴定抗病种质,并以抗病种质为供体进行黄瓜核心种质的抗黑星病遗传改良。 通过对102份种质资源的标记基因型分析,初步鉴定出抗性材料3份,中抗材料1份,感病材料98份。 2.2 种质的苗期人工接种抗病性鉴定 采用苗期人工喷雾接种鉴定对102份黄瓜高代自交系进行黑星病抗性鉴定。获得高度抗病材料4份, 华南型2份为‘南9427‘K92,日本类型2份为‘Q6和‘NINIA,共占3.92%;感病材料98份,占96.08%。该结果表明,我国黄瓜种质资源中蕴藏着改良黑星病抗性的有价值基因资源,但抗源较少,而华北有刺类型种质中无抗病材料。 2.3 2种方法结果比较 对这102份材料的人工接种鉴定和SSR分子检测结果进行了符合性测定,有2份材料明显不符,‘南9436(华南型)这个材料接种为感病,标记为抗病,‘K92(华南型)接种为抗病,标记为感病,由此计算2者符合率为98.04%,说明该分子标记检测结果准确、可靠,可用于黄瓜抗黑星病辅助育种(表1)。 3 讨论与结论 通过对供试的102份黄瓜种质的抗病性鉴定,明确了不同类型黄瓜品系的抗病性差异。其中,‘Q6(日本类型)、‘南9427(华南型)和‘NINIA(日本类型)这3份材料人工接种鉴定病情指数为0,高度抗病,SSR标记检测‘Q6和‘南9427为抗病,‘NINIA为杂合型。众多研究均表明,黄瓜对黑星病的抗性由一对显性基因控制,位于黄瓜chr2上[4-7],因此,基因型为杂合的材料接种鉴定会表现为抗病,‘NINIA是抗病材料。在育种实践中,如果培育抗黑星病品种,亲本中有一个抗病则该品种就会抗病。 目前市场上的黄瓜主栽品种是华北有刺类型,但华北有刺类型黄瓜中几乎没有抗源,生产上主栽品种不抗黑星病;而日本类型、华南型材料中蕴藏着改良黑星病抗性的有价值基因资源。该研究为华北型黄瓜抗黑星病遗传改良提供了材料基础。采用回交转育,结合分子标记检测技术定向改良核心种质的抗病性,聚合优势基因,是创新育种材料的快速、简便、行之有效的关键手段。实际上,很多科研单位基础研究和常规育种均取得不错的成绩,但基础技术研究和育种实践应用两者严重脱节,育种家大多不研究植物病理和分子标记,植物病理研究人员又对育种不太在行,分子领域的人才也多对育种不是深入了解、甚至可能植物病理方面也不专业,在做试验前基本是请别人给做接种鉴定,三者合一都很在行的人确实少之又少,因此很难取得较大进展[14-16]。目前,笔者已率先开展对黄瓜核心种质资源进行抗黑星病基因的定向遗传改良研究,以期培育优质、多抗黄瓜新品种,并创造黄瓜抗病新种质。 上述结果表明,分子标记检测与苗期人工接种鉴定有偏差,符合率达到98.04%,标记并非百分百准确。一方面,标记在开发过程中受到标记密度、群体大小、人工接种鉴定、材料等多种因素的影响,导致与抗病基因的遗传连锁距离较大。因此,如果在育种材料的选择过程中仅依赖一个标记,可能会出现目标偏离,在应用中可使用双标记、多标记或基因内的标记进行检测。周倩[17]利用高密度遗传图谱和RIL群体中丰富的表型数据,将黄瓜抗黑星病基因Ccu缩小到88 kb 的区间,只含有一个抗病基因Csa2G021710,可作为Ccu 的候选基因。目前,本单位正在基因Csa2G021710内部和标记CSWCTT02D附近开发距离抗黑星病基因更近的SNP或Indel标记,以便在进行种质抗性遗传改良及分子设计育种的应用中,有效提高鉴定、筛选效率和结果的准确性。 参考文献 [1] 易齐,王蔚,王传英.黄瓜黑星病及其蔓延危害现状[J].植物保护,1987(6):40-41. [2] 王进扬,卢香春,王敏.黄瓜黑星病调查简报[J].中国蔬菜,1988(2):42-43. [3] 李明远,易齐.黄瓜黑星病在我国流行的现状[J].长江蔬菜,1989(3):26-27. [4] BAILEY R M,BURGESS I M.Breeding Cucumbers resistant to scab.[J].Proceedings American Society for Horticultural Science,1934,32:474-476. [5] 张桂华,韩毅科,孙小红,等.与黄瓜抗黄瓜黑星病基因连锁的分子标记研究[J].中国农业科学,2006,39(11):2250-2254. [6] 王惠哲,李淑菊,管炜.与黄瓜抗黑星病相关基因紧密连锁的SSR标记[J].分子植物育种,2009,7(3):550-554. [7] KANG H X,WENG Y Q,YANG Y H,et al.Fine genetic mapping localizes cucumber scab resistance gene Ccu into an R gene cluster[J].Theoretical Applied Genetics, 2011,122:795-803. [8] 王惠哲,李淑菊,杨瑞环,等.黄瓜枯萎病、炭疽病、褐斑病、黑星病苗期抗源材料筛选试验[J].农业科技通讯,2013(8):118-121. [9] 王惠哲,管炜,杨瑞环,等.黄瓜种质资源抗黑星病鉴定与评价[J].农业科技通讯,2013(12):135-137. [10] ABUL-HAYJA Z,WILLIAMS P H.Inheritance of two seedling markers in cucumber[J].HortScience,1976,11(2):145. [11] 李光,李淑菊,王惠哲.兼抗黄瓜枯萎病、角斑病和黑星病育种材料苗期筛选[J].天津农业科学,2007,13(3):23-25. [12] 王艷飞,李平,王惠哲.黄瓜枯萎病、白粉病、霜霉病和黑星病苗期多抗性鉴定方法的评价[J].中国蔬菜,2007(3):27-28. [13] 王惠哲,李淑菊.黄瓜枯萎病-白粉病-褐斑病-黑星病多抗性鉴定技术研究[J].中国瓜菜,2010,23(5):6-8. [14] 李全辉,李锡香,王海平,等.黄瓜抗黑星病相关基因的差异表达分析[J].植物遗传资源学报,2013,14(3):501-506. [15] 毛爱军,张峰,张丽蓉,等.黄瓜品系WIS2757对黄瓜枯萎病生理小种4和黑星病的抗性遗传与连锁分析[J].中国农业科学,2008,41(10):3382-3388. [16] 康厚祥.黄瓜抗黑星病基因Ccu的精细定位与图位克隆及黄瓜与黑星菌互作的表达谱分析[D].北京:中国农业科学院,2011. [17] 周倩.基于基因组测序的黄瓜高密度遗传图谱构建和果皮浅绿突变体基因定位[D].北京:中国农业科学院,2015.
- 夏玉米节水高产高效栽培管理技术
- 探析森林资源管理与生态林业发展的改善措施
- 加强农作物种子经营管理的相关措施探讨
- 浅析加强种子检验工作对提高农业经济效益的影响
- 论新形势下种子管理工作中存在的问题和对策
- 林业种苗管理中存在的问题与对策
- 玉米种植密度对产量和品质的影响
- 温泉县春小麦3416肥料试验探究
- 2017—2019年寿宁县蔬菜农药残留快速监测结果与分析
- 盐碱胁迫对玉米苗期生理指标影响的研究进展
- 盘州市煤矿矸石尾矿环境治理中戟叶酸模生长情况调查报告
- 台州市西兰花-春大豆-晚稻种植模式探索
- 棉花GhERF14基因在拟南芥中的功能验证
- 清香木姜子容器苗繁育技术研究
- 广西维都林场牛角瓜引种栽培试验初探
- 草莓Remorin家族的全基因组鉴定及功能初步研究
- 芝稻共生栽培模式研究
- 70年玉米生产技术变革与展望
- 首个乡村振兴战略规划实施报告发布
- 无人遥感飞机在林业调查中的应用研究
- 黟县国有林场改革后存在的问题及发展策略探讨
- 现代林业规划管理及可持续发展的路径探究
- 富平县实施小麦转型升级促进结构调整的模式探索
- 我国林业育苗现状及其应对措施探究
- 贺州油茶产业发展存在的问题及对策
- copelessness's
- copes
- cope's
- cope-with
- copied
- copier
- copiers
- copies
- copies of products
- copiosities
- copious
- copiously
- copiousness, copiosity
- copiousnesses
- cop-out
- cop out
- cop out of
- cop out (of sth)
- cop-outs
- co pout's
- copped
- copped-out
- copper
- coppered
- copperer
- 日衰
- 日西
- 日西斜
- 日西斜,出炉铁
- 日见
- 日观
- 日规
- 日角
- 日角偃月
- 日角珠庭
- 日角龙庭
- 日角龙颜
- 日计不足,岁计有余
- 日计不足,月计有余
- 日记
- 日记体小说
- 日许多时
- 日许时间
- 日试万言
- 日语
- 日诵五车
- 日诵赋范
- 日贯白虹
- 日费
- 日趋