龚思 梁少华 严静怡 邹甜 杨洁 楚箫 陈泽南 孙小武

摘? ? 要: 西瓜未受精子房离体培养作为单倍体育种的有效方法,可极大提高育种效率。以西瓜‘早佳未受精子房为试材,对西瓜未受精子房出胚率的影响因素进行了研究,并鉴定了再生植株倍性。试验结果表明,栽培季节对西瓜未受精子房离体培养有很重要的影响,在相同的培养条件下,秋季栽培出胚率可达21.33%,高出春季栽培约6%;取材当天的日最低、最高气温对西瓜未受精子房离体培养出胚率也有一定的影响,在21~35 ℃范围内日平均出胚率均可达10%,显著高于过低或过高气温下统计的出胚率;4 ℃低温预处理并不能提高西瓜胚状体诱导效率。利用染色体计数法与流式细胞仪鉴定36棵再生植株倍性,单倍体率为97%、二倍体率为3%。
关键词: 西瓜;未受精子房;单倍体;倍性鉴定
Study on the technology of unfertilized ovary culture in watermelon
GONG Si,LIANG Shaohua,YAN Jingyi,ZOU Tian,YANG Jie,CHU Xiao,CHEN Zenan,SUN Xiaowu
(College of Horticulture and Landscape, Hunan Agricultural University,Changsha 410128,Hunan, China)
Abstract: In vitro culture of unfertilized ovary of watermelon is an effective method for haploid breeding. In this experiment, unfertilized ovaries of ‘Zaojia were chosen to study the factors affecting the germination rate of unfertilized ovary, also identify the regenerated plant ploidy. The results showed that the cultivation season was an important factor on the in vitro culture of unfertilized ovary of watermelon. In the same cultivate conditions, the induction rate which draw materials of autumn was 21.33%, about 6% higher than that in spring. The lowest and highest temperature of the day when materials selected also affect the induction rate, within the range of the 21-35 ℃, the average induction rate can reach 10%, significantly higher than the induction rate on the temperature too low or too high; Low temperature pretreatment (4 ℃) can not improve the efficiency of watermelon embryoid induction rate. We acquired 36 regeneration plants and used chromosome counting and flow cytometry to determine the ploidy levels of them. The ploidy of regeneration plants was clarified as 97% haploid, 3% diploid.
Key words: Watermelon; Unfertilized ovary; Haploid; Ploidy identification
西瓜(Citrullus lanatus)属于葫芦科西瓜属,目前作为中国一种重要的园艺经济作物,在全世界范围内都有广泛的种植。传统的西瓜育种技术需要通过至少8代的反复自交筛选后获得纯系植株,因此,传统育种方法限制了新品种的研究,不能满足中国现阶段新型农业发展的需求。单倍体育种获得的双单倍体(DH)不存在等位基因位点的显隐性作用,隐性基因控制的性状能够充分体现,故可极大降低育种材料的误选概率,提高育种效率。与此同时,单倍体育种获得的完全纯合同质的双单倍体群体,可作为数量性状研究、分子标记与遗传分析的良好材料。但西瓜单倍体自然产生概率低[1],无法满足育种研究进程,因此,人工诱导产生单倍体植株十分重要。
目前人工诱导单倍体方式主要是孤雄生殖与孤雌生殖两种方式,孤雄生殖通过花药和小孢子培养在结球甘蓝、青花菜、萝卜等十字花科作物中已有较成熟的进展[2-3],而葫蘆科作物起步晚,虽然在西瓜、黄瓜、苦瓜等作物上有过研究报道,但是获得的结果都不理想[4-7]。目前,未受精子房离体培养是获得西瓜单倍体植株的最佳途径。李迎迎等[8]对西瓜在3种基因型未受精子房离体培养中获得了4棵再生苗,利用流式细胞仪鉴定了再生植株倍性,结果表明,1株为四倍体,其余3株为单倍体与二倍体的嵌合体植株。邹甜等[9]在西瓜未受精子房离体培养中发现,基因型是影响西瓜未受精子房离体培养的关键因素,对培养基成分、激素浓度进行了筛选,并对50株再生植株进行倍性鉴定,结果分析单倍体率为96%,二倍体率为4%,未发现四倍体与嵌合体。至今,虽然西瓜未受精子房离体培养研究较多,但是主要集中在基因型筛选、培养基成分、激素种类与浓度等方面的研究[9-16],且胚状体诱导率低,供体植株栽培季节、取材时日气温差异、未受精子房低温预处理等对植株离体雌核发育有重要影响[17-21],但西瓜有关此方面的研究尚未见报道。
针对上述问题,笔者以西瓜‘早佳品种为试材,进一步分析大棚春秋季不同栽培时间、日最高与最低气温、低温冷冻预处理时间等对未受精子房离体培养出胚率的影响,并在前人的研究基础上筛选西瓜未授粉子房离体培养的分化培养基,且对再生植株进行了倍性鉴定。旨在为建立高效稳定的西瓜单倍体诱导技术体系奠定基础,为今后西瓜新品种的选育与育种新材料创制提供依据。
1 材料与方法
1.1 材料
供试西瓜品种‘早佳由湖南雪峰种业有限责任公司提供,为杂交一代材料(2n=2x=22),试验于2017年1—12月在湖南农业大学温室大棚与湖南省瓜类工程技术研究中心进行。
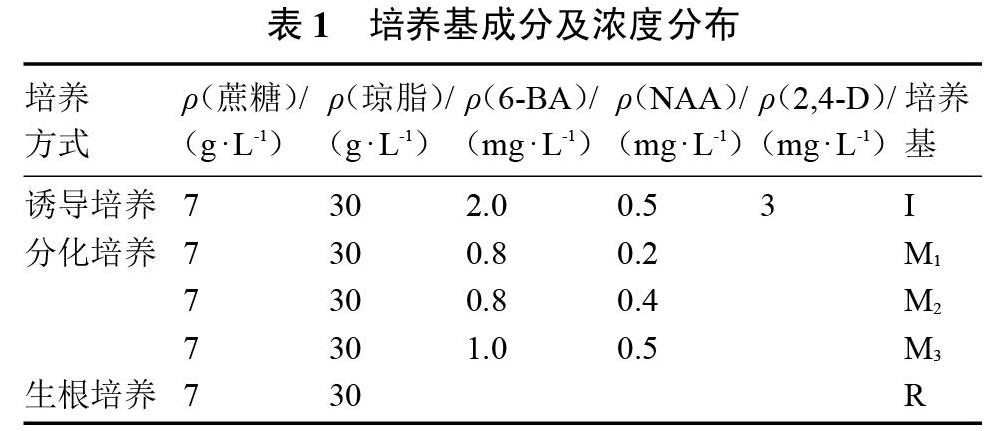
诱导、分化、生根培养基以MS为基本培养基,并附加不同浓度配比的2,4-D、6-BA、NAA等激素,pH调至5.8,培养基成分见表1。
1.2 处理及培养方法
1.2.1 未受精子房的采集与消毒 从第2个雌花节位以后开始取材,开花前一天17:30—18:00点套袋,开花当天7:30—8:00用装有碎冰的泡木箱取样,取回材料立即处理或者放置4 ℃冰箱保存后进行消毒切片试验,不能放置在常温条件下避免2次成熟。首先摘取子房并流水清洗,在超净工作台上先用75%的乙醇消毒1 min、无菌水冲洗3次,滤纸吸干表面水分后削皮切片成1 mm左右的薄片,而后立即放置2%的NaClO溶液消毒4 min、无菌水反复冲洗5次,无菌滤纸吸干表面水分至胚珠暴露后接种到预先准备的诱导培养基中,每个处理接种5瓶并设计3次重复,每瓶接种8片。
1.2.2 诱导培养 先在35 ℃通风透气的恒温箱里黑暗热激处理4 d,热激处理后胚珠膨大呈嫩黄色,接着放置光照为16 h·d-1,光强2 500 Lx、温度(25±1)℃的组培室培养,组培室诱导培养5 d左右胚珠大部分转绿。
1.2.3 分化培养 诱导培养15 d后,将子房片在超净工作台上转移至分化培养基,放置组培室继续培养,转绿后的胚珠部分变黄,部分形成胚状体,培养30 d左右会开始出胚,以后每隔5 d统计1次出胚数直至培养到60 d截止,出胚率为总出胚数与总接种子房片数的百分比。
1.2.4 生根培养 待胚状体继续生长分化出明显的形态学上端与下端后,在超净工作台上转移至MS生根培养基中,不添加辅助激素以促进胚状体生根,并放于组培室继续培养至长成再生植株,再生植株可在超净工作台上通过新长出的带芽节位进行扩繁,之后通过选取根尖与叶片进行倍性鉴定。
1.3 栽培季节对西瓜未受精子房离体培养出胚率的影响
1月中旬育苗,1—6月为春季栽培取材时间,9月中旬育苗,9—12月为秋季栽培取材时间,在生长阶段进行同样的水肥管理,春季栽培与秋季栽培材料在培养阶段用M1、M2、M3进行胚状体诱导试验,材料处理及培养方法如1.2。
1.4 日最高与最低气温对西瓜未受精子房离体培养出胚率的影响
在秋季栽培出胚率较高的9月16—27日连续12 d对生长环境进行监测,包括天气、日最高气温、日最低气温等,统计每天西瓜未受精子房离体培养的出胚率。
1.5 冷冻预处理对西瓜未受精子房离体培养出胚率的影响
以每日同一批采回的西瓜未受精子房为材料,放置4 ℃冰箱分别冷冻预处理1、2、3 d,以不做低温预处理的新鲜材料作对照,材料处理及培养方法如1.2。
1.6 再生植株倍性鉴定方法
1.6.1 染色体计数法 当根长至1~2 cm时取0.4~0.5 cm根尖进行预处理,预处理后用无菌水冲洗多次后再用固定液固定12~24 h。经固定后的根尖可用无菌水冲洗后进行解离,也可置于70%的酒精溶液中保存。解离后的根尖用无菌水冲洗3次后浸入改良品红中染色。将染色后的根尖取出置于洁净载玻片上,切除伸长区(约0.1 cm)后滴1滴45%醋酸溶液,覆上盖玻片,然后可用镊子轻轻敲片,以便根尖组织散开,即可在高倍显微镜下观察。选取染色体分散较好的体细胞进行拍照,并统计染色体数。
1.6.2 流式细胞仪检测 流式细胞术是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它能高速分析上万个细胞,并能同时从一个细胞中测得多个参数。取新鲜待测植物叶片0.5 cm2,置于培养皿中,取Partec CyStain UV Precise P裂解液400 ?L加于植物叶片周围,用刀片将叶片切碎,以充分提取出完整的细胞核,提取时间取决于样本性质,一般为10 s,后将培养皿中的液体用30 ?m滤网过滤至样品管中,向样品管中加入Partec CyStain UV Precise P染液1 600 ?L,染色时间取决于样本性质,一般为10 s,上机测定植株细胞DNA的相对含量。
1.7 数据处理
试验数据采用SPSS 20.0与Excel 2007软件进行统计分析。
2 结果与分析
2.1 胚状体发育过程及诱导成苗
据试验觀察,胚状体发育及诱导成苗过程如图1,在35 ℃烘箱热激4 d后,通过外界的适度高温胁迫,胚珠抗逆反应,显著膨大,呈嫩黄色(如图1-a)。转移至组培室后光暗培养5 d左右胚珠转绿,此时大部分胚珠都会转绿,但并不是转绿的胚珠都会分化成胚状体,转绿的胚珠又会变黄(如图1-b)。在组培室培养大约30 d后会逐渐形成肉眼可见的黄绿色胚状体(如图1-c),待胚状体分化出明显的形态学上端与下端时转至MS生根培养基中,最终生长成完整的植株(如图1-d)。
2.2 栽培季节对西瓜未受精子房离体培养出胚率的影响
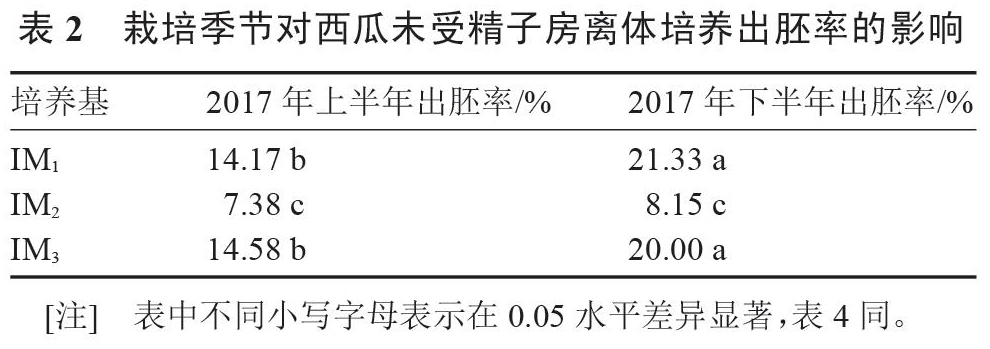
由表2可知,2017下半年西瓜‘早佳品种未受精子房在诱导效果较好的分化培养基M1、M3中出胚率可达21.33%、20.00%,均显著高于2017上半年出胚率,而在M2中同样略高于上半年的出胚率。由分析结果可以得出下半年种植栽培(即秋季栽培)条件下更有利于诱导胚状体的产生。
2.3 日最高与最低气温对西瓜未受精子房离体培养出胚率的影响
由表3可知,2017年9月连续12 d内出胚率有6 d在10.00%以上,分别为15.00%、17.78%、11.79%、12.17%、13.33%、10.00%,相对应的日最高气温/最低气温(℃)分别为31/22、32/22、31/22、25/22、27/21、32/21,由此可见,在日最高气温低于32 ℃、日最低气温高于21 ℃条件下胚状体诱导率相对较高。说明日气温过高或过低对未受精子房离体培养诱导出胚不利。
2.4 冷冻预处理对西瓜未受精子房离体培养出胚率的影响
由表4可以看出,4 ℃冷冻预处理0 d时出胚率为10.00%,显著高于4 ℃低温冷冻预处理1、2、3 d时的出胚率。由分析结果可以得出,西瓜未受精子房不进行冷冻预处理时更有利于诱导胚状体的发生。
2.5 胚状体成苗情况
通过对胚状体后期生长状况的观察与记录,笔者在胚状体分化生长成完整植株的过程中发现了一些不完全发育的胚状体,结果如图2,主要分为无生长点植株(图2-a)、白化苗(图2-b)、生长缓慢植株(图2-c)、玻璃化植株(图2-d)以上4类。
2.6 再生植株的鉴定
本试验共得到58株再生植株,我们利用染色体计数法与流式细胞仪检测2种方法对其中36株植株进行了倍性鉴定,结果发现其中35株为单倍体,只有1株为二倍体,根尖染色体计数法如图3,流式细胞仪鉴定结果如图4。
3 讨 论
在之前的研究中,‘早佳品种在西瓜未受精子房离体培养中出胚率最高[9],但总体来说西瓜未受精子房离体培养出胚率偏低,说明诱导体系还有待进一步的优化。植物未受精子房离体培养研究中发现春、秋不同的栽培季节,胚状体诱导率存在显著性差异。谢冰等[19]在西葫芦的培养研究中,秋播材料出胚率明显高于春播材料,认为这可能与西葫芦是短日性植物有关。魏爱民等在黄瓜未受精子房离体培养研究中,显示单倍体胚胎的发生率及植株的再生率在秋季温度较高的6、7和9月份更容易发生,且明显高于其他季节[17]。本试验与前人研究结果一致,西瓜秋季栽培取材的胚状体诱导率显著高于春季,这也可能与西瓜植株的生长喜欢温暖干燥的气候环境有关。
供体植株取材时日最高气温低于32 ℃、日最低气温高21℃时出胚率保持在10.00%以上,高于其它温度条件下的胚状体诱导率,说明温度对西瓜未受精子房离体培养出胚率的影响很大,这可能与西瓜生长发育最适温度为24~30 ℃、根系生长最适温度为30~32 ℃有关。此项研究仅供参照,由于供体植株的生长环境(温度、光照等)对出胚率的影响较大,更具体的结果需做更规律性的研究。
而西瓜未受精子房在不做低温预处理的情况下出胚率最高,这与草莓4 ℃低温预处理2 d能提高未受精子房出胚率的结果不一致[20],但是随着预处理时间的延长出胚率并没有降至零或者有规律的持续降低,说明4 ℃冷冻处理对胚珠活力保持起到一定的作用,本试验可能存在误差,具体的结果需要更具体的研究。
在本次研究工作中,除了未受精子房离体培养出胚率仍偏低这个主要问题以外,在胚状体分化成完整植株的过程中也遇到了一些问题,比如说植株无生长点、白化苗、植株生长缓慢、植株玻璃化等现象。闵子扬等[22]在南瓜未受精子房离体培养中有提到类似问题,这可能与在诱导培养阶段使用的激素种类与浓度有关,也有可能与胚状体在分化培养基上生长的时间有关。在下一步研究工作中,需要调整激素组成与浓度,按阶段对胚状体的分化状态进行记录,确定转移至生根培养基的最佳时期。
倍性鉴定结果得出再生植株单倍体率为97%、二倍体率为3%,未发现嵌合体与四倍体。这与Zou等[9]在西瓜单倍体培养试验中再生植株倍性鉴定结果一致,由于DNA流式细胞仪测定可靠性较高、方法简便易懂等特点,已成为倍性检测的一种新手段,运用到了草莓、甘蓝、黄瓜、西葫芦、西瓜等多种作物倍性鉴定的研究[15-19]。笔者用流式细胞仪基本确定了再生植株的倍性,并用根尖染色体计数法进一步验证了其倍性。
4 结 论
笔者建立了比较完善的西瓜未受精子房离体培养体系,提高了胚状体诱导率,获得了较多的再生植株,并且形成了一套较为精确的西瓜再生植株倍性鉴定方法,试验结果对后续试验具有重要的参考意义。接下来的试验应对获得的西瓜单倍体植株进行驯化移栽、染色体加倍等工作,希望本试验成果能早日运用到育种工作中。
参考文献
[1] SARI N,ABAK K,PITRAT M,et al.Induction of parthenogenetic haploid embryos after pollination by irradiated pollen in watermelon[J].Hortscience A Publication of the American Society for Horticultural Science,1994,29(10):1189-1190.
[2] 袁素霞,劉玉梅,方智远,等.结球甘蓝和青花菜小孢子胚植株再生[J].植物学报,2010,45(2):226-232.
[3] 李金荣,欧承刚,庄飞云,等.胡萝卜游离小孢子培养及其发育过程研究[J].园艺学报,2011,38(8):1539-1546.
[4] 胡雪丹,张曼,徐锦华,等.葫芦科作物游离小孢子培养研究进展[J].江苏农业科学,2016,44(6):25-29.
[5] 缑艳霞,张明方.西瓜花药离体培养影响因子研究[J].北方园艺,2013(10):117-120.
[6] 詹艳,陈劲枫,MALIK A A.黄瓜游离小孢子培养诱导成胚和植株再生[J].园艺学报,2009,36(2):221-226.
[7] 唐懿,李万宁,刘继,等.苦瓜花药培养研究进展[J].长江蔬菜,2010(24):4-7.
[8] 李迎迎.西瓜未授粉子房离体培养技术的研究[D].郑州:河南农业大学,2017.
[9] TIAN Z,HE-NAN S,QI W.Haploid induction via unfertilized ovary culture in watermelon [J].Plant Cell,Tissue and Organ Culture,2018,135:179-187.
[10] 王烨,顾兴芳,张圣平,等.黄瓜未受精胚珠离体培养及单倍体植株再生[J].园艺学报,2015,42(11):2174-2182.
[11] 李玲,闵子扬,童龙,等.西瓜未授粉子房的离体培养[J].中国瓜菜,2014,27(6):6-10.
[12] 徐洪国,宣杨,仲娟娟,等.小果型西瓜子叶节离体培养[J].中国瓜菜,2018,31(3):38-40.
[13] 王烨,顾兴芳,张圣平.预处理和外源激素对黄瓜未授粉子房的胚状体诱导的影响[J].华北农学报,2008(S1):50-53.
[14] 刘颖颖,刘世琦,薛小艳,等.大蒜未受精子房离体诱导单倍体的研究[J].园艺学报,2013,40(6):1178-1184.
[15] 賈思齐,王超,王帅,等.甘蓝未受精子房离体培养及再生植株倍性的鉴定[J].中国农学通报,2017,33(18):42-48.
[16] 荣文娟,刘君璞,朱迎春,等.西瓜未受精胚珠离体培养若干影响因素的研究[J].中国瓜菜,2015,28(3):9-13.
[17] 魏爱民,韩毅科,杜胜利,等.供体植株栽培季节和栽培方式对黄瓜未受精子房离体培养的影响[J].西北农业学报,2007(5):141-144.
[18] TOSCA A,ARCARA L,FRANGI P.Effect of genotype and season on gynogenesis efficiency in Gerbera[J].Plant Cell,Tissue and Organ Culture,1999,59(1):77-80.
[19] 谢冰.西葫芦的离体雌核发育及植株再生[D].山东泰安:山东农业大学,2005.
[20] 王文和,吴禄平,赵玉萍.草莓未受精子房的离体培养[J].中国农学通报,2011,27(13):177-182.
[21] 黄金华,董彦琪,王文英,等.葫芦科蔬菜单倍体育种技术研究进展——未授粉子房离体培养技术[J].中国瓜菜,2016,29(5):1-4.
[22] 闵子扬,李涵,邹甜,等.南瓜未授粉子房离体培养及植株再生[J].植物学报,2016,51(1):74-80.
- 论体验式教学在物流实践教学中的适用性
- 生产与运作管理教学探讨
- 物流箱式货车防盗锁创新设计
- 计算机物联网技术在物流领域中的创新
- 现代物流系统中智能移动机器人的自主性控制技术分析
- 高职院校物流管理专业工学结合人才培养模式研究
- 基于电气控制传送线在物流职业教育中的应用
- 基于物流工程的应用技术大学物流专业实践教学优化研究
- 中国制造2025的高校物流管理专业教改意义
- 适应自贸区跨境物流业需求的高职报关与国际货运专业人才培养研究
- 基于Sakai系统的物流网络教学资源整合研究
- 基于CBVE理念的船舶代理人才培养研究
- 军事物流信息资源标准体系研究
- 电商环境下双渠道供应链的冲突协调研究
- 数字化制造驱动下服务供应链转型研究
- 生活必需品市场供应风险管理研究
- 我国跨境电商物流中的海外仓储建设研究
- 高速铁路列车加开方案经济效益博弈分析
- 基于甩挂运输组织的车辆路径优化
- “一带一路”战略背景下我国煤炭绿色物流运输优化研究
- 城市公交站点选址评价分析
- 城市出租车驾驶员违章行为研究
- 基于似三棱柱的长大货物联运路径优化方法
- 物流业发展升级助力供给侧结构性改革策略研究
- “互联网+”对物流信息系统的影响
- unbewildered
- unbewildering
- unbewilderingly
- unbewitch
- unbewitched
- unbiased
- unbiasednesses
- unbias(s)edly
- unbickered
- unbickering
- unbigged
- unbigoted
- unbilled
- unbilleted
- unbinned
- unbiological
- unbiologically
- unbishoped
- unbit
- unbiting
- unbitten
- unbitterer
- unbitterest
- unblacked
- unblade
- 深切顾念和怜悯
- 深刑
- 深到极点的洞
- 深刺腧髓
- 深刻
- 深刻切实
- 深刻卓越的认识和见解
- 深刻吏
- 深刻地思考
- 深刻地觉悟
- 深刻地醒悟
- 深刻地领会
- 深刻明显
- 深刻 深沉
- 深刻理解
- 深刻的含意
- 深刻的意义
- 深刻的意旨
- 深刻的言论
- 深刻的议论
- 深刻研究
- 深刻而丰富
- 深刻而透彻
- 深刻而道理浅
- 深刻而长远