肖梓颖 王一帆 梁雪茹 黄郁葱

摘要 [目的] 獲得卵形鲳鲹(Trachinotus ovatus)HSP30基因并探讨其组织表达。 [方法]采用RACE的方法从卵形鲳鲹脾组织克隆HSP30基因的cDNA 全序列,并用荧光定量PCR分析在健康鱼及哈维氏弧菌感染后HSP30基因的组织表达。[结果]HSP30基因cDNA序列全长913 bp,包含5′非编码区(5′UTR)89 bp、3′非编码区(3′UTR)188 bp,开放阅读框(ORF)636 bp,编码211个氨基酸。预测其氨基酸序列成熟肽的蛋白分子质量为24.1 kD,理论等电点为5.62。HSP30包括N-末端序列(NTS)、α-晶状体蛋白结构域(ACD)、C-末端序列(CTS)和C-末端延伸(CTE)。系统进化分析结果显示卵形鲳鲹HSP30与高体鰤(Seriola dumerili)HSP30聚为一支。卵形鲳鲹HSP30基因在各组织中均有不同程度的表达,其中肝组织中表达量最高,其次为皮肤、肌肉、脾、心、肾,其他组织的表达量较低。哈维弧菌侵染卵形鲳鲹后,肝、脾和肾组织中HSP30基因mRNA 表达量均升高,肝组织中变化最显著。[结论]成功克隆了卵形鲳鲹HSP30基因,为进一步揭示卵形鲳鲹HSP30的抗菌免疫应答机制提供了理论依据。
关键词 卵形鲳鲹;热休克蛋白;HSP30;基因克隆;组织表达
中图分类号 S917.4文献标识码 A
文章编号 0517-6611(2021)02-0081-06
doi:10.3969/j.issn.0517-6611.2021.02.024
开放科学(资源服务)标识码(OSID):
Cloning and Tissue Expression of HSP30 Gene from Trachinotus ovatus
XIAO Ziying,WANG Yifan,LIANG Xueru et al (Fisheries College of Guangdong Ocean University/Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals of Guangdong&Key Laboratory of Control for Diseases of Aquatic Economic Animals of Guangdong Higher Education Institute,Zhanjiang,Guangdong 524088)
Abstract [Objective]To obtain the HSP30 gene of Trachinotus ovatus and to study its tissue expression.[Method]The full length cDNA sequence of the HSP30 gene was cloned by rapid amplification of cDNA ends (RACE) from the spleen of T.ovatus,and its expression profiles in tissues of the health fish and the fish infected with Vbirio harveyi were also analyzed by quantitative real time PCR (qRTPCR).[Result]The total cDNA sequence of T.ovatus HSP30 was 913 bp,including 5′ UTR of 89 bp,3′UTR of 188 bp,and an open reading frame (ORF) of 636 bp encoding 211 amino acids with molecule mass of 24.1 kD and PI of 5.62.The predicted HSP30 protein included an Nterminal sequence (NTS),an αcrystallin domain (ACD),a Cterminal sequence (CTS) and a Cterminal extension (CTE) in structure.Phylogenetic analysis showed that T.ovatus was clustered closely with Seriola dumerili.The qRTPCR analysis showed that T.ovatus HSP30 gene expressed in all examined tissues with the highest levels in liver,moderate levels in skin,muscle,spleen,heart,kidney,low levels in other tissues.The mRNA expression levels of HSP30 were significantly upregulated in the liver,spleen and kidney issues,especially in the liver.[Conclusion]The HSP30 gene of T.ovatus was successfully cloned,which will provide a theoretical basis for further elucidating the mechanism of antibacterial immune response of T.ovatus HSP30.
Key words Trachinotus ovatus;Heat shock protein;HSP30;Gene cloning;Tissue expression
热休克蛋白(heat shock proteins,HSPs) 是一类结构高度保守的应激反应伴侣蛋白,可响应各种应激而合成,参与各种细胞过程,如蛋白质折叠、蛋白质运输以及蛋白质复合物组装/拆卸和降解,维持细胞的稳态[1]。很多研究都表明HSP还参与炎症、免疫、细胞分化、抗氧化、抗辐射以及抗癌细胞增殖等生物学功能[2-3]。根据HSP分子、结构和功能,分为6个家族,包括小分子HSP(sHSP)、HSP40、HSP60、HSP70、HSP90和大分子HSP[2]。 HSP分子量大小为10~110 kD。此外,它们的特定部位和生理作用会根据其大小在细胞内发生变化。HSP30为sHSP家族的重要成员,其蛋白结构包括N-末端序列(N-terminal sequences,NTS)、α-晶状蛋白结构域(α-crystallin domain,ACD)、C-末端序列(C-terminal sequences,CTS)和C-末端延伸(C-terminal extension,CTE),在目前已发现的非哺乳动物和原核生物中具有高度的保守性。HSP30具有sHSP家族的类似功能,通过形成寡聚体(分子量100~800 kD)发挥其分子伴侣作用,防止错误折叠并加快蛋白质的重新折叠和复性[4]。
目前已有两栖动物[5]和鸟类[6]中HSP30的研究报道,尤其是非洲爪蟾(Xenopus tropicalis)HSP30的研究较为深入,而鱼类HSP30的研究相对较少,目前中华鲟(Acipenser sinensis)[7]、虹鳟(Oncorhynchus mykiss)[8]、金鱼(Carassius auratus)[9]和斑马鱼(Danio rerio)[10]的HSP30基因已得到克隆鉴定,研究表明鱼类的HSP30在热应激和刺激下,参与应激反应和保持内稳态的平衡[11-12]。卵形鲳鲹(Trachinotus ovatus)是我国南方沿海地区近岸和深远海养殖的重要经济鱼种,然而集约化养殖规模的不断扩大和养殖环境日趋恶化,各种病害频繁暴发[13-14],导致巨大的经济损失,成为制约其产业发展壮大的瓶颈。最近研究发现,HSP30还参与抗病毒免疫反应[15]。目前鲜见卵形鲳鲹HSP30基因的研究报道。该研究运用RACE方法克隆卵形鲳鲹HSP30基因cDNA 全长序列,应用实时荧光定量PCR(quantitative Real-Time PCR,qRT-PCR)检测HSP30基因在健康卵形鲳鲹及哈维弧菌(Vibrio harveyi)感染后卵形鲳鲹组织中的诱导表达,以期为进一步研究该基因在先天免疫中的功能提供理论依据。
1 材料与方法
1.1 材料 试验用健康卵形鲳鲹(平均体重约100 g)购自湛江某深海养殖网箱,哈维氏弧菌强毒株TOZJ1705由实验室分离自患病卵形鲳鲹并冻干保存。总RNA抽提试剂盒(EasyPureRNA Kit)、组织基因组提取试剂盒(EasyPureMarine Animal Genomic DNA Kit)和反转录试剂盒(EasyScriptOneStep gDNA Removal and cDNA Synthesis SuperMix)购自北京全式金公司;琼脂糖凝胶回收试剂盒(GeneJET)购自Thermo 公司;SMARTerTM RACE cDNA Amplification Kit 等购自TaKaRa 公司;实时荧光定量试剂盒(SYBRSelect Master Mix)购自ABI公司。
1.2 哈维氏弧菌感染及样品采集
将哈维氏弧菌强毒株TOZJ1705接种于TSB(1.5%NaCl)培养基中,28 ℃振荡培养10 h,用平板计数法计数菌液浓度,将哈维氏弧菌菌液用生理盐水调整其浓度为1.2×108 CFU/mL。将试验鱼分成2组,感染组每尾鱼腹腔注射哈维氏弧菌菌液0.1 mL,对照组注射等量无菌生理盐水,于感染后的0、3、6、12、24、48和72 h分别采集肝、脾和肌肉组织,每个时间点采集5尾卵形鲳鲹,组织用液氮固定后保存于-80 ℃。收集的组织主要用于qRT-PCR分析。同时取5尾健康鱼的鳃、肝、脾、肾、肠、肌肉和皮肤等组织立即置于液氮中,用于cDNA全长克隆和组织分布分析。
1.3 总RNA提取和cDNA一链合成
参考说明书分别提取卵形鲳鲹各组织总RNA。1.2%琼脂糖凝胶电泳检测总RNA的完整性,紫外分光光度法检测其纯度和浓度。参考说明书合成cDNA第一链,置于-40℃保存备用。另取肝、脾组织的总RNA,按SMARTerTM RACE cDNA Amplification Kit说明书分别合成用于3′与5′ RACE的cDNA,置于-80 ℃保存备用。参考说明书分别提取卵形鲳鲹组织DNA。
1.4 3′RACE、5′RACE和基因扩增
根据转录组测序获得的HSP30基因部分mRNA设计HSP30全长cDNA的3′RACE和5′RACE特异引物(表1)。3′HSP30F1、5′HSP30R1分别与引物UPM Mix进行3′与5′ RACE第一轮touch-down PCR扩增。反应条件为94 ℃ 4 min,94 ℃ 30 s,68 ℃ 1 min,5個循环;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 1 min,5个循环;94 ℃ 30 s ,62 ℃ 30 s,72 ℃ 1 min,25个循环,72 ℃延伸6 min,16 ℃保存。将第一轮PCR产物稀释10倍为第二轮PCR的模板,分别将3′HSP30F2、5′HSP30R2与引物NUP进行第二轮PCR扩增,反应条件为94℃ 4 min,94℃ 30 s,65 ℃ 30 s,72℃ 1 min 35个循环,72℃延伸6 min,16 ℃保存。PCR反应产物经1.2%琼脂糖凝胶电泳,扩增产物用琼脂糖凝胶DNA回收试剂盒进行回收,回收产物与pMD-18T 载体连接并转化DH5α感受态,阳性克隆送至生工生物工程(上海)股份有限公司进行测序。根据获得cDNA全序列,设计1对基因特异引物HSP30-F/HSP30-R,以基因组DNA为模板,扩增HSP30全长基因序列,方法与3′RACE第二轮PCR扩增、产物回收及克隆测序相同。
1.5 生物学信息分析
使用在线Blast程序进行序列同源性比对和相似性分析;使用Genetyx 6.0和Protparam推导开放阅读框(open reading frame,ORF)、分子量(Mw)和理论等电点(pI)等;SignalP 4.0 Server和TMHMM Server 2.0分别预测信号肽和跨膜结构域;PSITE预测氨基酸的功能位点分布;运用SMART分析蛋白质功能结构域;采用SOPMA预测蛋白二级结构;采用SWISS-MODEL预测蛋白质三维结构;使用ClustalX 2.1及MEGA 10.0 软件以邻位相连法(Neighbor-Joining)构建系统进化树,自检数为1 000。
1.6 qRT-PCR和数据统计与分析 根据HSP30基因ORF设计特异引物reHSP30F和reHSP30R(表1),以β-actin为内参基因,利用ABI7300实时荧光定量PCR仪对卵形鲳鲹HSP30基因的表达量进行分析,每个样本设3个重复。qRT-PCR反应条件为94℃ 3 min,94℃ 20 s,60℃ 20 s,60℃ 30 s,40 个循环。采用2-ΔΔCt法计算卵形鲳鲹HSP30 cDNA的相对表达量[16],应用SPSS 21.0软件对数据进行ANOVA单因素方差分析和Tukey HSD多重比较。
2 结果与分析
2.1 cDNA克隆与氨基酸序列分析 卵形鲳鲹HSP30基因cDNA序列全长913 bp(图1),包含89 bp 5′非编码区(untranslated region,UTR),188 bp 3′ UTR,636 bp ORF,推导编码211个氨基酸,预测其理论分子量为24.1 kD,等电点为5.62。SignalP 4.0 Server分析显示HSP30蛋白氨基酸序列不含信号肽,TMHMM Server 2.0预测显示该蛋白氨基酸序列不存在跨膜结构域。该蛋白氨基酸序列含有一个典型的HSP家族所有的特征基序,PSITE蛋白氨基酸序列含有1个N-糖基化位点,5个蛋白激酶C磷酸化位点,7个酪蛋白激酶Ⅱ磷酸化位点,1个酰胺化位点,1个CAAX box,2个微体C-末端定位信号序列,1个亮氨酸拉链结构。PSORT Ⅱ预测结果显示在细胞中细胞核、细胞质、线粒体和细胞骨架分布的概率分别为60.9%、21.7%、13.0%和4.3%。根据获得的HSP30全长cDNA序列,设计一对基因特异性引物HSP30F和HSP30R,以卵形鲳鲹基因组DNA为模板进行PCR扩增,PCR产物经琼脂糖凝胶及测序鉴定,所得序列与在cDNA模板中扩增的结果完全一致,表明卵形鲳鲹HSP30基因无内含子。
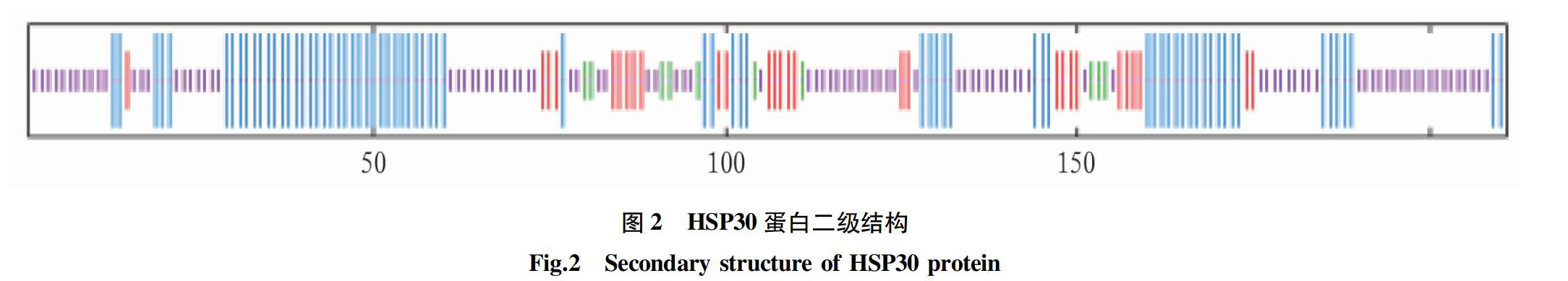
2.2 蛋白结构分析 卵形鲳鲹HSP30基因cDNA 编码211个氨基酸残基中,有24个碱性氨基酸(K,R),占氨基酸总数的11.37%;32个酸性氨基酸(D,E),占氨基酸总数的15.2%。亲疏水性的平均值为-0.738,表明该蛋白为亲水性蛋白。应用SOPMA在线软件对HSP30蛋白进行二级结构分析,结果显示,HSP30 蛋白分子二级结构中的α-螺旋占34.12%,β-转角占4.74%,无规卷曲占46.92%,延伸链占14.22%(图2)。将卵形鲳鲹HSP30氨基酸序列提交至SWISS-MODEL程序,自动搜索同源蛋白4yl9.1.A作模板,得到HSP30三级结构模型(图3),结果显示卵形鲳鲹HSP30空间结构包括5个α-螺旋,16个β-折叠。
2.3 氨基酸同源性比较及系统进化分析
利用NCBI的Blastp软件将卵形鲳鲹HSP30蛋白氨基酸序列与GenBank数据库中其他物种的HSP30蛋白氨基酸序列进行同源性比对,结果发现卵形鲳鲹HSP30蛋白与高体鰤(Seriola dumerili)同源率为93.33%,与斑马鱼、短吻鳄(Alligator mississippiensis)、椋鸟(Sturnus vulgaris)、原鸡(Gallus gallus)、中华鲟和爪蟾HSP30蛋白分子的同源性較低,分别为57.30%、37.67%、32.50%、31.29%、30.86%和30.69%。氨基酸序列比对发现,鱼类、两栖类、爬行类和鸟类的HSP30蛋白分子均由N-末端序列(NTS)、α-晶状体蛋白结构域(ACD)、C-末端序列(CTS)和C-末端延伸(CTE)组成,其中ACD较为保守(图4)。ACD 中的丝氨酸磷酸化位点在卵形鲳鲹、斑马鱼、中华鲟、爪蟾和短吻鳄氨基酸序列中均存在,而在原鸡、椋鸟氨基
酸序列中未发现此位点。CTS中的I-X-I基序存在于非洲爪蟾、斑马鱼和短吻鳄氨基酸序列中,中华鲟序列中为V-P-I,在卵形鲳鲹和原鸡中均未发现此基序。利用MEGA 10.0的Neighbor-Joining法构建的HSP30蛋白分子系统进化树显示(图5),卵形鲳鲹与同属鲈形目的高体鰤聚成一簇,然后再与其他鱼类聚成一个大的分支,两栖类和爬行类及鸟类形成独立的进化分支,与Blastp结果相一致。
2.4 HSP30 mRNA组织表达分布 应用qRT-PCR检测了HSP30基因mRNA在卵形鲳鲹各组织中的分布,以脑组织的mRNA表达量为基准,结果显示在脾、肾、肠、鳃、肝、心、肌肉和皮肤组织中均有不同程度的表达,其中肝组织中表达量最高,其次为皮肤、肌肉、肾、心,其他组织中的表达量较低(图6)。
2.5 哈维氏弧菌感染后HSP30 mRNA的表达分析
应用qRT-PCR检测了哈维氏弧菌感染卵形鲳鲹0、3、6、12、24、48和72 h后HSP30 mRNA在卵形鲳鲹肝、脾和肾组织中的表达变化。如图7所示,肝、脾和肾组织中HSP30 mRNA的表达量分别在3、3和6 h达到最高,显著高于对照组(P<0.01),然后开始下降,于感染后48 h再次上升到较高水平(P<0.01),然后缓慢降低,72 h仍高于对照组。
3 讨论
该研究成功克隆了卵形鲳鲹HSP30基因cDNA全序列,发现基因序列中不含内含子,与爪蟾[4]、美洲牛蛙(Rana catesbeiana)[17]、中华鲟[7]、斑马鱼[10]的研究结果相一致,而且在许多不同的HSP基因中均已存在[4]。这种不存在内含子的初级转录本不必经过剪接即可产生成熟的mRNA进行翻译,使它们能够有效表达小分子热激蛋白,从而保证了小分子热休克蛋白对应激源的快速响应;而在含有内含子的热休克蛋白(如HSP90)中,由于高温的极端压力可以使剪接机器失活从而抑制了热休克蛋白的表达[18]。HSP30蛋白氨基酸序列分析结果表明HSP30分子含有保守的CTS和ACD,而NTS和CTE保守性较差[19]。HSP30中的NTS、ACD 和CTS结构域可能以底物特异性方式参与靶蛋白结合[20]。小分子热休克蛋白基因的ACD中的丝氨酸是潜在的MAPKAPK-2 磷酸化位点[16],在两栖类、爬行类、鱼类中均存在,而在鸟类中不存在。在大多数非哺乳动物脊椎动物CTS中都存在I-X-I基序,与二聚体或更大的寡聚复合物缔合的相邻单体的ACD中β4-和β8-链之间形成的疏水沟结合[6]。在青蛙、斑马鱼和鳄鱼HSP30中为I-P-1,而在中华鲟和椋鸟HSP30中为V-P-I,其中V为保守氨基酸取代,而该研究中卵形鲳鲹缺失了此基序。椋鸟ACD中丝氨酸磷酸化位点以及卵形鲳鲹I-X-I 基序的缺失表明HSP30在不同物种间可能具有不同的功能,需要进一步研究加以阐明。
非洲爪蟾的HSP30 mRNA在肾中表达量最高,在肝、肠和肺组织中表达量较低[21]。中华鲟HSP30基因在皮肤中的表达水平明显高于其他组织[7],卵形鲳鲹中各组织均有不同程度的表达,肝组织中表达量最高,表明HSP30基因在不同物种中组织表达分布存在差异。
当机体受到环境中各种物理、化学和生物等因素刺激时产生应激反馈,mRNA转录合成热休克蛋白,帮助机体应对外界刺激对机体的伤害[4]。据报道,虹鳟从10 ℃转移到25 ℃水环境中并保持3 h,发现HSP30 mRNA有不同程度的上调表达[8]。另外,大西洋鲑鱼(Salmo salar)从15 ℃转移到26 ℃水环境30 min后鳃组织可检测到HSP30 mRNA的积累[11]。此外,研究发现细菌和病毒感染会增加鱼HSP30 mRNA的表达。斑点叉尾鮰(Ictalurus punctatus)感染柱状黄杆菌(Flavobacterium columnare)后,鳃组织中的HSP30 mRNA表达量升高[22]。最近,有研究表明,神经坏死病毒(NNV)感染尖吻鲈上皮细胞后,HSP30mRNA的相对表达量增加了1 000 倍以上[15]。该研究中,在感染的最初几个小时内肝脏、肾脏和脾脏中的HSP30mRNA上调表达,随后恢复到基础表达水平,2 d后表达量再次升高,与嗜水气单胞菌(Aeromonas hydrophila)感染了露斯塔野鲮(Labeo rohita)的研究结果较为相似[23]。究其原因,可能是在细菌或病毒感染期间,未折叠的细菌、病毒或宿主蛋白可能会增加,这可能会触发HSF1途径,导致HSP30和其他应激诱导的HSP积累[4],仍需要更多的研究加以证实。
参考文献
[1]
ZININGA T,RAMATSUI L,SHONHAI A.Heat shock proteins as immunomodulants[J].Molecules,2018,23(11):2846-2863.
[2] BOLHASSANI A,AGI E.Heat shock proteins in infection[J].Clinica chimica acta,2019,498:90-100.
[3] DAS J K,XIONG X F,REN X C,et al.Heat shock proteins in cancer immunotherapy[J].Journal of oncology,2019,2019:1-9.
[4] HEIKKILA J J.The expression and function of hsp30-like small heat shock protein genes in amphibians,birds,fish,and reptiles[J].Comparative biochemistry and physiology.Part A:Molecular & integrative physiology,2017,203:179-192.
[5] KRONE P H,SNOW A,ALI A,et al.Comparison of regulatory and structural regions of the Xenopus laevis small heatshock proteinencoding gene family[J].Gene,1992,110(2):159-166.
[6] KATOH Y,FUJIMOTO M,NAKAMURA K,et al.Hsp25,a member of the Hsp30 family,promotes inclusion formation in response to stress[J].FEBS Letters,2004,565(1/2/3):28-32.
[7] 司凱歌,江南,张海耿,等.中华鲟热休克蛋白hsp30基因cDNA的克隆及其在高温胁迫下的表达分析[J].淡水渔业,2019,49(6):20-26.
[8] CURRIE S,MOYES C D,TUFIS B L.The effects of heat shock and acclimation temperature on hsp70 and hsp30 mRNA expression in rainbow trout:in vivo and in vitro comparisons[J].Journal of fish biology,2000,56(2):398-408.
- 京津冀协同发展背景下河北省公务员绩效管理改革思路
- 论PPP模式在公共体育场馆项目中的应用
- 互联网环境下企业盈利模式转变研究
- 企业游说行为的一个博弈论方法研究
- 两类用户对移动医疗软件选择影响因素对比研究
- 杭州市星级饭店空间分布特征及影响因素研究
- 京津冀地区养老地产项目调研和养老地产发展建议
- 一二线城市社区商业的定位方法研究
- 城市居民养老方式及支付能力分析
- 外贸新常态下跨境电子商务的发展研究
- “互联网+”背景下我国跨境贸易发展策略研究
- 文化维度视阈下国际商务文化意识的培养探索
- 河南省中小型农产品企业的农产品贸易发展现状分析
- 新型农村金融机构发展与农村金融体系完善
- 我国PPP项目会计核算问题研究
- 简析电子商务环境下的财务管理策略
- 我国企业绿色会计信息披露问题的研究
- 行政事业单位财务管理存在的问题及对策研究
- 基于现金流量的房地产行业财务风险预警研究
- 我国个人所得税的现状及改进
- 传媒行业营改增的新思考
- “互联网+”环境下永泰李干的渠道建设思考
- 直播营销用户体验策略研究
- 文化冲突视角下酒店跨文化管理研究
- 财务风险下中小企业成本精细化管理策略
- overlinger
- overlingered
- overlingering
- overlingers
- overlip
- overlisten
- over-literal
- overliteral
- overliterarily
- overliterariness
- overliterarinesses
- overliterary
- overliveliness
- overlivelinesses
- overlively
- overload
- overloaded
- overloading
- overloads
- overloath
- overlocker
- overloftily
- overloftiness
- overloftinesses
- overlofty
- 泛泛其谈
- 泛泛其辞
- 泛泛地讲空话
- 泛泛而粗略地看
- 泛泛而谈
- 泛浩摩苍
- 泛浮
- 泛海
- 泛浸
- 泛涌
- 泛涨
- 泛淘淘
- 泛淫
- 泛渭赋并序
- 泛游
- 泛溢
- 泛滥
- 泛滥成灾
- 泛滥淹没
- 泛滥的样子
- 泛滥的洪水
- 泛然
- 泛爱
- 泛爱一切人与物
- 泛珠三角