CRISPR/Cas9技术在农作物中应用的局限及改进
武林琳 竹梦婕 王咪 李晓萍 刘跃鹏 裴蕾 杨淑巧 许琦 王华 郭文治
摘要 ? ?基因编辑技术是一种可以直接对DNA序列进行稳定、精准改造的技术,其中CRISPR/Cas9技术以简便、高效、经济等优势脱颖而出。CRISPR/Cas9技术被广泛应用于作物遗传育种、植物基因改造和农作物品种改良等多个方面,给农作物领域带来巨大机遇。但机遇与挑战并存,该技术在实际应用中亦遇到一些困难。因此,本文围绕CRISPR/Cas9技术的原理、局限及改进方案进行综合阐述,以期为CRISPR/Cas9技术在农作物中的进一步应用提供理论基础。
关键词 ? ?基因编辑;CRISPR/Cas9;农作物;局限;脱靶效应;改进手段
中图分类号 ? ?Q943.2 ? ? ? ?文献标识码 ? ?A
文章编号 ? 1007-5739(2020)22-0026-04 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?开放科学(资源服务)标识码(OSID)
Abstract ? ?Gene editing technology is a technology that can directly modify the DNA sequence stably and accurately, in which CRISPR/Cas9 technology stands out for the advantages of simplicity, high efficiency and economy. CRISPR/Cas9 technology is widely used in crop genetic breeding, plant genetic modification, crop variety improvement and other aspects, bringing great opportunities to the field of crops. However, there are both opportunities and challenges, and the technology also encounters some difficulties in practical application. Therefore, this paper comprehensively expounded the principle, limitation and improvement scheme of CRISPR/Cas9 technology, in order to provide theoretical basis for the further application of CRISPR/Cas9 technology in crops.
Keywords ? ?gene editing; CRISPR/Cas9; crop; limitation; off-target effect; improvement mean
随着世界人口的增加,到2050年为全球超过90亿的预期人口提供食物是21世纪的主要挑战之一。Henry等[1]研究结果表明,在耕地扩张不超过地球边界的情况下,至2050年向全球人口提供充足的食物是可能的,但需要对粮食系统的需求方进行重大改变或推进生物技术。因此,基因编辑技术应运而生。
基因编辑是一种在基因组水平上对DNA序列进行精确敲除、插入和替换,从而实现基因组序列稳定改善的技术[2]。基因编辑技术的原理是利用人工内切核酸酶(SSNs)在目标基因组位置产生DNA双链断裂(double-strand breaks,DSBs),激活细胞的DNA修复系统,在修复过程中改变DNA序列[2]。DSBs可以通过非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous-directed recombination,HDR)进行修复。NHEJ是DNA断裂后最常见的修复方式,仅能造成DNA序列的随机改变,而HDR则能够引入一个与DSBs同源的外源DNA作为修复模板,使基因组DNA产生精确的序列改变。
目前,在农作物中应用的基因编辑技术主要有3种,即锌指核酸酶(Zinc-finger nucleases,ZFNs)[3]、转录激活因子样效应物核酸酶(Transcription activator-like effector nucleases,TALENs)[4]和成簇规律间隔的短回文重复序列及其相关系统(Clustered regularly interspaced short palindromic repeats/CRISPR-associated 9,CRISPR/Cas9)技術,其中以CRISPR/Cas9最为常用。CRISPR/Cas9技术已被用于作物遗传育种、植物基因改造、农作物品种改良等多个方面。
1 ? ?CRISPR/Cas9基因编辑技术
能够识别并特异性切割DNA序列的核酸酶是各种基因编辑技术的特色所在,CRISPR/Cas9技术中的核酸酶为Cas9,通过识别前间区序列邻近基序(protospacer adjacent motif,PAM)进行DNA双链切割[5]。
CRISPR广泛存在于古细菌和细菌中,是细菌进行自我防御的重要机制。当噬菌体侵入细菌后,细菌会将病毒DNA短片段整合到自己的染色体上,之后将该序列转录为短RNA,称为crRNA(CRISPR RNA),然后与另一个称为tracrRNA(反式激活CRISPR RNA)的RNA形成复合体。这种复合物被称为“引导RNA(gRNA)”,引导核酸内切酶Cas9至病毒DNA部位定点切割,产生DSBs。当gRNA通过识别PAM序列在噬菌体DNA中找到其匹配序列时,Cas9核酸酶就会裂解病毒DNA,从而抵抗病毒攻击[6]。
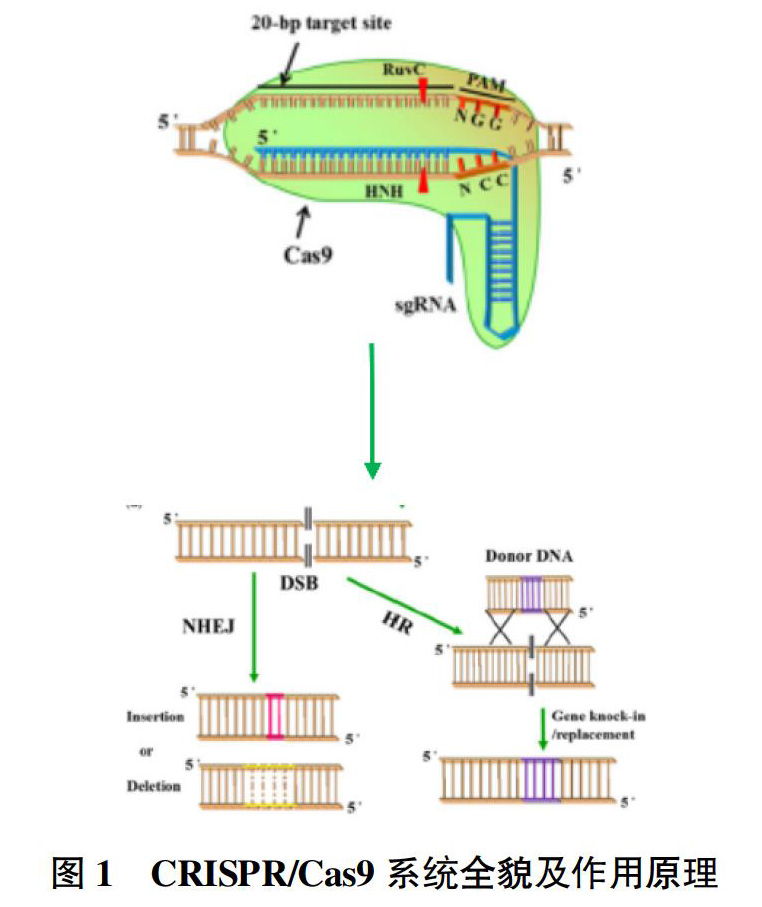
CRISPR/Cas9技术来源于上述细菌获得性免疫产生机制,该系统主要包括Cas9核酸内切酶和单链引导RNA(single guide RNA,sgRNA)。CRISPR/Cas9在sgRNA与Cas9蛋白的特定位点相结合后进入激活状态;sgRNA识别具有PAM序列的DNA序列,通过前20个核苷酸与目标DNA碱基配对;然后引导Cas9核酸酶至靶切割位点切割DNA,产生DSBs;最后通过NHEJ和HDR进行细胞修复[7](图1)。
由上可知,CRISPR/Cas9技术只需改变sgRNA的前20个核苷酸序列就可对基因组的不同位点实现靶向编辑,理论上能够识别任何含PAM序列的DNA片段。其因具有方便、精准、高效、经济等特点,在农作物改良中被迅速推广。
2 ? ?CRISPR/Cas9基因编辑技术的局限性
CRISPR/Cas9已被成功用于编辑超过25种植物和100个基因,创造出符合人们要求的主要作物的理想性状[8-9]。但CRISPR/Cas9技术仍有局限性,如该技术实现基因编辑有赖于PAM序列,在附近无PAM序列的区域无法进行编辑;由于CRISPR/Cas9技术会出现sgRNA与DNA间的错配,基因组中与靶位点序列相似的序列也会被CRISPR/Cas9识别并切断,出现脱靶。
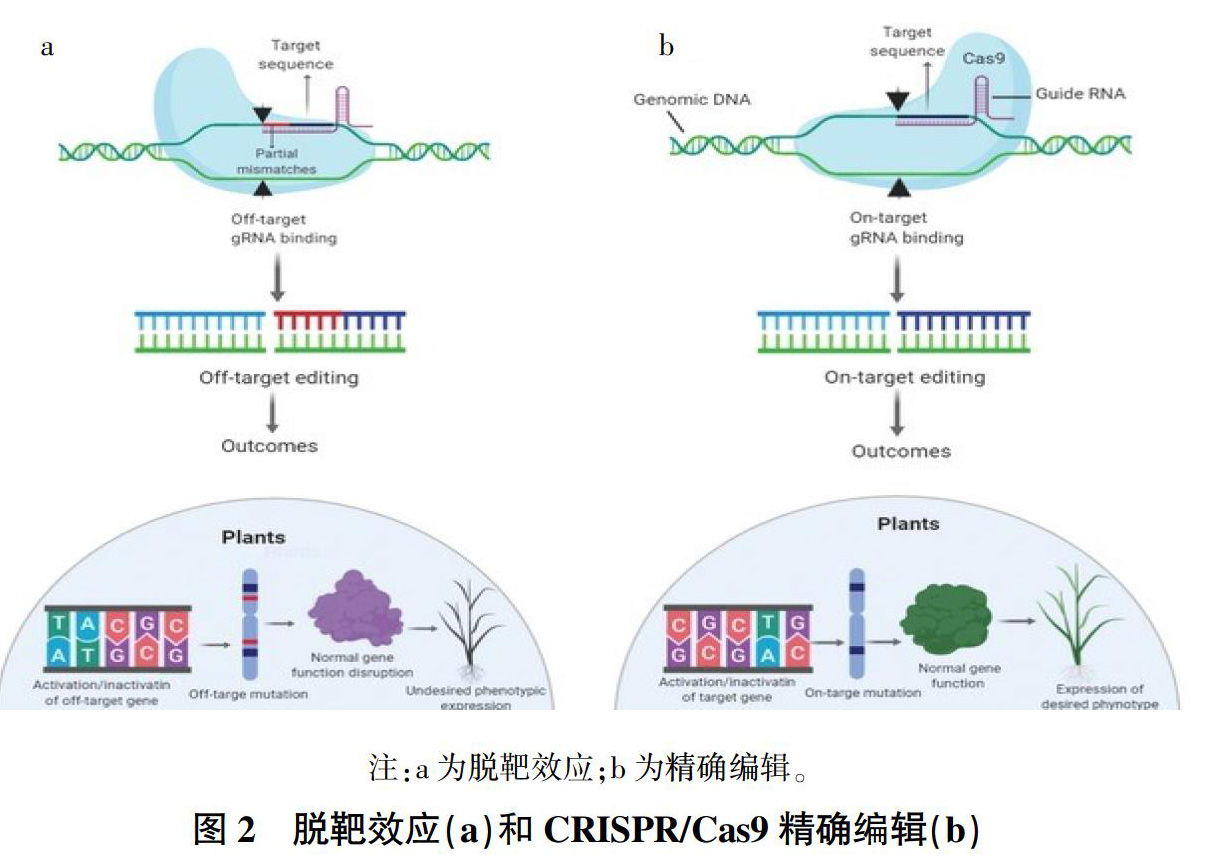
Cas9复合体与非靶标区域结合并启动切割,称为脱靶效应[10]。与ZFNs和TALENs相比,CRISPR/Cas9系统更易發生脱靶效应。原因在于Cas9的靶向准确度主要由基因组目标序列附近的20 nt sgRNA和PAM位点决定,单链的sgRNA更易产生识别DNA序列的错配,导致脱靶[11]。
脱靶可能导致染色体重排,造成不完全匹配的基因组位点的破坏[12]。另外,除干扰染色体稳定性外,脱靶效应还可能导致功能基因活性的丧失,从而导致各种信号异常[13](图2)。潜在的脱靶效应是CRISPR/Cas9在作物应用中备受关注的问题[14],它限制了该技术在作物育种及作物改良中的进一步扩展应用[15]。
3 ? ?对CRISPR/Cas9技术局限性的改进手段
鉴于CRISPR/Cas9技术的强大优势,科研工作者采取多种策略降低CRISPR/Cas9的脱靶效应。CRISPR/Cas9系统由Cas9核酸内切酶和sgRNA两部分组成,对降低脱靶效应策略的研究大都集中在两方面。
3.1 ? ?设计最优sgRNA
设计最优sgRNA,有利于消除基因编辑致命的脱靶现象。为此,首先需要选择该目标基因型的高质量基因组作参考基因组[16];其次,选择CRISPR-P 2.0[17]、E-CRISP[18]、Breaking-Cas[19]、CasFinder[20]来设计最优的sgRNA序列以最小化脱靶机会。
3.2 ? ?改进CRISPR/Cas9系统
3.2.1 ? ?CBES和ABES(Cytosine and Adenine Base Edi-tors,BEs,胞嘧啶和腺嘌呤碱基编辑器)。BEs是由催化结构域和DNA靶向模块组成的嵌合蛋白,具有脱氨腺嘌呤或胞苷的能力。通过靶向sgRNA,将具有脱氨酶结构域的蛋白酶引导至靶标位置,进行切割,同时可将目标部位配对碱基中的C精确转化为T或将A转化为G[21-23]。该过程不产生DSBs,大大减小了靶点位置上随机插入、缺失产生的脱靶效应。
3.2.2 ? ?xCas9和Cas9-NG。xCas9和Cas9-NG是SpCas9的变异体,在提高靶点特异性和扩大靶点范围方面显示出巨大的潜力。xCas9-3.7是一个高效的xCas9变体,可针对多达16个候选NGN PAM组合(如NGG、NG、GAA和GAT)进行有针对性地编辑。xCas9已被证明具有最广泛的PAM识别能力,与SpCas9相比,xCas9表现出更高的DNA特异性,在全基因组范围内所有NGG PAM的脱靶效应明显降低[24]。xCas9具有靶向标准NGG PAM的能力,而Cas9-NG是植物基因编辑中识别非标准PAM的首选酶[25]。
3.2.3 ? ?Cas9n(Cas9 Nickase) and dCas9(Dead Cas9)。成对的Cas9n是Cas9的一个突变体,其中Cas9的HNH或RuvC结构域通过引入H840A或D10A改变而失活。成对的Cas9n由2个针对相邻位点的sgRNA引导至靶标位点进行切割、插入[26]。Cas9n也被用作高频碱基编辑的靶向模块[27]。dCas9工作模式与Cas9n非常相似。由于碱基编辑不产生DSBs,Cas9n和dCas9都被用来通过靶向脱氨酶结构域来编辑特定的碱基。
3.2.4 ? ?Tru-gRNAs(Shorter/Truncated Guide RNAs for On-Target Site)。研究表明,gRNA由最初20 bp缩短至17~18 bp,基因编辑效率并未改变,而脱靶位修饰减少[26]。在植物中,在使用组成型启动子的CRISPR/Cas9系统中使用截短的sgRNA会导致靶上编辑率增高,脱靶效应大大降低[27]。此外,将Tru-gRNAs与Cas9n相结合,进一步减少了脱靶突变[26]。
3.2.5 ? ?Cas9高保真突变体。①SpCas9-HF1(High-Fidelity Engineered Variants of SpCas9)。SpCas9-HF1是一种高保真的变体,旨在减少非特异性DNA相互作用。由于其非凡的准确性,可成为临床治疗的替代品[28]。②eSpCas9(Enhanced Specificity of SpCas9)。eSpCas9减少了脱靶效应并保持了有效的靶位编辑。对于需要高特异性的基因编辑工具(例如临床医学),eSpCas9非常实用。可通过合理设计生成的eSpCas9(K848A,K1003A,R1060A)减少与非目标序列的结合,提高基因编辑的特异性[29]。③HypaCas9(Hyper-Accurate Cas9 Variant)。HypaCas9系统能够在不影响人类细胞目标基因组编辑的情况下实现更高的全基因组保真度。这个系统提供了一种平衡核酸酶激活和目标识别之间关系的改进方法,以实现精确的基因编辑[30]。
4 ? ?總结与展望
CRISPR/Cas9技术的出现为植物基因操作领域带来了新的机遇。作为用于定点诱变的基因组编辑工具,CRISPR/Cas9满足了人们的所有期待:高效率、高特异性、价格低廉、操作方便,这些是传统诱变方法无法企及的。由于人们对CRISPR/Cas9系统了解相对较深,其构建方法已逐渐得到改善,同时研究者们正在尝试将脱靶效应降至最低。所有这些优点使研究者迫切将其用于植物基因组学研究和作物改良,特别是在与产量、品质以及非生物和生物胁迫耐受性/抗性相关的特征方面。目前,脱靶效应仍是CRISPR/Cas9系统进一步广泛应用的阻碍,还需要更多的研究来进一步提高靶标的特异性,以避免或减轻脱靶效应。
5 ? ?参考文献
[1] HENRY R C,ENGSTR?魻M K,OLIN S,et al.Food supply and bioenergy production within the global cropland planetary boundary[J].PLoS One,2018,13(3):194695.
[2] HSU P D,LANDER E S,ZHANG F.Development and appli-cations of CRISPR/Cas9 for genome engineering[J].Cell,2014,157(6):1262-1278.
[3] MILLER J C,HOLMES M C,WANG J,et al.An improved zinc-finger nuelease architecture for highly specific genome editing[J].Nat Biotechnol,2007,25(7):778-785.
[4] CHRISTIAN M,CEMAK T,DOYLE E L,et al.Targeting DNA double-strand breaks with TAL effector nucleases[J].Genetics,2010,186(2):757-761.
[5] KNOTT G J,DOUDNA J A.CRISPR-Cas guides the future of genetic engineering[J].Science,2018,361(6405):866-869.
[6] WIEDENHEFT B,STERNBERG S H,DOUDNA J A.RNA-guided genetic silencing systems in bacteria and archaea[J].Nature,2012,482(7385):331-338.
[7] BAO A,BURRITT D J,CHEN H,et al.The CRISPR/Cas9 system and its applications in crop genome editing[J].Crit Rev Biotechnol,2019,39(3):321-336.
[8] ZHOU X,JACOBS T B,XUE L J,et al.Exploiting SNPs for biallelic CRISPR mutations in the outcrossing woody perennial Populus reveals 4-coumarate:CoA ligase specificity and redundancy[J].New Phytol,2015,208(2):298-301.
[9] MALZAHN A,LOWDER L,QI Y.Plant genome editing with TALEN and CRISPR[J].Cell Biosci,2017,7:21.
[10] ALKAN F,WENZEL A,ANTHON C,et al.CRISPR-Cas9 off-targeting assessment with nucleic acid duplex energy parameters[J].Genome Biol,2018,19(1):177.
[11] TANG X,LIU G,ZHOU J,et al.A large-scale whole-genome sequencing analysis reveals highly specific genome editing by both Cas9 and Cpf1(Cas12a)nucleases in rice[J].Genome Biol.,2018,19(1):84.
[12] YIN J,LIU M,LIU Y,et al.Optimizing genome editing strategy by primer-extension-mediated sequencing[J].Cell Discov,2019,5:18.
[13] MANGHWAR H,LI B,DING X,et al.CRISPR/Cas systems in genome editing:methodologies and tools for sgRNA design,off-target evaluation,and strategies to mitigate off-target effects[J].Adv Sci(Weinh),2020,7(6):1902312.
[14] BORTESI L,FISCHER R.The CRISPR/Cas9 system for plant genome editing and beyond[J].Biotechnol Adv,2015,33(1):41-52.
[15] JOUNG J K.Unwanted mutations:standards needed for gene-editing errors[J].Nature,2015,523(7559):158.
[16] LESSARD S,FRANCIOLI L,ALFOLDI J,et al.Human genetic variation alters CRISPR-Cas9 on-and off-targeting specificity at therapeutically implicated loci[J].Proc Natl Acad Sci U S A,2017,114(52):11257-11266.
[17] LIU H,DING Y,ZHOU Y,et al.CRISPR-P 2.0:an improved CRISPR-Cas9 tool for genome editing in plants[J].Mol Plant,2017,10(3):530-532.
[18] HEIGWER F,KERR G,BOUTROS M.E-CRISP:fast CRISPR target site identification[J].Nat Methods,2014,11(2):122-123.
[19] OLIVEROS J C,FRANCH M,TABAS-MADRID D,et al.Breaking-Cas-interactive design of guide RNAs for CRISPR-Cas experiments for ENSEMBL genomes[J].Nucleic Acids Res,2016,44(W1):W267-W271.
[20] N?魪RON B,M?魪NAGER H,TOUCHON M,et al.MacSyFind-er:a program to mine genomes for molecular systems with an application to CRISPR-Cas systems[J].PLoS One,2014,9(10):110726.
[21] KOMOR A C,KIM Y B,PACKER M S,et al.Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage[J].Nature,2016,533(7603):420-424.
[22] LI X,WANG Y,LIU Y,et al.Base editing with a Cpf1-cytidine deaminase fusion[J].Nat Biotechnol,2018,36(4):324-327.
[23] GAUDELLI N M,KOMOR A C,REES H A,et al.Program-mable base editing of A·T to G·C in genomic DNA without DNA cleavage[J].Nature,2017,551(7681):464-471.
[24] HU J H,MILLER S M,GEURTS M H,et al.Evolved Cas9 variants with broad PAM compatibility and high DNA specificity[J].Nature,2018,556(7699):57-63.
[25] ZHONG Z,SRETENOVIC S,REN Q,et al.Improving plant genome editing with high-fidelity xCas9 and non-canonical PAM-targeting Cas9-NG[J].Mol Plant,2019,12(7):1027-1036.
[26] RAN FA,HSU PD,LIN CY,et al.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J].Cell,2013,154(6):1380-1389.
[27] QI L S,LARSON M H,GILBERT L A,et al.Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression[J].Cell,2013,152(5):1173-1183.
[28] KLEINSTIVER B P,PATTANAYAK V,PREW M S,et al.High-fidelity CRISPR-Cas9 nucleases with no detectable genome-wide off-target effects[J].Nature,2016,529(7587):490-495.
[29] SLAYMAKER I M,GAO L,ZETSCHE B,et al.Rationally engineered Cas9 nucleases with improved specificity[J].Science,2016,351(6268):84-88.
[30] CHEN J S,DAGDAS Y S,KLEINSTIVER B P,et al.Enhanced proofreading governs CRISPR-Cas9 targeting accuracy[J].Nature,2017,550(7676):407-410.

