室内工厂化培育凡纳滨对虾生态式无特定病原(SPF)苗种的探究
彭张明 蒲桂川

摘要:为探究凡纳滨对虾(Litopenaeus vannamei)室内工厂化培育生态式无特定病原苗种的育苗方法,在室内育苗池开展不同工厂化育苗模式,对育苗过程水質、细菌和虾苗进行跟踪与检验,结果显示:传统方形池和U型池的三种育苗充气模式(气管+气石+铅粒的吊管模式、纳米管模式和PVC底管模式)的水质和细菌均未出现超标,PL5阶段虾苗抗应激成活率达95%以上,PL10阶段虾苗抗应激成活率达85%以上;U型池平均育苗成活率77.03%,相比方形池的63.96%差异显著(P<0.05);U型池虾苗体长日增长率0.06 cm/d,较方形池的0.05 cm/d差异不显著(P>0.05);方形池纳米管模式PL10阶段虾苗体长变异系数达到15.8,相比其余组差异显著(P<0.05)。结果表明:不同工厂化育苗模式均可培育出生态化无特定病原苗种,方形池的纳米管模式对PL10阶段的虾苗体长变异系数有显著影响,可能不适用于高密度大规格虾苗的养殖;U型池在育苗成活率、虾苗生长速度及虾苗均匀度上优于传统方形池。
关键词:凡纳滨对虾(Litopenaeus vannamei);室内;工厂化育苗模式;生态式SPF苗种
开展凡纳滨对虾(Litopenaeus vannamei)室内不同工厂化育苗模式的探究,以期为培育生态式SPF虾苗提供实践数据和技术参考。
1材料与方法
1.1试验材料
1.1.1SPF无节幼体运用荧光定量PCR(qPCR)对生产无节幼体的进口亲虾进行虾肝肠胞虫(EHP)、虾白斑综合征病毒(WSSV)、虾桃拉病毒(TSV)、传染性皮下和造血坏死病毒(IHHNV)、传染性肌坏死病毒(IMNV)、坏死性肝胰腺炎细菌(NHPB)、急性肝胰腺坏死病细菌(AHPND)、哈维氏弧菌(Vh)和虾血细胞虹彩病毒(SHIV)等虾类无特定病原的检测,确保无节幼体是SPF的。
1.1.2试验条件与设施育苗试验在湛江海壹水产种苗有限公司徐闻县龙塘综合基地的室内育苗车间进行。养殖水源为经消毒沉淀、沙滤、陶氏超滤及蛋白分离器等处理后的海水,其氨氮和亚硝酸盐含量低于0.01 mg/L。
方形育苗池长宽高为3.3 m×3.3 m×1.3 m,共计9个,U型育苗池的体积为10 m3,共计9个,总计18个育苗池。
饵料及添加剂:主要包括微藻类(公司生物饵料培育中心培育的角毛藻、海链藻)、卤虫(公司生物饵料培育中心孵化的卤虫无节幼体)、江口罐装早期虾片、英伟微囊料、八卦桶装虾片、维他命C(博尚VC)、绿百多丰虾素(光合菌)和EM菌培养基(广州精博)等。
1.2试验方法
1.2.1育苗试验准备工作2019年5月28日对车间育苗池清洗消毒,用10 L淡水+有效浓度10%的碘液50 mL+洗洁精2~5 mL制成的混合溶液彻底刷洗内外壁两遍,淡水冲干净后通风晾晒2~3 d;对育苗工具、气管、铅粒、气石、纳米管、PVC底管进行彻底清洗消毒晾晒后,安装在育苗池中;投幼体前一天准备好盐度为32‰,经公司水处理流程过滤后的海水入室内蓄水池中,调整海水总碱度140~160,pH值8.0~8.4,投入10 g/m3 EDTA-2Na,充分打均匀后,停气沉淀24 h,海水温度30 ℃。
1.2.2转水及幼体投放2019年6月3日从蓄水池中过棉花棒转水到18个育苗池中,水位70 cm(水体7 m3),检测余氯为0,投放幼体前30 min投入1~1.5 g/m3的维他命C到各育苗池中。无节幼体是来自同一批次亲虾所生产,总量3 600万尾,投放密度为200万尾/池(20万尾/m2),同时,取放幼体前的水样涂弧菌板检测得到黄弧菌、绿弧菌数量为0。
1.2.3试验设计9个方形育苗池分成三组,育苗充气模式分别是:气石+铅粒的吊管模式、纳米管模式和PVC底管模式,每组3个平行;9个U形育苗池分成三组,育苗充气模式分别是:气石+铅粒的吊管模式、纳米管模式和PVC底管模式,每组3个平行;各组日常管理和操作保持一致。
1.2.4SPF饵料制备与投喂生物饵料的制备,包括微藻类和丰年虫的培养,要通过检测确保投喂的饵料是无特定病原携带(SPF),人工饵料的投喂,包括虾片、微生态制剂及其他辅料等,每个产品也必须通过无特定病原(SPF)的检测。
1.2.5日常育苗关键点把控a.育苗温度范围,全程30~32 ℃;b.育苗车间的光照和通风,避免阳光直射,苗池正上方2~3 m处用遮阳布挡光,打开车间门窗,自然通风;c.苗池人为藻相构建:无节幼体发育到N5~N6时,开始向苗池投喂角毛藻、海链藻,维持水体中藻类密度5万~8万cell/mL,一直持续到虾苗完全变糠虾Ⅰ期(M1),保持苗池的藻类不老化;d.苗池自然菌相形成:每日向苗池水体中投喂一定量的光合细菌,以供虾苗摄食菌体及净化水质,每日投喂一定量的EM菌培养基,为苗池的细菌增殖提供必要的营养物质,以配合藻类和人工饵料中的有益细菌繁殖,形成天然的菌相,达到苗池的总菌平衡;e.饵料投喂:虾苗蚤Ⅰ阶段(Z1)投喂早期微囊料和前期罐装虾片,投喂量为1 g/m3,4次/d,虾苗蚤Ⅱ(Z2)至蚤Ⅲ阶段(Z3),投喂量增加到1.2~1.5 g/m3,6次/d,使用冻死或烫死的丰年虫无节幼体投喂100~150 g/百万尾,4次/d,并且要依据虾苗摄食、拖便情况进行调整;虾苗糠Ⅰ(M1)至糠Ⅲ阶段(M3)投喂中期微囊料和中期桶装虾片,投喂量15~25 g/百万尾,6次/d,使用冻死或烫死的丰年虫无节幼体投喂200~300 g/百万尾,4次/d,并且要依据虾苗摄食、粪便情况进行调整;虾苗到仔虾阶段投喂中后期桶装虾片,投喂量40~60 g/百万尾,6次/d,使用活的丰年虫无节幼体投喂250~300 g/百万尾,4次/d,并且要依据虾苗摄食、粪便情况进行调整;f. 加换水:蚤Ⅲ(Z3)至糠Ⅲ阶段(M3)每日按海水与淡水1∶1比例加水6~10 cm,仔虾后每日换水15%~30%,每日加水前向苗池投入1.2~1.5 g/m3的维他命C,加水后向苗池投入10 g/m3的小苏打;g. 溶氧量:保持水体溶氧量6 mg/L以上,N2~N6阶段充气呈微波状态,Z1~Z3阶段微沸腾状态,M1~M3阶段沸腾状态,仔虾后强沸腾状态。
1.2.6育苗过程水质与细菌跟踪在虾苗的M3阶段和PL3阶段取苗池海水进行水质和细菌测定,水质包括pH值、氨氮和亚硝氮含量,pH值用玻璃电极法检测,铵态氮和亚硝酸盐含量采用分光光度计法测定。
细菌测定包括水体弧菌和虾体弧菌含量,取水样稀释进行tcbs平板涂布,取PL3和PL7阶段的虾苗10~20尾用75%酒精消毒虾体表面,接着喷蒸馏水清洗酒精,与1 mL蒸馏水充分混合研磨,取100 μL样本加至tcbs平板均匀涂布,在31 ℃恒温箱中培养16~18 h后,观察平板中菌落生长情况。
1.2.7虾苗抗应激能力检测取100尾PL5阶段的虾苗置于15‰的海水中1 h,清点虾苗的死亡数量,计算PL5虾苗抗应激成活率=(100-死亡数量)/100×100%;取100尾PL10阶段的虾苗置于淡水中30 min,然后捞取所有虾苗到30‰海水中30 min,清点虾苗的死亡数量,计算PL10虾苗抗应激成活率=(100-死亡数量)/100×100%。
1.2.8无特定病原携带(SPF)检测取各育苗池PL3和PL8阶段的虾苗按照1.1.1中的方法进行检测。
1.2.9虾苗数据测量
育苗成活率测定方法:在试验结束时,分别将每组苗池的虾苗收集,称取质量(W1,精确至0001 g),再从其中随机取100 尾虾苗,称取其质量(W2),计算每个育苗池内虾苗存活总数。虾苗全长测定:测量自对虾的额剑尖端至对虾尾节的末端的长度,要将对虾尽量伸直,然后测量,在PL5、PL10阶段分别随机取各组50尾虾苗进行全长测量。
相关计算公式如下:
育苗成活率SR(%)=[(W1/W2)/100]/N×100%? (1)
生长速率LGR(cm/d)=(L1-L0)/(t1-t0)???????? (2)
虾苗体型差异(测量出全部虾苗体长数据的变异系数,CV)=标准差/平均值×100%? (3)
式(1)~(3)中,L0和L1为前一次取样的虾苗全长和后一次取样时的全长,t0和t1分别为前一次采样时间和后一次采样时的时间,N为每个池的幼体投放数量。
1.2.10数据分析采用SPSS 19.0分析软件对实验数据进行单因素方差分析(ANOVA),并使用Duncan法进行多重比较,检验处理间的差异显著性水平设为0.05;实验数据采用平均值±标准差表示。
2结果与分析
2.1室内不同工厂化育苗模式的水质和细菌情况
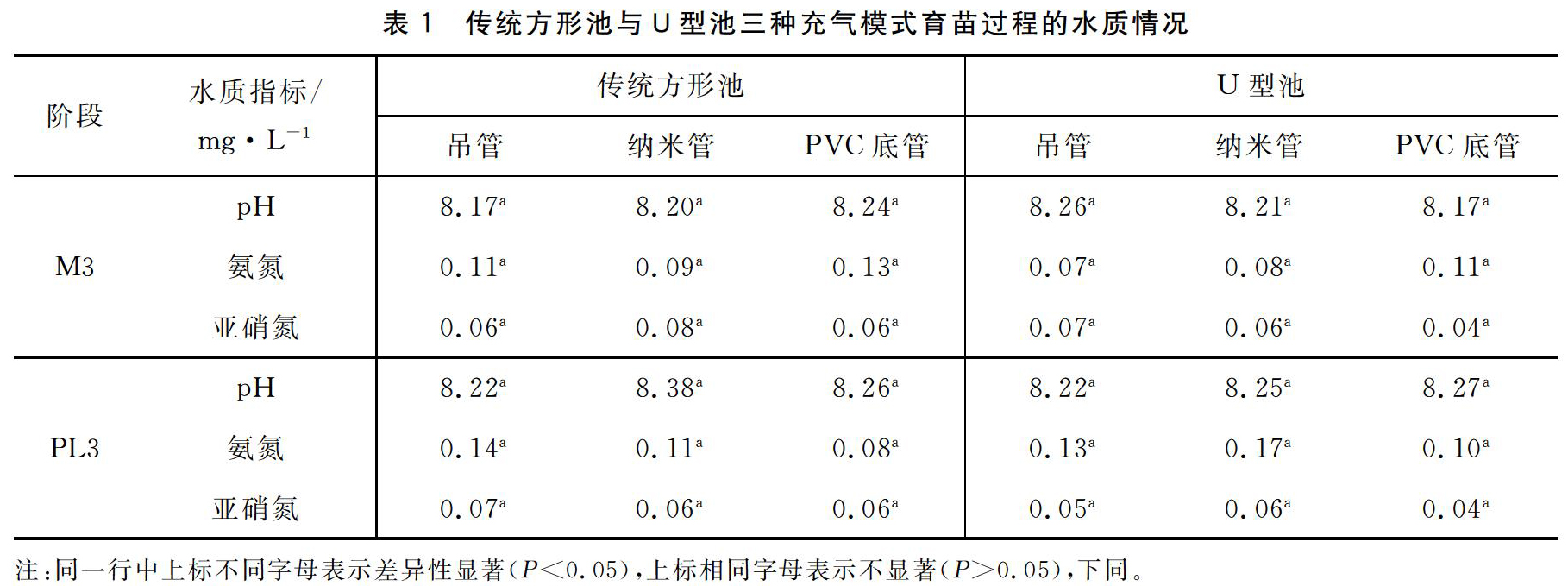
2.1.1传统方形池与U型池三种充气模式育苗过程的水质情况从表1可知,传统方形池与U型池的三种充气育苗模式在育苗过程的水质情况都趋于稳定,没有显著差异(P>0.05),PL3阶段pH的稳定得益于每天的换水量,大大降低了水中的有机质,以及NaHCO3的投入,其是酸碱缓冲剂,能有效提高水中的总碱度,维持pH值的稳定;育苗M3和PL3阶段氨氮、亚硝氮含量总体趋于平稳,没有异常波动和超标(育苗用水标准:氨氮<0.4 mg/L,亚硝氮<0.1 mg/L),主要的原因可能是水处理后的水质洁净度、换水量的保证、饵料投喂量的精准把控以及苗池菌相的稳定等方面,与充气模式关联不大。综上可得,三种育苗充气模式在方形池和U型池中对水质的影响没有显著差异,可用于凡纳滨对虾工厂化生态式苗种的培育。
2.1.2传统方形池与U型池三种充气模式育苗过程的细菌情况从表2可知,传统方形池与U型池的三种充气育苗模式在各阶段对水体、虾体细菌的含量没有显著影响(P>0.05),各苗池都没有出现弧菌超标的现象(育苗养殖水弧菌参考:黄弧菌≤10 000,绿弧菌≤1000,荧光菌=0,单位是cfu/mL;虾苗弧菌参考:黄弧菌≤200,绿弧菌≤10,荧光菌=0,单位是cfu/尾),首先是得益于苗池人为藻相的构建,每日投喂的藻类细胞不老化,并维持密度5万~8万cell/mL持续到虾苗完全变糠虾Ⅰ期(M1),有效抑制了水体中有害弧菌的生长,其次是定向投入了EM菌培养基,促使苗池的菌相得以自然天成,有效维持了益生菌相的生态平衡,减少了有害弧菌的繁殖,最后是育苗用水的安全和洁净,通过加换水,大大降低了有害弧菌的带入风险。因此,三种充气模式对育苗过程的细菌基本没有影响。
2.2室内不同工廠化育苗模式的虾苗表现情况
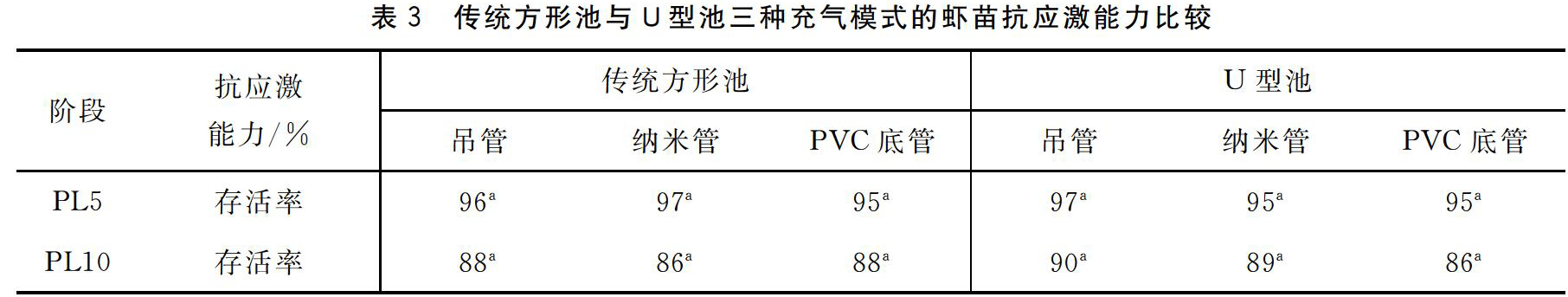
2.2.1传统方形池与U型池三种充气模式的虾苗抗应激能力比较由表3可知,传统方形池与U型池的三种充气育苗模式对PL5和PL10阶段虾苗的抗应激能力没有显著影响(P>0.05),各育苗池的虾苗都通过了应激检验标准(PL5阶段虾苗存活率>90%,PL10阶段虾苗存活率>85%),适合养殖。
2.2.2传统方形池与U型池三种充气模式的虾苗性状指标比较由表4可知,三种充气模式在传统方形池和U型池中对虾苗的育苗成活率(SR)、生长速率(LGR)及PL5阶段虾苗体长变异系数(CV)的影响不显著(P>0.05),但方形池的纳米管充气模式在PL10阶段虾苗CV较其余组出现显著差异(P<0.05),推断是在方形池纳米管对水体的气动模式不适宜高密度养殖大规格虾苗。U型池的三种充气模式虾苗SR(平均7703%)相比传统方形池(平均63.96%)具显著差异(P<0.05),而且U型池虾苗LGR略高,但差异不显著(P>0.05),可能与U型池的形状、特殊的构造有关系。
3讨论
3.1室内不同工厂化育苗模式的水质和细菌情况
国内外学者对凡纳滨对虾的室内、室外水泥池育苗试验,工厂化育苗,生态育苗及仿生态育苗等方面进行了大量的研究,并取得了许多宝贵的成果[4-7]。培育优质高产生态式SPF对虾苗种,除了优质的亲本种质、饵料营养等因素,还与育苗环境因素密不可分,包括水体微生物群落的生态调控作用、养殖水体的理化指标稳定、育苗模式的优选等等,除此之外,对虾苗的SPF检测已经成为行业评判苗种质量好坏最基本的标准。本次试验通过室内不同工厂化育苗充气模式的探究,运用生态式育苗理念,在育苗池中构建了人为藻相,利用定向投入EM菌培养基,促使菌相自然天成,试验得到不同的充气模式对育苗的水质和细菌没有影响,未出现超标的现象,通过对虾苗抽样进行SPF检测,结果显示所有苗池都是阴性。关于凡纳滨对虾室内工厂化育苗过程的水质变化、细菌生物量、菌群结构等已大量报道[8-11],但不同充气模式的育苗水质、细菌的跟踪与探究尚未见报道。
3.2室内不同工厂化育苗模式的虾苗表现情况
凡纳滨对虾工厂化育苗的供气一般采用罗茨鼓风机,常用的充气方式有吊管、纳米管和PVC底管,一般情况下,不同技术员采用不同的充气方式育苗,主要与其长久从事育苗的习惯性操作手法相关,总的而言,对虾育苗没有固定的充气方式。本次试验首次探究了凡纳滨对虾室内工厂化育苗的三种充气模式对虾苗性状的影响,同时也对比了传统方形池与U型池的育苗效果,结果得到:传统方形池和U型池的三种育苗充气模式对虾苗抗应激能力没有影响;方形池的三種充气模式中仅纳米管模式会对PL10阶段的虾苗体长变异系数产生显著影响,而U型池的三种充气模式没有影响;U型池虾苗成活率显著高于传统方形池,且虾苗生长速度也优于传统方形池。分析上述结果的原因可能有:一是虾苗的抗应激能力与其自身生长发育速度及虾体抗应激机制的完善程度有关联,而充气模式的改变并未影响虾苗的变态发育;二是方形池中的纳米管模式会从池底翻滚水体,但水体滚动的力量有一定的局限性,方形池边缘处可能会存在滚动的死角,而健壮的虾苗一般逆水而流,汇聚在纳米管的气头处,摄食充足,久而久之就导致了虾苗的大小分化,虾苗的体长变异系数变大,而在U型池中因其特殊的形状则不会存在类似现象;三是U型池较传统方形池而言,U型池的形状、构造具有其特殊的先天优势,例如充气无死角,水体滚动彻底、力度强,饵料不易下沉、存留在水中的时间长,虾苗随水流运动更频繁,与自然海域水流生活环境更类似等等,这些先天优势可以造就虾苗更高的存活率,育苗过程损耗更低,虾苗的生长速度更快。
4结论
不同工厂化育苗模式均可培育出生态化无特定病原苗种,三种充气模式对水质、细菌没有影响。
方形池的纳米管模式对PL10阶段的虾苗体长变异系数有显著影响,在工厂化高密度大规格虾苗的养殖中易出现大小分化。
U型池在育苗成活率、虾苗生长速度及虾苗均匀度上优于传统方形池。
参考文献:
[1] 张伟权.世界重要养殖品种——南美白对虾生物学简介[J].海洋科学,1990,14(3):69~73.
[2] 李大海.经济学视角下的中国海水养殖发展研究——实证研究与模型分析[D].中国海洋大学, 2007:43-46.
[3] 彭张明,黄明,樵江华,等.养殖密度和盐度对南美白对虾标粗过程生长性状的影响[J].水产科技情报,2019,46(03):154-159.
[4] 梁华芳.南美白对虾室外育苗的初步试验[J].水产科学,2003,22(2):27-29.
[5] 骆大鹏,何玉贵,杨明秋,等.凡纳滨对虾室内生态育苗技术[J].现代农业科技,2015(10):256-257.
[6] 王玉佩,肖培弘,孔玉敏,等.臭氧在南美白对虾工厂化育苗生产中的应用[J].渔业现代化, 2006(1):23-24.
[7] 林更铭,杨清良,许章程.对虾无公害生态育苗[J].海洋科学,2007,31(10):11-14.
[8] 黄明哲.南美白对虾育苗中若干水质变化的影响[J].渔业致富指南,2015(10):46-50.
[9] Yan M, Jian L, Bin W, et al. Study on the quantity dynamic changes of heterobacteria and vibrios in larvae industrialized culture system[J]. Agricultural Science and Technology, 2008, 36(18):7703-7126.
[10] 薛明,何瑶瑶,邱孟德,等.高通量测序分析凡纳滨对虾育苗期水体菌群结构特征[J].水产学报,2017,41(05):785-794.
[11] 苏国成,周常义.凡纳滨对虾育苗水环境的细菌学初探[J].集美大学学报(自然科学版),2007(04):289-293.
(收稿日期:2020-01-03)
基金项目:企业自选科技项目HNHY-2019-03。
作者简介:彭张明(1989-),男,硕士,从事南美白对虾育苗与养殖。E-mail:pzm731675208@126.com。
通信作者:蒲桂川(1992-),女,助理工程师,从事南美白对虾育苗与检测。E-mail:190617599@qq.com。DOI:10.3969/j.issn.1004-6755.2020.02.008

