使例析中考对酸、碱、盐的考查
吴海洋


酸、碱、盐知识作为初、高中化学最重要的衔接点之一,一直是中考考查的重点,因此,了解酸、碱、盐的考点,对中考取胜至关重要,本文以典型中考题为例,剖析酸、碱、盐这部分知识的常见考点,供同学们参考,
一、考查酸、碱、盐的概念
例1 (2019.绥化)下列物质的名称、俗称、化学式和分类对应完全正确的一组是( ).
A.氧化钙、熟石灰、Ca0、氧化物
B.氯化氢、盐酸、HCI、酸
C.氢氧化钠、火碱、NaOH、碱
D.碳酸氢钠、苏打、NaHC03、盐
解析:氧化钙俗称生石灰,化学式为Ca0,属于氧化物.盐酸是氯化氢气体的水溶液,属于酸,但氯化氢不是盐酸,盐酸的化学名称为氢氯酸.氢氧化钠俗称火碱、烧碱、苛性钠,化学式为NaOH,属于碱,碳酸氢钠俗称小苏打,化学式为NaHC03,苏打是碳酸钠的俗称,两者均属于盐.
答案:C.
二、考查酸、碱、盐的性质
例2(2019.衡阳)宏宏同学发现上个月做实验用的氢氧化钠溶液忘记盖瓶盖.对于该溶液是否变质,宏宏邀约了几个喜欢探究的同学对此进行了探究.请你一起完成下列实验报告.
(1)【提出问题1】
该溶液是否变质?
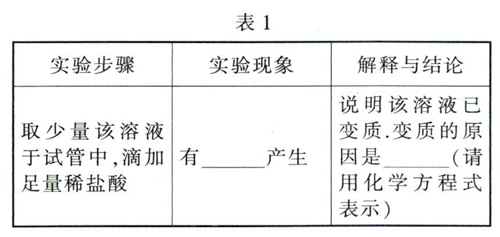
【实验探究1】(见表1)
(2)【提出问题2】
该溶液变质程度怎样?
【提出猜想】
猜想1:该溶液已完全变质,溶液中溶质只有Na2C03.猜想2:该溶液部分变质,该溶液中溶质含有一.
【查阅资料】
氯化钡溶液呈中性,
【实验探究2】(见表2)
(3)【提出问题3】
怎样提纯该样品从而得到纯净的氢氧化钠固体?
【实验探究3】
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图1所示的实验方案.
请回答下列问题:
①操作A和操作B中都需用到玻璃棒,其中操作A中玻璃棒的作用为 ____.
②根据实验流程可知,最终所得氢氧化钠固体的质量____(填“大于”“小于”或“等于”)变质后样品中氢氧化钠的质量.
(4)【反思交流】
在“实验探究2”中加入过量的氯化钡溶液的目的是.
解析:(1)由于氢氧化钠易与空气中的二氧化碳反應生成碳酸钠,所以判断氢氧化钠是否变质,可通过检验样品中是否含有碳酸根离子:取少量该溶液于试管中,滴加足量稀盐酸,若有气泡产生,则说明氢氧化钠溶液变质了.(2)若氢氧化钠溶液全部变质,则溶液中只有碳酸钠;若部分变质,溶液中是碳酸钠和氢氧化钠的混合物.要探究氢氧化钠溶液的变质程度,设计实验时要考虑碳酸钠的水溶液显碱性:先取少量该溶液于试管中,加入过量氯化钡溶液(其目的是确保将碳酸钠完全除去),有白色沉淀生成,静置,取上层清液于另一支试管中,加入2-3滴酚酞溶液,上层清液变红,说明猜想2成立.(3)要得到纯净的氢氧化钠固体,需先用适量的澄清石灰水将碳酸钠除掉,然后通过过滤、蒸发得到纯净的氢氧化钠,在这两个操作中均会用到玻璃棒:操作A是过滤,玻璃棒的作用为引流;操作B是蒸发,玻璃棒的作用是搅拌,使各部分均匀受热,防止液滴飞溅,由于在提纯氢氧化钠的过程中加入了澄清石灰水,澄清石灰水会和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以最终所得氢氧化钠固体的质量大于变质后样品中氢氧化钠的质量,
答案:(1)气泡 C02+2NaOH=Na2C03+H20 (2)NaOH、Na2C03 白色沉淀 2(3)①引流 ②大于 (4)将碳酸钠完全除去
三、考查复分解反应
例3下列各组离子在水溶液中能大量共存的是( ).
A.Cu2+、Mg2+、N03、OH-
B.H+、SO2-、CO;-、Ba2+
C.K+、N03、Cl-、Na+
D.H+、N03、Ca2+、OH-
解析:这类题目实际上是考查溶液中的物质不能发生复分解反应,即离子不会相互结合生成水、气体或沉淀.A选项中,铜离子和镁离子都不能与氢氧根离子共存,则A错误.B选项中,氢离子和碳酸根离子不能共存,碳酸根离子和硫酸根离子都不能与钡离子共存,则B错误.D选项中,氢离子和氢氧根离子不能共存,则D错误,
答案:C.
四、考查酸、碱、盐的实际应用
例4 (2019.绥化)酸、碱、盐在我们的生产、生活中有广泛的应用.
(1)氢氧化钠溶液与稀硫酸反应时,溶液pH的变化如图2所示.
①根据图示可知该实验是将____ 滴人_____中.
②当滴入溶液的体积为V2 mL时,溶液中的溶质为_____(填化学式).
(2)测定某酸溶液的pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH_(填“偏大”或“偏小”).
(3)用来改良酸性土壤的碱是.
解析:由图象可知,开始时溶液的pH大于7,随着反应的进行,溶液的pH逐渐减小到7,最后小于7,所以该实验是将稀硫酸滴人氢氧化钠溶液中.当滴入稀硫酸体积为V2 mL时,溶液的pH小于7,说明溶液显酸性,稀硫酸过量,这时溶液中的溶质为反应生成的Na2S04及过量的H2S04.测定酸性溶液的pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,相当于稀释了待测液,会使酸溶液的酸性减弱,所以pH偏大.
答案:(1)①稀硫酸 氢氧化钠溶液②H2S04.Na2S04 (2)偏大 (3)氢氧化钙
例5 (2019.广东)化学肥料是农作物的“粮食”,下列说法正确的是( ).
A.尿素[CO(NH2)2]属于复合肥料
B.我们应大量施用化肥以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
解析:复合肥料指的是含氮、磷、钾三种元素中的两种或两种以上的肥料,尿素属于氮肥,故A错误,我们应均衡适度地施用化肥,故B错误.棉花叶片枯黄,应施用氮肥,故D错误.
答案:C.
你学会了吗
1.某同学在学习化学过程中归纳出了以下知识,你认为正确的是( ).
A.能使紫色石蕊试液变蓝或使无色酚酞溶液变红的溶液一定是碱溶液
B.如果金属与酸能发生置换反应,那么反应前后溶液的质量可能增加
C.酸、碱的组成中一定含有氢元素,盐中可能含有氢元素
D.某固体与盐酸反应能产生无色气体,则该固体一定是碳酸盐
2.表3所列有关物质的检验、鉴别、分离、除杂的实验方案正确的是( ).
3.酸、碱、盐在生产、生活中应用广泛.
(1)硫酸是一种重要的酸,稀释浓硫酸时应.
(2)酸和碱的中和反应在实际中应用广泛.我市某校化学实验室的废液呈酸性,应选用
溶液(指示剂)检验该废液.
(3)小苏打是焙制糕点所用的发酵粉的主要成分之一.在医疗上,它是治疗胃酸过多症的一种药剂,请写出该反应的化学方程式:.
(4)现有Ba(N03)2溶液、稀硫酸、Na2C03溶液、KOH溶液和CuS04溶液,下列选项中能够与上述物质发生复分解反应,并生成沉淀的是( ).
A.稀盐酸
B.烧碱溶液
C.硝酸铵溶液
写出上述反应的化学方程式:____.
参考答案
1.C 2.D 3.(1)将浓硫酸沿容器内壁缓慢注入,并用玻璃棒不断搅拌 (2)紫色石蕊 (3)NaHC03+HCI=NaCI+H20+C02 ↑(4)B 2NaOH+CuS04=Na2S04+Cu(OH)2↓

