拼接式毛细管电泳柱后蛋白质荧光衍生微膜反应器的构建与性能研究
张凌怡等
摘 要 通过将两根柱端刻蚀的毛细管插入一小段聚砜中空纤维膜中,两根毛细管在膜内距离为零,构建了拼接式毛细管电泳柱后蛋白质荧光衍生微膜反应器,研究了其衍生化性能。拼接式微膜反应器中,衍生试剂通过两根拼接毛细管之间的空隙进入反应池和目标物反应。研究表明,与膜长0.3~1.0 mm非拼接式微膜反应器相比,拼接式柱后衍生微膜反应器可保证衍生化试剂和分析物充分反应,有效改善柱效和检测灵敏度。考察了分离电压(5~10 kV)及衍生试剂浓度等因素对衍生化反应的影响,并对荧光强度和蛋白质样品浓度之间的关系进行了探究。当运行电压为10 kV, 衍生试剂为含有1.5 mmol/L 2,3-萘二甲醛和 60.0 mmol/L β-巯基乙醇的100 mmol/L 硼酸盐缓冲液(pH 9.5)时,在0.007~0.04 mg/mL浓度范围内,荧光强度与蛋白质浓度之间具有良好的线性关系,对标准蛋白BSA的检出限可达5.6 nmol/L。与毛细管区带电泳/紫外检测结果对比,此反应器几乎没有增加系统的死体积,柱效也无明显降低,具有良好的稳定性和重现性。
关键词 拼接式微膜反应器; 毛细管电泳; 柱后荧光衍生; 蛋白质
1 引 言
毛细管电泳(CE)因其具有分离效率高、分析速度快、样品用量少、容易实现自动化等优点,在生物样品的分离分析方面发挥着重要作用[1~4]。但CE的检测光程一般较短, 采用紫外检测灵敏度较低, 在一定程度上限制了其应用。激光诱导荧光检测器 (LIFD) 以激光器为光源,更易于聚焦至微分析系统的流通光路中,是CE中灵敏度最高的一种检测器[5,6]。高灵敏度的LIFD与高分辨率的CE分离技术相结合, 不仅可以提高检测灵敏度,还可改善选择性,在生物样品方面具有广阔的应用前景[7]。
目前, 已知的蛋白质大部分没有自然荧光[8],使用荧光检测时通常需对蛋白质进行荧光衍生。文献报道的蛋白质荧光衍生化法主要有柱前衍生、柱上衍生、柱后衍生3种类型[9,10]。柱前衍生是最常用的衍生化方式,其衍生化过程和分离过程分别独立完成,样品经衍生化后被送入分离系统进行分离分析,对衍生化产物的稳定性要求较高[11,12]。柱上衍生为衍生过程和分离过程同时进行的衍生化方法,缓冲液必须同时满足衍生化和分离的需求[13,14]。无论柱前衍生还是柱上衍生,其衍生化过程都会带入较多的杂质而影响检测结果。柱后衍生法中, 样品经CE分离后再与衍生化试剂发生反应,可避免杂质及多重衍生峰对分离结果的影响,因此特别适合像蛋白质这种复杂且具有多反应位点的大分子的荧光衍生。
柱后衍生反应器的制作是柱后衍生的难点之一,目前文献报道的柱后衍生反应器主要有间隙式、同轴式和鞘流式等 \[9]。间隙式柱后衍生反应器因其结构简单,已被大量应用于CE-LIFD系统中,然而即使扩散系数较小的大分子样品也会在间隙处产生损失,准直性问题造成的扩散损失也不容忽视。中空纤维膜具有良好的尺寸排阻特性,可以减少蛋白质在接口处的扩散损失,并且可以避免普通间隙式反应器接口处因准直性差造成的样品扩散损失。
在本研究组的前期工作中[15,16],利用膜的半渗透性,使用截留分子量小于蛋白质分子量的中空纤维膜构建了一种新型柱后衍生微膜反应器,并应用于蛋白质的CE-LIFD检测,取得了较好的效果。然而,将配有柱后衍生微膜反应器的毛细管区带电泳(CZE)系统与一般的CZE比较发现,前者死时间增加15%,柱效也有所下降,说明反应器带来较大死体积 \[15]。为了完善该反应器,本研究构建了死体积较小的拼接式柱后荧光衍生微膜反应器,并对其性能进行了研究。
2 实验部分
2.1 仪器与试剂
熔融石英毛细管 (75 μm i.d.375 μm o.d.,邯郸市鑫诺光纤色谱有限公司);中空纤维膜 (MWCO 10000 Da, 200 μm i.d.220 μm o.d.,中科院大连化学物理研究所);高压直流电源(天津东文高压电源有限公司)。2,3-萘二甲醛 (NDA,北京百灵威科技有限公司); β-巯基乙醇 (β-ME,上海阿拉丁试剂有限公司);牛血清白蛋白第5组分 (BSA)和胎球蛋白(Fetuin)(美国Sigma-Aldrich公司);其它试剂均为分析或更高纯度试剂;实验用水经 Sartorius Arium 611 (德国Sartorius公司) 纯水仪纯化。
2.2 溶液的配制
分别配制1 mg/mL的 BSA和Fetuin标准储备液,4℃保存,再用水逐级稀释至所需浓度。
硼酸盐缓溶液是由硼砂配制而成,并用1 mol/L NaOH溶液调至pH 9.50;磷酸盐缓冲液是由NaHPO4配制而成,并用1 mol/L NaOH溶液调至pH 11.00;NDA和β-ME溶于甲醇中,作为母液备用;衍生反应溶液:100 mmol/L硼酸盐缓冲液中 (pH 9.5) 加入适量 1.5 mmol/L NDA和 60 mmol/L β-ME的甲醇溶液;最终的分离缓冲溶液是由磷酸盐缓冲液加入0.4% (m/V) PEG 8000和10% (V/V) 乙腈 (ACN) 组成。上述溶液在使用前用0.22 μm有机微孔滤膜过滤。
2.3 柱后衍生微膜反应器的构建[15]
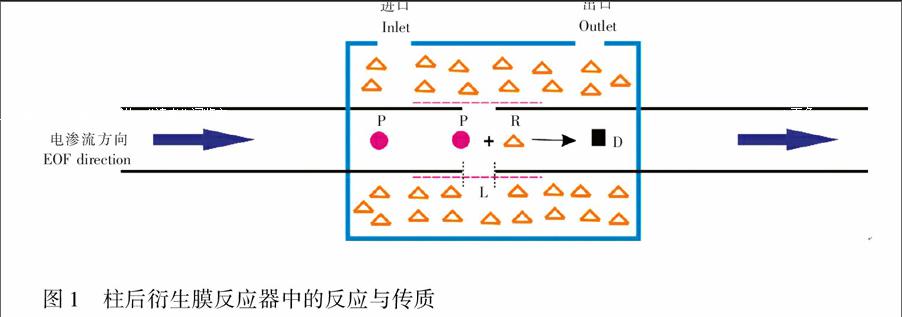
将两根柱端刻蚀的毛细管插入一小段聚砜中空纤维膜中,使两根毛细管在膜内相距0~1 mm,然后用环氧胶固定;再将固定有纤维膜的这一段毛细管固定在用以盛装衍生试剂的反应池中;最后在检测毛细管上接近反应池的一端除去一小段聚酰亚胺涂层作为检测窗口。图1为微膜反应器的衍生原理示意图。
2.4 实验条件
自行搭建的共轴型结构激光诱导荧光检测器的激发波长和发射波长分别为473和525 nm; 分离毛细管的入口端放入分离缓冲液容器中,电极接正极;检测毛细管的出口端置于废液容器中,电极接地。为减少外界杂散光的影响,整个系统置于暗箱中。
每天使用前,膜反应器用0.1 mol/L HCl、超纯水、0.1 mol/L NaOH、超纯水依次冲洗5 min。每5次进样后用0.1 mol/L NaOH、超纯水、分离缓冲液按照出峰的保留情况依次冲洗2~5 min。除特定指出外,电泳分离分析均在200 V/cm电压下进行,200 V/cm电进样10 s。
3 结果与讨论
3.1 膜长与荧光强度的关系
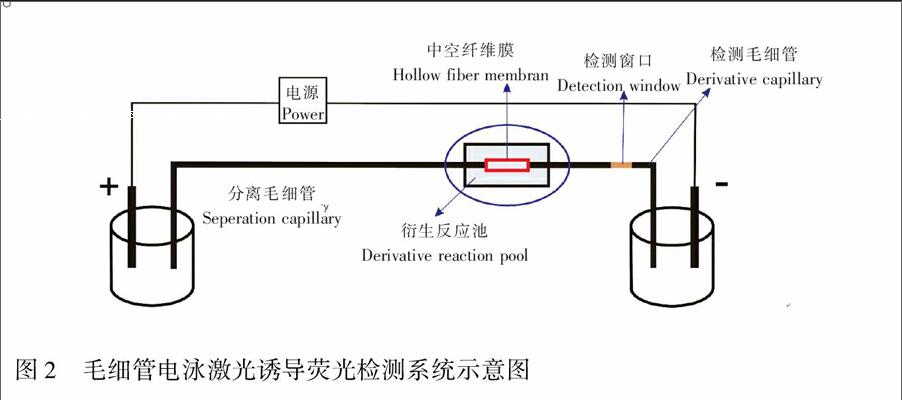
前期工作[15,16]中发现,1 mm膜长反应器死体积较大,本研究构建了膜长约为1.0 mm微膜反应器,并考察了膜长与荧光强度的关系,构建了拼接式微膜反应器(衍生试剂通过两根拼接毛细管之间的空隙进入反应池和目标物反应),并详细研究了其性能特征。图2是毛细管电泳激光诱导荧光检测系统的结构示意图。
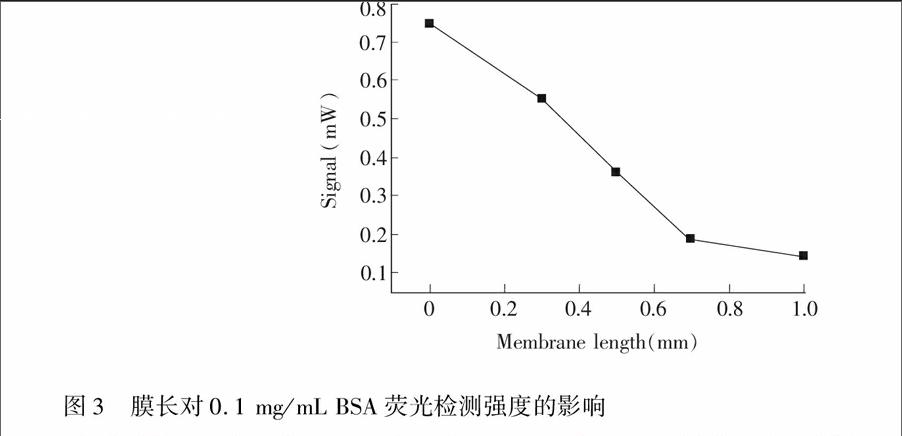
以0.1 mg/mL BSA为样品,研究~1.0 mm膜长与荧光强度的关系,结果如图3所示。在相同实验条件下,荧光强度随着膜长度的增加而降低,并且峰型稍有展宽,柱效降低。表明两根毛细管之间的间隙已足够使得衍生试剂和待测目标物充分反应。因此,采用拼接的方式,结合膜的阻隔作用,可以更好地实现蛋白质的柱后衍生及荧光检测,避免过长的膜导致的较大死体积。
3.2 运行电压的影响
在拼接式微膜反应器系统中,运行电压通过影响电渗流速度而影响样品的衍生化反应时间,进而影响检测。运行电压过大,电渗流速度太大,导致膜内外溶液交换时间短,衍生试剂进入膜内量少,衍生反应不完全。同时, 运行电压过大,焦耳热效应对膜的损害也很大。图4为运行电压5~10 kV 时,0.1 mg/mL BSA衍生化产物荧光信号及保留时间的变化趋势。随着运行电压的减小,荧光强度呈略微增大趋势,但保留时间大大延长,导致分析周期过长。综合考虑两种因素,采用10 kV为运行电压。采用高于10 kV的运行电压可以加快分析时间,但是在所构建的系统中,焦耳热现象已经十分明显。
3.3 衍生试剂浓度的影响
NDA与β-ME反应的产物与氨基反应速度快,荧光量子产率高,已经被大量用于CE柱后衍生化系统。在前期工作[15,16]中已经对NDA、β-ME及蛋白质的最佳配比加以优化。但在拼接式柱后衍生CE-LIFD系统中,衍生化区段长度大大减小,相同条件下进入膜内的衍生化试剂量也相应地减少,因此,考察衍生试剂浓度对衍生化程度的影响十分必要。以0.1 mg/mL BSA为样品,分别考察不同衍生化试剂浓度对衍生化反应的影响,结果如图5所示。
由图 5 可见,随着衍生化试剂浓度的增加,BSA的荧光强度几乎没有变化,说明当衍生试剂的组成是100 mmol/L 硼酸盐缓冲液(pH 9.5)中含
3.4 荧光强度与蛋白质浓度间关系
如图6所示,当BSA浓度在0.007~0.04 mg/mL时,蛋白质浓度与荧光强度有良好的线性关系,线性回归方程为y=106.27x-0.5206 (R=0.9996)。以实验中基线峰值为噪声(0.012 mV), 测得BSA 的检出限为0.34 μg/mL (S/N=3),即5.6 nmol/L。此结果与文献\[17\]报道的鞘流式柱后衍生反应器(8.6 nmol/L)处于同一数量级。图7为0.007 mg/mL BSA的电泳谱图。
3.5 系统死体积与柱效间关系
使用与拼接式柱后衍生微膜反应器具有相同内径、相同检测长度和相同总长度的空管柱作对照,使两者在相同条件下对相同浓度的BSA样品进行CZE分析,考察膜反应器对系统死体积及柱效的影响。实验中膜反应器的反应池内充满分离缓冲液。
相比于常规空管柱CZE分析,拼接式柱后衍生微膜反应器系统中的死时间和空管柱的死时间几乎相同, BSA峰宽说明柱效没有明显降低,相对于1 mm膜长反应器的CZE分析结果,分析系统的死体积大大降低,系统柱效得到显著提高。
3.6 分离能力和稳定性考察
用该微膜系统分离标准蛋白质BSA和Fetuin的混合物,结果如图8所示。两者分离度R=3.07,柱效分别为 1387和1285塔板数/m。
进一步对该系统的重复性及稳定性进行考察。连续进样3次, BSA和Fetuin保留时间的RSD分别为0.6%和0.3%;峰高的RSD分别为4.6%和3.2%。在连续进行35次后,微膜反应器依旧稳定,分离能力和柱效没有显著变化,说明其稳定性良好。
4 结 论
构建了拼接式毛细管电泳柱后蛋白质荧光衍生分离检测系统,考察了分离电压及衍生化试剂浓度等因素对衍生反应的影响,BSA浓度在0.007~0.04 mg/mL浓度范围内,荧光强度和样品浓度呈良好的线性关, BSA的检出限可达5.6 nmol/L。此反应器死体积较小,具有良好的稳定性和重现性。本研究为进一步将拼接式柱后衍生微膜反应器应用于复杂蛋白质样品的分离分析提供参考。
References
1 Righetti P G, Sebastiano R, Citterio A. Proteomic, 2013, 13(2): 325-340
2 DolnikV. Electrophoresis, 2006, 27(1): 126-141
3 DolnikV. Electrophoresis, 1999, 20(15-16): 3106-3115
4 YANG Xiu-Min, ZHANG Shuai-Hua, WANG Chun, WANG Zhi. Chinese J. Anal. Chem., 2013, 41(12): 1939-1945
杨秀敏, 张帅华, 王 春, 王 志. 分析化学, 2013, 41(12): 1939-1945
5 Ramsay L M, Dickerson J A, Dovichi N J. Electrophoresis, 2009, 30(2): 297-302
6 Ramsay L M, Dickerson J A, Dada O. Anal. Chem., 2009, 81(5): 1741-1746
7 LU Qiao-Mei, ZHANG Lan, CHENG Jin-Tian, CHEN Guo-Nan. Chinese J. Chem. Commun., 2010, 73(7): 586-592
卢巧梅, 张 兰, 程锦添, 陈国南. 化学通报, 2010, 73(7): 586-592
8 Ye M,Hu S, Quigley W W C, Dovichi N J. J. Chromatogr. A, 2004, 1022(1-2): 201-206
9 Zhu R,Kok W T. J. Pharm. Biomed. Anal., 1998, 17(6-7): 985-999
10 Jin L J, Giordano B C, Landers J P. Anal. Chem., 2001, 73(20): 4994-4999
11 Gump E L,Monnig C A. J. Chromatogr. A, 1995, 715(1): 167-177
12 LI Zhi, SHAO Wan-Fang, HUANG Ye-Wei, ZHANG Dong-Ying. Chinese J. Tea in Fujian., 2010, (12): 12-16
李 智, 邵宛芳, 黄业伟, 张冬英. 福建茶叶, 2010, (12): 12-16
13 Krull I S,Deyl Z, Lingeman H. J. Chromatogr. A, 1994, 659(1-2): 1-17
14 Wang Y Y, Yang X R, Li K K, Li C R, Li L L, Li J X, Huang H L, He Y M, Ye C X, Song X H . Int. J. Food Sci. Technol., 2010, 45(6): 1263-1269
15 Liu F, Zhang L Y, Qian J H, Gao F Y, Ren J. Chem. Res. Chin. Univ., 2013, 29(5): 828-830
16 Liu F, Zhang L Y, Qian J H, Ren J, Gao F Y. Analyst, 2013, 138, 6429
17 Ye M L, Hu S, Quigley W W C, Dovichi N J. J. Chromatogr. A, 2004, 1022(1-2): 201-206



摘 要 通过将两根柱端刻蚀的毛细管插入一小段聚砜中空纤维膜中,两根毛细管在膜内距离为零,构建了拼接式毛细管电泳柱后蛋白质荧光衍生微膜反应器,研究了其衍生化性能。拼接式微膜反应器中,衍生试剂通过两根拼接毛细管之间的空隙进入反应池和目标物反应。研究表明,与膜长0.3~1.0 mm非拼接式微膜反应器相比,拼接式柱后衍生微膜反应器可保证衍生化试剂和分析物充分反应,有效改善柱效和检测灵敏度。考察了分离电压(5~10 kV)及衍生试剂浓度等因素对衍生化反应的影响,并对荧光强度和蛋白质样品浓度之间的关系进行了探究。当运行电压为10 kV, 衍生试剂为含有1.5 mmol/L 2,3-萘二甲醛和 60.0 mmol/L β-巯基乙醇的100 mmol/L 硼酸盐缓冲液(pH 9.5)时,在0.007~0.04 mg/mL浓度范围内,荧光强度与蛋白质浓度之间具有良好的线性关系,对标准蛋白BSA的检出限可达5.6 nmol/L。与毛细管区带电泳/紫外检测结果对比,此反应器几乎没有增加系统的死体积,柱效也无明显降低,具有良好的稳定性和重现性。
关键词 拼接式微膜反应器; 毛细管电泳; 柱后荧光衍生; 蛋白质
1 引 言
毛细管电泳(CE)因其具有分离效率高、分析速度快、样品用量少、容易实现自动化等优点,在生物样品的分离分析方面发挥着重要作用[1~4]。但CE的检测光程一般较短, 采用紫外检测灵敏度较低, 在一定程度上限制了其应用。激光诱导荧光检测器 (LIFD) 以激光器为光源,更易于聚焦至微分析系统的流通光路中,是CE中灵敏度最高的一种检测器[5,6]。高灵敏度的LIFD与高分辨率的CE分离技术相结合, 不仅可以提高检测灵敏度,还可改善选择性,在生物样品方面具有广阔的应用前景[7]。
目前, 已知的蛋白质大部分没有自然荧光[8],使用荧光检测时通常需对蛋白质进行荧光衍生。文献报道的蛋白质荧光衍生化法主要有柱前衍生、柱上衍生、柱后衍生3种类型[9,10]。柱前衍生是最常用的衍生化方式,其衍生化过程和分离过程分别独立完成,样品经衍生化后被送入分离系统进行分离分析,对衍生化产物的稳定性要求较高[11,12]。柱上衍生为衍生过程和分离过程同时进行的衍生化方法,缓冲液必须同时满足衍生化和分离的需求[13,14]。无论柱前衍生还是柱上衍生,其衍生化过程都会带入较多的杂质而影响检测结果。柱后衍生法中, 样品经CE分离后再与衍生化试剂发生反应,可避免杂质及多重衍生峰对分离结果的影响,因此特别适合像蛋白质这种复杂且具有多反应位点的大分子的荧光衍生。
柱后衍生反应器的制作是柱后衍生的难点之一,目前文献报道的柱后衍生反应器主要有间隙式、同轴式和鞘流式等 \[9]。间隙式柱后衍生反应器因其结构简单,已被大量应用于CE-LIFD系统中,然而即使扩散系数较小的大分子样品也会在间隙处产生损失,准直性问题造成的扩散损失也不容忽视。中空纤维膜具有良好的尺寸排阻特性,可以减少蛋白质在接口处的扩散损失,并且可以避免普通间隙式反应器接口处因准直性差造成的样品扩散损失。
在本研究组的前期工作中[15,16],利用膜的半渗透性,使用截留分子量小于蛋白质分子量的中空纤维膜构建了一种新型柱后衍生微膜反应器,并应用于蛋白质的CE-LIFD检测,取得了较好的效果。然而,将配有柱后衍生微膜反应器的毛细管区带电泳(CZE)系统与一般的CZE比较发现,前者死时间增加15%,柱效也有所下降,说明反应器带来较大死体积 \[15]。为了完善该反应器,本研究构建了死体积较小的拼接式柱后荧光衍生微膜反应器,并对其性能进行了研究。
2 实验部分
2.1 仪器与试剂
熔融石英毛细管 (75 μm i.d.375 μm o.d.,邯郸市鑫诺光纤色谱有限公司);中空纤维膜 (MWCO 10000 Da, 200 μm i.d.220 μm o.d.,中科院大连化学物理研究所);高压直流电源(天津东文高压电源有限公司)。2,3-萘二甲醛 (NDA,北京百灵威科技有限公司); β-巯基乙醇 (β-ME,上海阿拉丁试剂有限公司);牛血清白蛋白第5组分 (BSA)和胎球蛋白(Fetuin)(美国Sigma-Aldrich公司);其它试剂均为分析或更高纯度试剂;实验用水经 Sartorius Arium 611 (德国Sartorius公司) 纯水仪纯化。
2.2 溶液的配制
分别配制1 mg/mL的 BSA和Fetuin标准储备液,4℃保存,再用水逐级稀释至所需浓度。
硼酸盐缓溶液是由硼砂配制而成,并用1 mol/L NaOH溶液调至pH 9.50;磷酸盐缓冲液是由NaHPO4配制而成,并用1 mol/L NaOH溶液调至pH 11.00;NDA和β-ME溶于甲醇中,作为母液备用;衍生反应溶液:100 mmol/L硼酸盐缓冲液中 (pH 9.5) 加入适量 1.5 mmol/L NDA和 60 mmol/L β-ME的甲醇溶液;最终的分离缓冲溶液是由磷酸盐缓冲液加入0.4% (m/V) PEG 8000和10% (V/V) 乙腈 (ACN) 组成。上述溶液在使用前用0.22 μm有机微孔滤膜过滤。
2.3 柱后衍生微膜反应器的构建[15]
将两根柱端刻蚀的毛细管插入一小段聚砜中空纤维膜中,使两根毛细管在膜内相距0~1 mm,然后用环氧胶固定;再将固定有纤维膜的这一段毛细管固定在用以盛装衍生试剂的反应池中;最后在检测毛细管上接近反应池的一端除去一小段聚酰亚胺涂层作为检测窗口。图1为微膜反应器的衍生原理示意图。
2.4 实验条件
自行搭建的共轴型结构激光诱导荧光检测器的激发波长和发射波长分别为473和525 nm; 分离毛细管的入口端放入分离缓冲液容器中,电极接正极;检测毛细管的出口端置于废液容器中,电极接地。为减少外界杂散光的影响,整个系统置于暗箱中。
每天使用前,膜反应器用0.1 mol/L HCl、超纯水、0.1 mol/L NaOH、超纯水依次冲洗5 min。每5次进样后用0.1 mol/L NaOH、超纯水、分离缓冲液按照出峰的保留情况依次冲洗2~5 min。除特定指出外,电泳分离分析均在200 V/cm电压下进行,200 V/cm电进样10 s。
3 结果与讨论
3.1 膜长与荧光强度的关系
前期工作[15,16]中发现,1 mm膜长反应器死体积较大,本研究构建了膜长约为1.0 mm微膜反应器,并考察了膜长与荧光强度的关系,构建了拼接式微膜反应器(衍生试剂通过两根拼接毛细管之间的空隙进入反应池和目标物反应),并详细研究了其性能特征。图2是毛细管电泳激光诱导荧光检测系统的结构示意图。
以0.1 mg/mL BSA为样品,研究~1.0 mm膜长与荧光强度的关系,结果如图3所示。在相同实验条件下,荧光强度随着膜长度的增加而降低,并且峰型稍有展宽,柱效降低。表明两根毛细管之间的间隙已足够使得衍生试剂和待测目标物充分反应。因此,采用拼接的方式,结合膜的阻隔作用,可以更好地实现蛋白质的柱后衍生及荧光检测,避免过长的膜导致的较大死体积。
3.2 运行电压的影响
在拼接式微膜反应器系统中,运行电压通过影响电渗流速度而影响样品的衍生化反应时间,进而影响检测。运行电压过大,电渗流速度太大,导致膜内外溶液交换时间短,衍生试剂进入膜内量少,衍生反应不完全。同时, 运行电压过大,焦耳热效应对膜的损害也很大。图4为运行电压5~10 kV 时,0.1 mg/mL BSA衍生化产物荧光信号及保留时间的变化趋势。随着运行电压的减小,荧光强度呈略微增大趋势,但保留时间大大延长,导致分析周期过长。综合考虑两种因素,采用10 kV为运行电压。采用高于10 kV的运行电压可以加快分析时间,但是在所构建的系统中,焦耳热现象已经十分明显。
3.3 衍生试剂浓度的影响
NDA与β-ME反应的产物与氨基反应速度快,荧光量子产率高,已经被大量用于CE柱后衍生化系统。在前期工作[15,16]中已经对NDA、β-ME及蛋白质的最佳配比加以优化。但在拼接式柱后衍生CE-LIFD系统中,衍生化区段长度大大减小,相同条件下进入膜内的衍生化试剂量也相应地减少,因此,考察衍生试剂浓度对衍生化程度的影响十分必要。以0.1 mg/mL BSA为样品,分别考察不同衍生化试剂浓度对衍生化反应的影响,结果如图5所示。
由图 5 可见,随着衍生化试剂浓度的增加,BSA的荧光强度几乎没有变化,说明当衍生试剂的组成是100 mmol/L 硼酸盐缓冲液(pH 9.5)中含
3.4 荧光强度与蛋白质浓度间关系
如图6所示,当BSA浓度在0.007~0.04 mg/mL时,蛋白质浓度与荧光强度有良好的线性关系,线性回归方程为y=106.27x-0.5206 (R=0.9996)。以实验中基线峰值为噪声(0.012 mV), 测得BSA 的检出限为0.34 μg/mL (S/N=3),即5.6 nmol/L。此结果与文献\[17\]报道的鞘流式柱后衍生反应器(8.6 nmol/L)处于同一数量级。图7为0.007 mg/mL BSA的电泳谱图。
3.5 系统死体积与柱效间关系
使用与拼接式柱后衍生微膜反应器具有相同内径、相同检测长度和相同总长度的空管柱作对照,使两者在相同条件下对相同浓度的BSA样品进行CZE分析,考察膜反应器对系统死体积及柱效的影响。实验中膜反应器的反应池内充满分离缓冲液。
相比于常规空管柱CZE分析,拼接式柱后衍生微膜反应器系统中的死时间和空管柱的死时间几乎相同, BSA峰宽说明柱效没有明显降低,相对于1 mm膜长反应器的CZE分析结果,分析系统的死体积大大降低,系统柱效得到显著提高。
3.6 分离能力和稳定性考察
用该微膜系统分离标准蛋白质BSA和Fetuin的混合物,结果如图8所示。两者分离度R=3.07,柱效分别为 1387和1285塔板数/m。
进一步对该系统的重复性及稳定性进行考察。连续进样3次, BSA和Fetuin保留时间的RSD分别为0.6%和0.3%;峰高的RSD分别为4.6%和3.2%。在连续进行35次后,微膜反应器依旧稳定,分离能力和柱效没有显著变化,说明其稳定性良好。
4 结 论
构建了拼接式毛细管电泳柱后蛋白质荧光衍生分离检测系统,考察了分离电压及衍生化试剂浓度等因素对衍生反应的影响,BSA浓度在0.007~0.04 mg/mL浓度范围内,荧光强度和样品浓度呈良好的线性关, BSA的检出限可达5.6 nmol/L。此反应器死体积较小,具有良好的稳定性和重现性。本研究为进一步将拼接式柱后衍生微膜反应器应用于复杂蛋白质样品的分离分析提供参考。
References
1 Righetti P G, Sebastiano R, Citterio A. Proteomic, 2013, 13(2): 325-340
2 DolnikV. Electrophoresis, 2006, 27(1): 126-141
3 DolnikV. Electrophoresis, 1999, 20(15-16): 3106-3115
4 YANG Xiu-Min, ZHANG Shuai-Hua, WANG Chun, WANG Zhi. Chinese J. Anal. Chem., 2013, 41(12): 1939-1945
杨秀敏, 张帅华, 王 春, 王 志. 分析化学, 2013, 41(12): 1939-1945
5 Ramsay L M, Dickerson J A, Dovichi N J. Electrophoresis, 2009, 30(2): 297-302
6 Ramsay L M, Dickerson J A, Dada O. Anal. Chem., 2009, 81(5): 1741-1746
7 LU Qiao-Mei, ZHANG Lan, CHENG Jin-Tian, CHEN Guo-Nan. Chinese J. Chem. Commun., 2010, 73(7): 586-592
卢巧梅, 张 兰, 程锦添, 陈国南. 化学通报, 2010, 73(7): 586-592
8 Ye M,Hu S, Quigley W W C, Dovichi N J. J. Chromatogr. A, 2004, 1022(1-2): 201-206
9 Zhu R,Kok W T. J. Pharm. Biomed. Anal., 1998, 17(6-7): 985-999
10 Jin L J, Giordano B C, Landers J P. Anal. Chem., 2001, 73(20): 4994-4999
11 Gump E L,Monnig C A. J. Chromatogr. A, 1995, 715(1): 167-177
12 LI Zhi, SHAO Wan-Fang, HUANG Ye-Wei, ZHANG Dong-Ying. Chinese J. Tea in Fujian., 2010, (12): 12-16
李 智, 邵宛芳, 黄业伟, 张冬英. 福建茶叶, 2010, (12): 12-16
13 Krull I S,Deyl Z, Lingeman H. J. Chromatogr. A, 1994, 659(1-2): 1-17
14 Wang Y Y, Yang X R, Li K K, Li C R, Li L L, Li J X, Huang H L, He Y M, Ye C X, Song X H . Int. J. Food Sci. Technol., 2010, 45(6): 1263-1269
15 Liu F, Zhang L Y, Qian J H, Gao F Y, Ren J. Chem. Res. Chin. Univ., 2013, 29(5): 828-830
16 Liu F, Zhang L Y, Qian J H, Ren J, Gao F Y. Analyst, 2013, 138, 6429
17 Ye M L, Hu S, Quigley W W C, Dovichi N J. J. Chromatogr. A, 2004, 1022(1-2): 201-206

