电动微分离技术的研究进展
陈长功等

摘 要 电动微分离技术是一门近年来快速发展的技术,主要包括毛细管电泳(Capillary electrophoresis, CE)和毛细管电色谱(Capillary electrochromatography, CEC)。该技术凭借高效、快速、环境友好等特点获得了广泛的关注。早期电动微分离技术存在重现性差、定量受限及联用检测器类型有限等缺点,发展缓慢。针对这些问题,多种形式的仪器结构改造及新型检测器的研发成为电动微分离技术的研究趋势。本文主要就近年来电动微分离技术在仪器结构改造及检测器研发方面进行了系统综述,希望能够为电动微分离技术的使用提供一定的指导。
关键词 电动微分离技术; 定量毛细管电泳; 加压毛细管电色谱; 综述
1 引 言
近年来,随着社会的发展和进步,食品药品质量控制及环境监控的要求不断提高,对微流试剂和低毒试剂技术来替代传统的需要消耗大量试剂的分析技术的需求更加迫切[1,2]。同时,随着生命科学在全球的兴起,样品的贵重化和微量化也显得尤为突出,现有的很多分析手段已经无法满足科技工作者对痕量样品的高效、快速的分析要求,需要具有更高分辨率、更快分离速度和更高灵敏度的分析技术及仪器[3]。因此,发展更加高效环保的微分离技术便成为大趋势[4]。电动微分离技术,如毛细管电泳(Capillary electrophoresis, CE)和毛细管电色谱(Capillary electrochromatography, CEC)技术等,引起了人们越来越多的关注[5~7]。这类技术具有高效、快速及环境友好等优势,但由于传统电动微分离技术存在重现性差、定量受限及联用检测器类型有限等缺点,它们的应用领域及应用范围受到了很大的限制。近年来,为了提高和拓展这类电动微分离技术的性能及应用范围,科研工作者投入了大量的精力对仪器结构进行了改造并开发了多种新型检测器。
本文将针对近年来电动微分离技术在仪器结构改造及检测器开发进行系统综述,期望能够为电动微分离技术的使用及发展提供指导。
2 仪器结构改进
传统的电动微分离仪器主要由进样装置、微流溶剂输送装置、微流控制装置、高压电源、毛细管柱、检测器等组成,各个部件均需要通过不断地优化和改进,才能使得电动微分离技术呈现出高柱效、高分辨率、高选择性及快速分离的优势。近年来,为了进一步提高微电动分离技术的稳定性、精密度、灵敏度和实用性,新型高精度定量进样装置、自动进样装置、微流控制方式以及毛细管柱控温系统的研发都获得了长足进展。
2.1 全自动高精度定量毛细管电泳
CE仅依靠电渗流(Electroosmotic flow, EOF)的驱动来进行离子型物质的分离,中性物质无法得到分离。而且传统的“蘸取式”进样方法无法进行定量分析。闫超等[8]研制了全自动高精度定量毛细管电泳仪(Quantitative capillary electrophoresis, qCE),结构如图1。该设备既能和UV联用,也能与LIF等检测器联用, 并具有如下优点:(1) 自动进样器通过10 nL的定量阀实现系统的准确定量,与液流分配系统的协作运行实现了该系统从取样、进样、冲洗管路以及毛细管预处理等过程的全面自动化。自动进样过程也极大地提高了分析时间的重现性。(2) 自主研制的柱温箱,可实现4℃~40℃范围的控温。有效降低了焦耳热的影响,改善该系统的定量重复性和分离效率。(3) 成功引入电隔离槽装置,将定量阀隔离于电场之外,提高了系统的安全性、可靠性和稳定性。并用该系统进行了胞嘧啶、脱氧尿苷、腺苷、尿嘧啶、尿苷及肌苷这6种核苷及碱基类物质的分析,保留时间的相对标准偏差(RSD)<0.6%,峰面积的RSD在0.5%~3%之间,表明该系统改善了传统电泳的痼疾,定性和定量分析重复性可达到FDA的要求,分析结果准确可靠。
2.2 加压毛细管电色谱
毛细管电色谱(CEC)是依靠电渗流(Electroosmotic flow, EOF) 的推动力和两相间分配系数的不同分离极性和中性物质,但在分析过程中容易发生干柱和气泡现象。为了克服传统CEC的缺陷,引入了液相色谱溶剂输送模块,提出了加压毛细管电色谱(Pressurized capillary electrochromatography, pCEC)的概念。pCEC采用了压力流和电渗流的双驱动,柱效介于HPLC和CEC之间[9]。Yan 等推出了TriSepTM-2000系统,实现了pCEC与紫外检测器的联用,它通过两个微流泵来输送溶液并且经过混合阀混合,在毛细管色谱柱进样端提供一定的压力,二元微流泵系统可由程序来控制其中两种流动相的混合比例,完成溶剂的梯度洗脱。整个系统由于有压力和电压两个参数共同作用来调节分离,拓宽了它的分离能力和应用范围,使其能被用在分析复杂样品的领域。
最近,该研究组又推出了一款新型Trisep-2100 pCEC 系统(图2),其对高效微流电色谱体系进行了柱温箱、四通的优化及纳升级旋转进样阀的使用,进一步提升了pCEC进样的准确度。采用该系统进行了植物油中没食子酸丙酯、叔丁基对苯二酚、丁基羟基茴香醚、二叔丁基对甲酚4种抗氧剂的测定[10],8 min实现分离,样品的加标回收率在93.5%~108.0%之间,RSD为0.3%~1.3%,结果稳定可靠。
3 联用检测器的研究进展
近年来,各类电动微分离技术凭借高效、快速、溶剂及样品消耗少等优势获得了广泛的关注和发展,但是其本身固有的一些不足,如毛细管色谱柱内径窄小、检测灵敏度低、样品检测种类受限等,使得研制开发新型高效的各类检测器成为必然的发展趋势。据统计,目前已发展的电动微分离仪器联用检测器主要包括:紫外-可见吸收检测器(UV/Vis)、激光诱导荧光检测器(LIF)、电化学检测器(ECD)、化学发光检测器(CL)、与核磁共振仪(NMR)联用、与质谱仪(MS)联用、微型蒸发光检测器(μELSD)等。下面将分类进行介绍:
3.1 紫外-可见吸收检测器 (Ultraviolet/ visible absorption detector, UV/Vis)
UV/Vis吸收检测器结构简单,灵敏度高、噪音低、线性范围宽,具有很好的适用性,是电动微分离技术最常用的一种检测器。但UV/Vis只适合具有紫外或可见光吸收基团的物质,对紫外吸收差的化合物灵敏度低,检出限一般为106 mol/L。UV/Vis检测器满足不了痕量分析的要求。为了提高电动微分离技术的检测灵敏度,可以采用优化检测波长、直接激光诱导荧光柱上检测、紫外光催化触发化学反应检测[11,12]等手段。
3.2 激光诱导荧光检测器(Laser induced fluorescence detector, LIF)
LIF检测器最早于上世纪70年代提出,是目前检测灵敏度最高的一种检测器,在超痕量检测和快速分离中具有显著优势。1995年,Yan等[13]首次将CEC与LIF联用,使用257 nm的氩离子激光源,快速分离测定了16种痕量多环芳烃,柱效高达6×105塔板数/m。Rebscher 等[14]考察了“柱上”与“在柱”两种不同方式,前者在检出限和区带宽度效果要优于后者。虽然经历了半个多世纪的发展,激光波长的选择和检测窗口校准等方面的仍有很大的局限,这在一定程度上限制了LIF检测器的应用范围。为了解决这个问题,闫超等[15]又研制了一种可变波长的新型LIF检测器(图3),有4个波长(375, 473, 561和638 nm)可供选择。利用半导体光纤激光器,设计了一种激光准直及位置可视化校准装置,实现了激光源位置、二向色镜和滤光片组的方便更换,提高了新型LIF检测器的重复性和安全性,大大拓展了其应用范围。结合这种新型可变波长LIF检测器,采用pCEC系统,成功实现了花生酱样品中4种黄曲霉毒素的分离检测,验证了这种可变波长LIF检测器的实用性及可靠性[16]。
与紫外检测器相比,LIF检测器的适用范围较窄; 影响分析灵敏度的因素较多,例如荧光淬灭、背景荧光等。
3.3 电化学检测器 (Electrochemical detector, ECD)
ECD检测器的原理是化合物被氧化或还原能产生正比于待测化合物浓度的电流,一般在特殊情况下使用,主要用于测定化学性质不稳定的离子,通常只有容易氧化或还原的电活性物质才可被检测,有高含量的氯化物、硫酸盐共存时,其它离子的检测也不受干扰,选择性非常高。而且还是一类灵敏度较高的检测器。检出限可达pg~ng 级,适合复杂体系(如体液、神经递质、组织匀浆等)的电活性物质的检测。安培检测器 (Amperometric detector, AD) 是基于在电极表面上发生氧化或还原反应产生电流响应与其电活性物质浓度成比例而建立的, AD 是与CEC联用中最常使用的检测器。根据有无隔离电场,分为离柱和在柱检测两种方式。Abdelhader等[17]首次进行了 CEC-AD 联用实验。Liu 等[18]构建了柱端式 pCEC-ED 系统,研制了自对准式电化学检测池,能自动实现电极和毛细管出口的对准操作,极大地提高了实验效率和重现性。Liu等[19]开发了一种 pCEC 在柱末端与 AD 相连接,在7 min内可以快速高效的分离辣椒中添加的4种苏丹红染料。通过对系统进行改进,分离出鸡蛋和牛奶等样品中的5种酚类雌激素、氯酚、苯酚[20,21]。Li 等[22]进行了联吡啶钌电化学电极联用,在 pH 3.5~7.0范围内,可使脯氨酸、腐胺、精胺、亚精胺达到基线分离,检出限均低于2.0 μmol/L。Lin 等[23]开发了 pCEC 与化学发光检测器柱上联用,通过在碱性溶液中鲁米诺与过氧化氢在电极上形成的Cu2+-氨基酸络合物的增强效应来进行氨基酸的分离,可使L-组氨酸、L-苏氨酸、L-络氨酸达到基线分离。Thanh 等[24]进行了 CEC-柱上非接触电导检测器联用进行非 UV 吸收样品的检测和定性工作,可在10 min内分离12种氨基酸。
安培检测器的灵敏度高,检出限可达10~1012 g; 线性范围较宽,一般为104~105。但是其选择性受到限制,通常只对电活性物质有响应;对流动相的温度、速度、pH 值等因素的变化比较敏感,其中溶解的氧会干扰测定;使用中,电极需经常清洗和更换。
3.4 化学发光检测器(Chemiluminescence detector, CL)
CL检测器的光学系统由反应池、检测器和读数装置3部分组成,结果简单,无需外加光源和分光系统,背景噪声低,避免了杂散光和光源不稳定性的影响,因而具有很高的检测灵敏度(10~10-10 mol/L)。化学发光检测器具有“化学窄带”效应,即在样品充分扩散到本底溶液前就已产生化学发光信号,适合于小体积在线快速检测,不会造成明显的区带展宽。但CL选择性较差,为了得到理想的分离效果和灵敏度及获得稳定的分析体系,需首先考察待测物和CL 试剂的混合模式以及检测体积,其次是用于分离的缓冲液与CL 试剂 pH 值的兼容性及混合流体的稳定性。一般首选柱后混合模式,因其能确保分离后组分在检测区域仍能保持较好的分离环境。柱后流体混合接口装置可分为合并流式、同轴流式、和贮液池式等。根据检测区与分离电压提供区是否隔离,接口装置又可分为在柱式、离柱式和柱端式等。Lin 等[25]设计了离柱同轴流式的 μHPLC/pCEC-CL 系统,通过分离鲁米诺和 N-4-氨基丁基-N-乙基异鲁米诺,结果表明, 由于“化学窄带”效应,离柱同轴流式 CL 检测接口对组分区带展宽的影响可以忽略。此外,与在柱或离柱式检测接口相比,柱端式检测池具有结构简单、便于操作等优点,尤其柱后无需引入 CL 试剂,解决了因柱后 CL 试剂流速不稳而导致体系稳定性和重现性下降等问题。但是,柱端式检测池发光反应时间不足10 s,光背景高,检测结果的稳定性和重现性差;可被利用的发光试剂较少。
3.5 与核磁共振仪(Nuclear magnetic resonance detector, NMR)联用
NMR是化合物结构鉴定的强有力的工具。Pusecker 等[26]设计了一套 CEC-NMR 系统,利用该系统测定了连续流和停流模式下含有对乙酰氨基酚尿液的 1D 1H NMR 和2D 1H-1H TOCSY 数据。Klaus 等[27]设计了可与CE、CEC等联用的接口装置,采用连续流和停流两种模式,尤其是停留模式可以有效避免信号峰的重叠,提高分辨率,实现了异构体、同系物组分的分离与鉴定。Petra 等[28]设计了一种仅施加电压于分离柱的缩短分析时间的联用装置。
3.6 与质谱仪(Mass spectrometry,MS)联用
MS是一种选择性高、应用面广的检测器,具有灵敏度高、准确性高等特点,而且有较强的定性能力。根据离子化操作模式的不同,离子源可分为大气压化学离子源(Atmospheric pressure chemical ionization, APCI)、连续流动快速原子轰击源(Continuous flow fast atom bombardment, CFFAB)、电喷雾离子源(Electrospray ionization, ESI)等。
将 CEC柱效高、样品试剂用量少等特点与 MS 能提供精确分子量和结构信息、灵敏度高以及专属性强等功能相结合,接口技术是关键,目前有在线联用和离线联用两种模式。CEC-MS离线联用的关键是对已分离样品的有效收集,并不涉及真正意义上的联用接口技术。与离线联用相比,CEC-MS在线联用具有样品损失少、自动化程度高、分析速度快等优点,其应用要比离线联用广泛。CEC-MS 在线联用需要设计合适的接口,能够将已分离的样品全部转移到质谱仪中,同时实现样品快速高效的离子化。下面对 CEC-MS联用进行介绍。
CFFAB-MS提供了一种液相分离与 FAB-MS 相连的方式。在首个 CEC和CFFAB-MS相连的离子源中,同轴 CFFAB 探针适合纳流分离[29~31]。CEC-CFFAB-MS 接口的主要优势是能够以高灵敏度和低检出限分离和检测不同极性分子的 \[M+H\]+或 \[M-H\] 离子,劣势是化学背景较高,特别是在m/z<400的情况下。
与 ESI 相比,APCI 离子化效率高,样品分子在ESI 中的绝对离子化效率只有0.01%~0.1%,而 APCI 离子化的起始离子化效率几乎是100%。但是,现实中由于制备 CEC-APCI-MS 相连的毛细管重现性差,造成 CEC-APCI-MS 接口应用较少。Norton 等[32]设计了在线联用的 CEC-ESI-MS 和 CEC-APCI-MS,并用于甜菜碱型和两性离子表面活性剂的分析。与ESI相比,APCI 的检出限更低,相差3个数量级。Cheng 等[33]利用CEC-APCI-MS装置,通过简单进样和在线富集测定海产品中16种多环芳烃,检出限均低于50 ng/g。CEC-ESI-MS 接口有3种:(1)无鞘流接口;(2)同轴鞘流接口;(3)液接接口。无鞘流接口中不使用鞘流液,通过喷雾毛细管的尖端镀金属来形成电接触。直接电极接口也是一种特殊类型的无鞘流接口,将金导线放置在毛细管出口处来实现电接触,这种类型的接口克服了鞘流接口的区带稀释问题[34,35]。由于难以改变离子化程度来增加 ESI-MS 的灵敏度和尖端镀金处的不稳定型,非鞘流接口通常用于低流速离子源或纳喷源。鞘流接口技术[36]优点在于通过提高样品流速使得喷雾更加稳定,有利于形成稳定的电流回路,同时可改变 CEC 运行缓冲液的组成,使其满足 ESI 源的检测要求,但灵敏度和重现性比较差。另外鞘液的引入会稀释样品,使检测灵敏度下降。Masaru等[37]应用同轴 CEC-ESI-MS分析了肝细胞癌中带电和电中性物质,检出33个峰,鉴定了18种化合物。液接接口利用三通建立电接触并为缓冲液提供额外的液流,毛细管色谱柱和喷针处于三通中相对的位置。D′Orazio等[38]运用液接纳流 ESI 接口搭建了 CEC-ESI-MS 平台用于分析杀虫剂和药物异构体。他们又设计了一种 T 形聚合物的 CEC 与 MS 的压力微流接口[39],该接口价格低,尺寸小,易于使用。Simpson 等[40]构建了CEC 与离子阱 TOF-MS 相连的两步激光 MS 接口,塔板数平均可达到每米94000,萘的检出限为500 nmol/L。
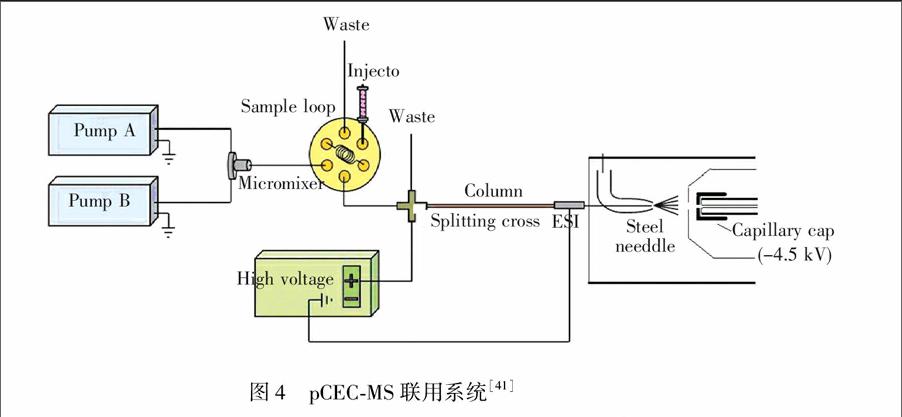
闫超等[41]设计了pCEC-ESI-MS联用系统包括二元梯度微流液相泵、六通进样阀、四通分流阀、±18 kV高压电源,以及毛细管流通池支架。样品被注入到一个外部的进样环,然后随流动相流经四通阀,经四通阀分流后,样品随流动相进入毛细管柱。毛细管柱的入口端连接到四通阀的一个接口,可以施加正电压或负电压,而柱末端通过零死体积的不锈钢两通连接到质谱的电喷雾源,并通过该不锈钢两通接地。为了避免高电压对液相泵的影响,两个泵头也通过导线接地。结构见图4。Wu 等[42]运用该装置进行了肺癌尿液代谢组学研究,pCEC独特的分离机制使得该系统获得了很高的分离效率,并鉴定了一些特殊的代谢产物,如可将谷氨酰胺结合物的质谱碎片峰和共流出峰区分开。结果表明,pCEC-ESI-MS方法将会在未来的代谢组学研究中发挥重要作用。
3.7 蒸发光散射检测器(Evaporative light-scattering detector, ELSD)
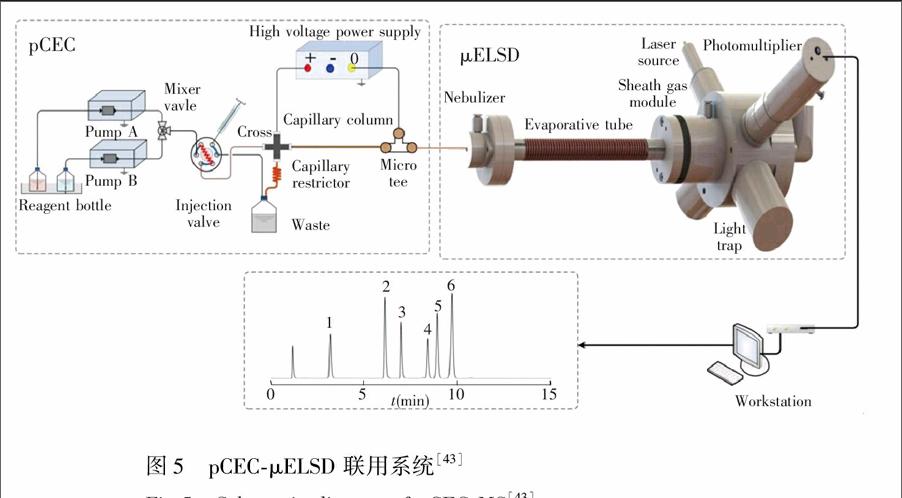
ELSD检测器是一种通用型质量检测器,主要基于将色谱柱洗脱液雾化形成气溶胶,然后在加热的漂移管中将溶剂蒸发,剩余不挥发性溶质颗粒在光散射检测池中得到检测。ELSD具有很高的通用性,不受检测物质本身结构的限制,适用于绝大多数不挥发和半挥发物质的分析检测,尤其适用于氨基酸、糖类、脂类等化合物的分析。经研究发现,ELSD检测器对峰展宽的影响很小,因此非常适用于微分离技术。周文莉等[43]自主开发研制了一种微型ELSD检测器(μELSD)(图5),对常规ELSD的雾化、蒸发及检测部分进行了整体微型化设计,可以实现与电动微分离技术的联用,分离检测了3种常见甜味剂,体现了分析时间短、溶剂消耗量少、样品需求量小的优点。利用pCEC-μELSD联用技术测定了川贝枇杷糖浆中桔梗皂苷D、贝母辛、齐墩果酸、西贝素、贝母甲素和贝母乙素6种有效成分的含量,线性范围达4个数量级,检出限达 pg 级,该装置简便、快速、可靠,方法精密度、重复性和稳定性良好。高红秀等[44]利用此pCEC-μELSD联用系统,测定了中药提取物注射用血塞通(冻干)中的5种皂苷类化合物,并对其流动相体系、梯度洗脱条件、雾化载气流速、蒸发温度及施加电压等参数进行了优化,考察了系统的实用性和稳定性。
ELSD检测器是通用的质量检测器,响应值与化合物粒子的大小、形状和质量有关;溶剂的挥发消除了前溶剂峰的干扰,可进行梯度洗脱,基线平稳,分析时间短;与紫外检测器相比,检测范围宽。其缺点是流动相须采用易挥发的溶剂;使用挥发性的缓冲溶液的浓度不宜过高。
4 展 望
随着基因组学、代谢组学、蛋白组学的飞速发展,样品日益复杂化和微量化,对分析仪器提出了更高的要求。高效的微流电动分离仪器,如qCE和pCEC,以其优越的性能可以实现快速、稳定、高效的分离,满足当前复杂和微量化样品的分析需求;其次是各种检测仪的配备,是适应不同类型样品分离的关键。如LIF适用于痕量样品,ELSD具有通用性,而质谱仪可以给出分子量和结构信息,具有极强的定性能力。总之,高效的微流电动分离仪器和各种不同检测仪的联用将为科技工作者提供一种全新的手段,也为未来生物医药、生命科学、食品安全和环境保护等领域的发展提供有力的保障。
References
1 Miguel D I G. Trends Anal. Chem., 2010, 29(7): 577
2 Javier M, Salvador G, Miguel D I G. Trends Anal. Chem., 2010, 29(7): 578-591
3 Hai Y X, You Z H. Trends Anal. Chem., 2010, 29(7): 629-635
4 Yan C. Contemporary Microscale Separation Technology. New York: HNB Publishing, 2013
5 Acevska J, Stefkov G, Petkovska R. Anal. Bioanal. Chem., 2012, 403(4): 1117-1129
6 Aturki Z, D′Orazio G, Rocco A, Fanali S. Electrophoresis, 2011, 32(9): 2602-2608
7 Zhao J, Hu D J, Lao K, Yang Z M, Li S P. Electrophoresis, 2014, 35(1): 205-224
8 YAN Chao, YAO Dong, XU Yuan, LING Bang-Zan. China Patent, CN 201420538174, 2014
阎 超, 姚 冬, 徐 媛, 凌邦瓒. 中国专利, CN201420538174, 2014
9 Dorothee W, Karin C, Volker S. Electrophoresis, 2001, 22(12): 2600-2605
10 WANG Xiao-Xi, WANG Yan, LI Jing, RU Xin YAN Chao. Science and Technology of Food Industry, 2015, 36(9): 273-277
王晓曦, 王 彦, 李 静, 茹 鑫, 闫 超. 食品工业科技, 2015, 36(9): 273-277
11 Emily F H, Andreas J Z, Miroslav M, Paul R H. Electrophoresis, 2001, 22(7): 1273-1281
12 Chena X J, Zhao J, Meng Q, Li S P, Wang Y T. J. Chromatogr. A, 2009, 1216(43): 7329-7335
13 Yan C, Dadoo R, Zhao H. Anal. Chem., 1995, 67(13): 2026-2029
14 Rebscher H, PyellU. J. Chromatogr. A, 1996, 737(2): 171-180
15 YAN Chao, RU Xin, WAN Qing-Yun, WANG Yu-Hong, YAO Fan, YAO Dong. China Patent CN104483297A, 2014
阎 超, 茹 鑫, 万青云, 王玉红, 姚 凡, 姚 冬. 中国专利, CN104483297A, 2014
16 WAN Qing-Yun, RU Xin, WANG Xiao-Xi, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2015, 43(7): 1063-1068
万青云, 茹 鑫, 王晓曦, 王 彦, 闫 超. 分析化学, 2015, 43(7) : 1063-1068
17 Abdelkader H, John H T L. Electrophoresis, 2000, 21(7): 1395-1404
18 Liu S F, Wu X P, Xie Z H, Lin X C, Guo L Q, Yan C, Chen G N. Electrophoresis, 2005, 26(12)2342-2350
19 Liu S F, Zhang X, Lin X C Wu X P, Fu F F, Xie Z H. Electrophoresis, 2007, 28(11): 1696-1703
20 Wu M W, YuanX W, Wu X H, Lin X C, Xie Z H. Electrophoresis, 2010, 31(6): 1011-1018
21 Lu L X, Chen Y K, Yu X W, Wu X H, Tang F X, Wu X P. Electrophoresis, 2013, 34(14): 2049-2057
22 Li H J, Liu X Q, Niu W X, Zhu S Y, Fan L S, Shi L H, Xu G B. Electrophoresis, 2008, 29(22): 4475-4481
23 Lin Z, Xie Z H, Lu H X, Lin X C, Wu X P, Chen G N. Anal. Chem., 2006, 78(15): 5322-5328
24 Thanh D M, Hung V P, Peter C H. Anal. Chim. Acta., 2009, 653(2): 228-233
25 Lin Z, Lin J, Wu X P, Lin X C, Xie Z H. Electrophoresis, 2008, 29(2): 401-409
26 Pusecker K, Schewitz J, Gfrorer P, Tseng L H, Albert K. Anal. Commun., 1998, 35(7): 213-215
27 Klaus P, Jens S, Petra G, Li H T, Klaus A, Ernst B. Anal. Chem., 1998, 70(15): 3280-3285
28 Petra G, Li-H T, Erdmann R, Klaus A, Ernst B. Anal. Chem., 2001, 73(14): 3234-3239
29 Deterding L J, Moseley M A, Tomer K B, Jorgenson J W. Anal. Chem., 1989, 61(22): 2504-2511
30 Moseley M A, Deterding L J, Tomer K B, Jorgenson J W. J. Chromatogr. A , 1989, 480: 197- 209
31 Moseley M A, Deterding L J, Tomer K B, Jorgenson J W. Anal. Chem., 1991, 63(141): 467-1473
32 Norton D, Zheng J, Danielson N D, Shamsi S A. Anal. Chem., 2005, 77(21): 6874-6886.
33 Cheng Y J, Huang S H, Chiu J Y, Liu W L, Huang H Y. J. Chromatogr. A , 2013, 1313(SI): 132-138
34 Lord G A, Gordon D B, Myers P, King B W. J. Chromatogr. A, 1997, 768(1): 9-16
35 J. Fred Banks. Electrophoresis, 1997, 18(12-13)2: 255-2266
36 Gargi C, Csaba H, Fred B. J. Chromatogr. A, 1998, 828(1-2): 469-480
37 Masaru K, Yuko O, Masashi S, Masakuni D, Toshimasa T. J. Chromatogr. A, 2009, 1216(47): 8277-8282
38 D′Orazio G, Fanali S. J. Chromatogr. A, 2010, 1217(25): 4079-4086
39 D′Orazio G, Fanali S. J. Chromatogr. A, 2013, 1317(SI) : 67-76
40 Simpson D C, Yates A J, Knox J H, Smith L. Int. J. Mass Spectrom., 2014, 363: 8-15
41 YAN Chao, CHEN Chang-Gong, WANG Yan, GU Xue, WU Qian, YU Xin-Wei, PAN Zhe-Min, HOU Yu-Jie. China Patent, ZL20425422.9, 2014
闫 超, 陈长功, 王彦, 谷 雪, 吴 谦, 余欣尉, 潘喆敏, 侯玉洁. 中国专利, ZL 2 0425422.9, 2014
42 Wu Q, Yu X W, Wang Y, Gu X, Ma X Q, Lv W, Chen Z, Yan C. Electrophoresis, 2014, 35(17): 2470-2478
43 ZHOU Wen-li, KAN Wen-bin, WANG Yu-hong, ZHANG Lin, WANG Yan, YAN Chao. Journal of Instrumental Analysis, 2015, 34(3): 321 -327
周文莉, 阚文彬, 王玉红, 张 琳, 王 彦, 阎 超. 分析测试学报, 2015, 34(3): 321-327
44 GAO Hong-Xiu, ZHOU Wen-Li, WANG Yu-Hong, LI Peng, GU Xue, WANG Yan, LI Jing, YAN Chao. Chinese J. Anal. Chem., 2014, 42(5): 766-772
高红秀, 周文莉, 王玉红, 李 鹏, 谷 雪, 王 彦, 闫 超. 分析化学, 2014, 42(5): 766-772



摘 要 电动微分离技术是一门近年来快速发展的技术,主要包括毛细管电泳(Capillary electrophoresis, CE)和毛细管电色谱(Capillary electrochromatography, CEC)。该技术凭借高效、快速、环境友好等特点获得了广泛的关注。早期电动微分离技术存在重现性差、定量受限及联用检测器类型有限等缺点,发展缓慢。针对这些问题,多种形式的仪器结构改造及新型检测器的研发成为电动微分离技术的研究趋势。本文主要就近年来电动微分离技术在仪器结构改造及检测器研发方面进行了系统综述,希望能够为电动微分离技术的使用提供一定的指导。
关键词 电动微分离技术; 定量毛细管电泳; 加压毛细管电色谱; 综述
1 引 言
近年来,随着社会的发展和进步,食品药品质量控制及环境监控的要求不断提高,对微流试剂和低毒试剂技术来替代传统的需要消耗大量试剂的分析技术的需求更加迫切[1,2]。同时,随着生命科学在全球的兴起,样品的贵重化和微量化也显得尤为突出,现有的很多分析手段已经无法满足科技工作者对痕量样品的高效、快速的分析要求,需要具有更高分辨率、更快分离速度和更高灵敏度的分析技术及仪器[3]。因此,发展更加高效环保的微分离技术便成为大趋势[4]。电动微分离技术,如毛细管电泳(Capillary electrophoresis, CE)和毛细管电色谱(Capillary electrochromatography, CEC)技术等,引起了人们越来越多的关注[5~7]。这类技术具有高效、快速及环境友好等优势,但由于传统电动微分离技术存在重现性差、定量受限及联用检测器类型有限等缺点,它们的应用领域及应用范围受到了很大的限制。近年来,为了提高和拓展这类电动微分离技术的性能及应用范围,科研工作者投入了大量的精力对仪器结构进行了改造并开发了多种新型检测器。
本文将针对近年来电动微分离技术在仪器结构改造及检测器开发进行系统综述,期望能够为电动微分离技术的使用及发展提供指导。
2 仪器结构改进
传统的电动微分离仪器主要由进样装置、微流溶剂输送装置、微流控制装置、高压电源、毛细管柱、检测器等组成,各个部件均需要通过不断地优化和改进,才能使得电动微分离技术呈现出高柱效、高分辨率、高选择性及快速分离的优势。近年来,为了进一步提高微电动分离技术的稳定性、精密度、灵敏度和实用性,新型高精度定量进样装置、自动进样装置、微流控制方式以及毛细管柱控温系统的研发都获得了长足进展。
2.1 全自动高精度定量毛细管电泳
CE仅依靠电渗流(Electroosmotic flow, EOF)的驱动来进行离子型物质的分离,中性物质无法得到分离。而且传统的“蘸取式”进样方法无法进行定量分析。闫超等[8]研制了全自动高精度定量毛细管电泳仪(Quantitative capillary electrophoresis, qCE),结构如图1。该设备既能和UV联用,也能与LIF等检测器联用, 并具有如下优点:(1) 自动进样器通过10 nL的定量阀实现系统的准确定量,与液流分配系统的协作运行实现了该系统从取样、进样、冲洗管路以及毛细管预处理等过程的全面自动化。自动进样过程也极大地提高了分析时间的重现性。(2) 自主研制的柱温箱,可实现4℃~40℃范围的控温。有效降低了焦耳热的影响,改善该系统的定量重复性和分离效率。(3) 成功引入电隔离槽装置,将定量阀隔离于电场之外,提高了系统的安全性、可靠性和稳定性。并用该系统进行了胞嘧啶、脱氧尿苷、腺苷、尿嘧啶、尿苷及肌苷这6种核苷及碱基类物质的分析,保留时间的相对标准偏差(RSD)<0.6%,峰面积的RSD在0.5%~3%之间,表明该系统改善了传统电泳的痼疾,定性和定量分析重复性可达到FDA的要求,分析结果准确可靠。
2.2 加压毛细管电色谱
毛细管电色谱(CEC)是依靠电渗流(Electroosmotic flow, EOF) 的推动力和两相间分配系数的不同分离极性和中性物质,但在分析过程中容易发生干柱和气泡现象。为了克服传统CEC的缺陷,引入了液相色谱溶剂输送模块,提出了加压毛细管电色谱(Pressurized capillary electrochromatography, pCEC)的概念。pCEC采用了压力流和电渗流的双驱动,柱效介于HPLC和CEC之间[9]。Yan 等推出了TriSepTM-2000系统,实现了pCEC与紫外检测器的联用,它通过两个微流泵来输送溶液并且经过混合阀混合,在毛细管色谱柱进样端提供一定的压力,二元微流泵系统可由程序来控制其中两种流动相的混合比例,完成溶剂的梯度洗脱。整个系统由于有压力和电压两个参数共同作用来调节分离,拓宽了它的分离能力和应用范围,使其能被用在分析复杂样品的领域。
最近,该研究组又推出了一款新型Trisep-2100 pCEC 系统(图2),其对高效微流电色谱体系进行了柱温箱、四通的优化及纳升级旋转进样阀的使用,进一步提升了pCEC进样的准确度。采用该系统进行了植物油中没食子酸丙酯、叔丁基对苯二酚、丁基羟基茴香醚、二叔丁基对甲酚4种抗氧剂的测定[10],8 min实现分离,样品的加标回收率在93.5%~108.0%之间,RSD为0.3%~1.3%,结果稳定可靠。
3 联用检测器的研究进展
近年来,各类电动微分离技术凭借高效、快速、溶剂及样品消耗少等优势获得了广泛的关注和发展,但是其本身固有的一些不足,如毛细管色谱柱内径窄小、检测灵敏度低、样品检测种类受限等,使得研制开发新型高效的各类检测器成为必然的发展趋势。据统计,目前已发展的电动微分离仪器联用检测器主要包括:紫外-可见吸收检测器(UV/Vis)、激光诱导荧光检测器(LIF)、电化学检测器(ECD)、化学发光检测器(CL)、与核磁共振仪(NMR)联用、与质谱仪(MS)联用、微型蒸发光检测器(μELSD)等。下面将分类进行介绍:
3.1 紫外-可见吸收检测器 (Ultraviolet/ visible absorption detector, UV/Vis)
UV/Vis吸收检测器结构简单,灵敏度高、噪音低、线性范围宽,具有很好的适用性,是电动微分离技术最常用的一种检测器。但UV/Vis只适合具有紫外或可见光吸收基团的物质,对紫外吸收差的化合物灵敏度低,检出限一般为106 mol/L。UV/Vis检测器满足不了痕量分析的要求。为了提高电动微分离技术的检测灵敏度,可以采用优化检测波长、直接激光诱导荧光柱上检测、紫外光催化触发化学反应检测[11,12]等手段。
3.2 激光诱导荧光检测器(Laser induced fluorescence detector, LIF)
LIF检测器最早于上世纪70年代提出,是目前检测灵敏度最高的一种检测器,在超痕量检测和快速分离中具有显著优势。1995年,Yan等[13]首次将CEC与LIF联用,使用257 nm的氩离子激光源,快速分离测定了16种痕量多环芳烃,柱效高达6×105塔板数/m。Rebscher 等[14]考察了“柱上”与“在柱”两种不同方式,前者在检出限和区带宽度效果要优于后者。虽然经历了半个多世纪的发展,激光波长的选择和检测窗口校准等方面的仍有很大的局限,这在一定程度上限制了LIF检测器的应用范围。为了解决这个问题,闫超等[15]又研制了一种可变波长的新型LIF检测器(图3),有4个波长(375, 473, 561和638 nm)可供选择。利用半导体光纤激光器,设计了一种激光准直及位置可视化校准装置,实现了激光源位置、二向色镜和滤光片组的方便更换,提高了新型LIF检测器的重复性和安全性,大大拓展了其应用范围。结合这种新型可变波长LIF检测器,采用pCEC系统,成功实现了花生酱样品中4种黄曲霉毒素的分离检测,验证了这种可变波长LIF检测器的实用性及可靠性[16]。
与紫外检测器相比,LIF检测器的适用范围较窄; 影响分析灵敏度的因素较多,例如荧光淬灭、背景荧光等。
3.3 电化学检测器 (Electrochemical detector, ECD)
ECD检测器的原理是化合物被氧化或还原能产生正比于待测化合物浓度的电流,一般在特殊情况下使用,主要用于测定化学性质不稳定的离子,通常只有容易氧化或还原的电活性物质才可被检测,有高含量的氯化物、硫酸盐共存时,其它离子的检测也不受干扰,选择性非常高。而且还是一类灵敏度较高的检测器。检出限可达pg~ng 级,适合复杂体系(如体液、神经递质、组织匀浆等)的电活性物质的检测。安培检测器 (Amperometric detector, AD) 是基于在电极表面上发生氧化或还原反应产生电流响应与其电活性物质浓度成比例而建立的, AD 是与CEC联用中最常使用的检测器。根据有无隔离电场,分为离柱和在柱检测两种方式。Abdelhader等[17]首次进行了 CEC-AD 联用实验。Liu 等[18]构建了柱端式 pCEC-ED 系统,研制了自对准式电化学检测池,能自动实现电极和毛细管出口的对准操作,极大地提高了实验效率和重现性。Liu等[19]开发了一种 pCEC 在柱末端与 AD 相连接,在7 min内可以快速高效的分离辣椒中添加的4种苏丹红染料。通过对系统进行改进,分离出鸡蛋和牛奶等样品中的5种酚类雌激素、氯酚、苯酚[20,21]。Li 等[22]进行了联吡啶钌电化学电极联用,在 pH 3.5~7.0范围内,可使脯氨酸、腐胺、精胺、亚精胺达到基线分离,检出限均低于2.0 μmol/L。Lin 等[23]开发了 pCEC 与化学发光检测器柱上联用,通过在碱性溶液中鲁米诺与过氧化氢在电极上形成的Cu2+-氨基酸络合物的增强效应来进行氨基酸的分离,可使L-组氨酸、L-苏氨酸、L-络氨酸达到基线分离。Thanh 等[24]进行了 CEC-柱上非接触电导检测器联用进行非 UV 吸收样品的检测和定性工作,可在10 min内分离12种氨基酸。
安培检测器的灵敏度高,检出限可达10~1012 g; 线性范围较宽,一般为104~105。但是其选择性受到限制,通常只对电活性物质有响应;对流动相的温度、速度、pH 值等因素的变化比较敏感,其中溶解的氧会干扰测定;使用中,电极需经常清洗和更换。
3.4 化学发光检测器(Chemiluminescence detector, CL)
CL检测器的光学系统由反应池、检测器和读数装置3部分组成,结果简单,无需外加光源和分光系统,背景噪声低,避免了杂散光和光源不稳定性的影响,因而具有很高的检测灵敏度(10~10-10 mol/L)。化学发光检测器具有“化学窄带”效应,即在样品充分扩散到本底溶液前就已产生化学发光信号,适合于小体积在线快速检测,不会造成明显的区带展宽。但CL选择性较差,为了得到理想的分离效果和灵敏度及获得稳定的分析体系,需首先考察待测物和CL 试剂的混合模式以及检测体积,其次是用于分离的缓冲液与CL 试剂 pH 值的兼容性及混合流体的稳定性。一般首选柱后混合模式,因其能确保分离后组分在检测区域仍能保持较好的分离环境。柱后流体混合接口装置可分为合并流式、同轴流式、和贮液池式等。根据检测区与分离电压提供区是否隔离,接口装置又可分为在柱式、离柱式和柱端式等。Lin 等[25]设计了离柱同轴流式的 μHPLC/pCEC-CL 系统,通过分离鲁米诺和 N-4-氨基丁基-N-乙基异鲁米诺,结果表明, 由于“化学窄带”效应,离柱同轴流式 CL 检测接口对组分区带展宽的影响可以忽略。此外,与在柱或离柱式检测接口相比,柱端式检测池具有结构简单、便于操作等优点,尤其柱后无需引入 CL 试剂,解决了因柱后 CL 试剂流速不稳而导致体系稳定性和重现性下降等问题。但是,柱端式检测池发光反应时间不足10 s,光背景高,检测结果的稳定性和重现性差;可被利用的发光试剂较少。
3.5 与核磁共振仪(Nuclear magnetic resonance detector, NMR)联用
NMR是化合物结构鉴定的强有力的工具。Pusecker 等[26]设计了一套 CEC-NMR 系统,利用该系统测定了连续流和停流模式下含有对乙酰氨基酚尿液的 1D 1H NMR 和2D 1H-1H TOCSY 数据。Klaus 等[27]设计了可与CE、CEC等联用的接口装置,采用连续流和停流两种模式,尤其是停留模式可以有效避免信号峰的重叠,提高分辨率,实现了异构体、同系物组分的分离与鉴定。Petra 等[28]设计了一种仅施加电压于分离柱的缩短分析时间的联用装置。
3.6 与质谱仪(Mass spectrometry,MS)联用
MS是一种选择性高、应用面广的检测器,具有灵敏度高、准确性高等特点,而且有较强的定性能力。根据离子化操作模式的不同,离子源可分为大气压化学离子源(Atmospheric pressure chemical ionization, APCI)、连续流动快速原子轰击源(Continuous flow fast atom bombardment, CFFAB)、电喷雾离子源(Electrospray ionization, ESI)等。
将 CEC柱效高、样品试剂用量少等特点与 MS 能提供精确分子量和结构信息、灵敏度高以及专属性强等功能相结合,接口技术是关键,目前有在线联用和离线联用两种模式。CEC-MS离线联用的关键是对已分离样品的有效收集,并不涉及真正意义上的联用接口技术。与离线联用相比,CEC-MS在线联用具有样品损失少、自动化程度高、分析速度快等优点,其应用要比离线联用广泛。CEC-MS 在线联用需要设计合适的接口,能够将已分离的样品全部转移到质谱仪中,同时实现样品快速高效的离子化。下面对 CEC-MS联用进行介绍。
CFFAB-MS提供了一种液相分离与 FAB-MS 相连的方式。在首个 CEC和CFFAB-MS相连的离子源中,同轴 CFFAB 探针适合纳流分离[29~31]。CEC-CFFAB-MS 接口的主要优势是能够以高灵敏度和低检出限分离和检测不同极性分子的 \[M+H\]+或 \[M-H\] 离子,劣势是化学背景较高,特别是在m/z<400的情况下。
与 ESI 相比,APCI 离子化效率高,样品分子在ESI 中的绝对离子化效率只有0.01%~0.1%,而 APCI 离子化的起始离子化效率几乎是100%。但是,现实中由于制备 CEC-APCI-MS 相连的毛细管重现性差,造成 CEC-APCI-MS 接口应用较少。Norton 等[32]设计了在线联用的 CEC-ESI-MS 和 CEC-APCI-MS,并用于甜菜碱型和两性离子表面活性剂的分析。与ESI相比,APCI 的检出限更低,相差3个数量级。Cheng 等[33]利用CEC-APCI-MS装置,通过简单进样和在线富集测定海产品中16种多环芳烃,检出限均低于50 ng/g。CEC-ESI-MS 接口有3种:(1)无鞘流接口;(2)同轴鞘流接口;(3)液接接口。无鞘流接口中不使用鞘流液,通过喷雾毛细管的尖端镀金属来形成电接触。直接电极接口也是一种特殊类型的无鞘流接口,将金导线放置在毛细管出口处来实现电接触,这种类型的接口克服了鞘流接口的区带稀释问题[34,35]。由于难以改变离子化程度来增加 ESI-MS 的灵敏度和尖端镀金处的不稳定型,非鞘流接口通常用于低流速离子源或纳喷源。鞘流接口技术[36]优点在于通过提高样品流速使得喷雾更加稳定,有利于形成稳定的电流回路,同时可改变 CEC 运行缓冲液的组成,使其满足 ESI 源的检测要求,但灵敏度和重现性比较差。另外鞘液的引入会稀释样品,使检测灵敏度下降。Masaru等[37]应用同轴 CEC-ESI-MS分析了肝细胞癌中带电和电中性物质,检出33个峰,鉴定了18种化合物。液接接口利用三通建立电接触并为缓冲液提供额外的液流,毛细管色谱柱和喷针处于三通中相对的位置。D′Orazio等[38]运用液接纳流 ESI 接口搭建了 CEC-ESI-MS 平台用于分析杀虫剂和药物异构体。他们又设计了一种 T 形聚合物的 CEC 与 MS 的压力微流接口[39],该接口价格低,尺寸小,易于使用。Simpson 等[40]构建了CEC 与离子阱 TOF-MS 相连的两步激光 MS 接口,塔板数平均可达到每米94000,萘的检出限为500 nmol/L。
闫超等[41]设计了pCEC-ESI-MS联用系统包括二元梯度微流液相泵、六通进样阀、四通分流阀、±18 kV高压电源,以及毛细管流通池支架。样品被注入到一个外部的进样环,然后随流动相流经四通阀,经四通阀分流后,样品随流动相进入毛细管柱。毛细管柱的入口端连接到四通阀的一个接口,可以施加正电压或负电压,而柱末端通过零死体积的不锈钢两通连接到质谱的电喷雾源,并通过该不锈钢两通接地。为了避免高电压对液相泵的影响,两个泵头也通过导线接地。结构见图4。Wu 等[42]运用该装置进行了肺癌尿液代谢组学研究,pCEC独特的分离机制使得该系统获得了很高的分离效率,并鉴定了一些特殊的代谢产物,如可将谷氨酰胺结合物的质谱碎片峰和共流出峰区分开。结果表明,pCEC-ESI-MS方法将会在未来的代谢组学研究中发挥重要作用。
3.7 蒸发光散射检测器(Evaporative light-scattering detector, ELSD)
ELSD检测器是一种通用型质量检测器,主要基于将色谱柱洗脱液雾化形成气溶胶,然后在加热的漂移管中将溶剂蒸发,剩余不挥发性溶质颗粒在光散射检测池中得到检测。ELSD具有很高的通用性,不受检测物质本身结构的限制,适用于绝大多数不挥发和半挥发物质的分析检测,尤其适用于氨基酸、糖类、脂类等化合物的分析。经研究发现,ELSD检测器对峰展宽的影响很小,因此非常适用于微分离技术。周文莉等[43]自主开发研制了一种微型ELSD检测器(μELSD)(图5),对常规ELSD的雾化、蒸发及检测部分进行了整体微型化设计,可以实现与电动微分离技术的联用,分离检测了3种常见甜味剂,体现了分析时间短、溶剂消耗量少、样品需求量小的优点。利用pCEC-μELSD联用技术测定了川贝枇杷糖浆中桔梗皂苷D、贝母辛、齐墩果酸、西贝素、贝母甲素和贝母乙素6种有效成分的含量,线性范围达4个数量级,检出限达 pg 级,该装置简便、快速、可靠,方法精密度、重复性和稳定性良好。高红秀等[44]利用此pCEC-μELSD联用系统,测定了中药提取物注射用血塞通(冻干)中的5种皂苷类化合物,并对其流动相体系、梯度洗脱条件、雾化载气流速、蒸发温度及施加电压等参数进行了优化,考察了系统的实用性和稳定性。
ELSD检测器是通用的质量检测器,响应值与化合物粒子的大小、形状和质量有关;溶剂的挥发消除了前溶剂峰的干扰,可进行梯度洗脱,基线平稳,分析时间短;与紫外检测器相比,检测范围宽。其缺点是流动相须采用易挥发的溶剂;使用挥发性的缓冲溶液的浓度不宜过高。
4 展 望
随着基因组学、代谢组学、蛋白组学的飞速发展,样品日益复杂化和微量化,对分析仪器提出了更高的要求。高效的微流电动分离仪器,如qCE和pCEC,以其优越的性能可以实现快速、稳定、高效的分离,满足当前复杂和微量化样品的分析需求;其次是各种检测仪的配备,是适应不同类型样品分离的关键。如LIF适用于痕量样品,ELSD具有通用性,而质谱仪可以给出分子量和结构信息,具有极强的定性能力。总之,高效的微流电动分离仪器和各种不同检测仪的联用将为科技工作者提供一种全新的手段,也为未来生物医药、生命科学、食品安全和环境保护等领域的发展提供有力的保障。
References
1 Miguel D I G. Trends Anal. Chem., 2010, 29(7): 577
2 Javier M, Salvador G, Miguel D I G. Trends Anal. Chem., 2010, 29(7): 578-591
3 Hai Y X, You Z H. Trends Anal. Chem., 2010, 29(7): 629-635
4 Yan C. Contemporary Microscale Separation Technology. New York: HNB Publishing, 2013
5 Acevska J, Stefkov G, Petkovska R. Anal. Bioanal. Chem., 2012, 403(4): 1117-1129
6 Aturki Z, D′Orazio G, Rocco A, Fanali S. Electrophoresis, 2011, 32(9): 2602-2608
7 Zhao J, Hu D J, Lao K, Yang Z M, Li S P. Electrophoresis, 2014, 35(1): 205-224
8 YAN Chao, YAO Dong, XU Yuan, LING Bang-Zan. China Patent, CN 201420538174, 2014
阎 超, 姚 冬, 徐 媛, 凌邦瓒. 中国专利, CN201420538174, 2014
9 Dorothee W, Karin C, Volker S. Electrophoresis, 2001, 22(12): 2600-2605
10 WANG Xiao-Xi, WANG Yan, LI Jing, RU Xin YAN Chao. Science and Technology of Food Industry, 2015, 36(9): 273-277
王晓曦, 王 彦, 李 静, 茹 鑫, 闫 超. 食品工业科技, 2015, 36(9): 273-277
11 Emily F H, Andreas J Z, Miroslav M, Paul R H. Electrophoresis, 2001, 22(7): 1273-1281
12 Chena X J, Zhao J, Meng Q, Li S P, Wang Y T. J. Chromatogr. A, 2009, 1216(43): 7329-7335
13 Yan C, Dadoo R, Zhao H. Anal. Chem., 1995, 67(13): 2026-2029
14 Rebscher H, PyellU. J. Chromatogr. A, 1996, 737(2): 171-180
15 YAN Chao, RU Xin, WAN Qing-Yun, WANG Yu-Hong, YAO Fan, YAO Dong. China Patent CN104483297A, 2014
阎 超, 茹 鑫, 万青云, 王玉红, 姚 凡, 姚 冬. 中国专利, CN104483297A, 2014
16 WAN Qing-Yun, RU Xin, WANG Xiao-Xi, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2015, 43(7): 1063-1068
万青云, 茹 鑫, 王晓曦, 王 彦, 闫 超. 分析化学, 2015, 43(7) : 1063-1068
17 Abdelkader H, John H T L. Electrophoresis, 2000, 21(7): 1395-1404
18 Liu S F, Wu X P, Xie Z H, Lin X C, Guo L Q, Yan C, Chen G N. Electrophoresis, 2005, 26(12)2342-2350
19 Liu S F, Zhang X, Lin X C Wu X P, Fu F F, Xie Z H. Electrophoresis, 2007, 28(11): 1696-1703
20 Wu M W, YuanX W, Wu X H, Lin X C, Xie Z H. Electrophoresis, 2010, 31(6): 1011-1018
21 Lu L X, Chen Y K, Yu X W, Wu X H, Tang F X, Wu X P. Electrophoresis, 2013, 34(14): 2049-2057
22 Li H J, Liu X Q, Niu W X, Zhu S Y, Fan L S, Shi L H, Xu G B. Electrophoresis, 2008, 29(22): 4475-4481
23 Lin Z, Xie Z H, Lu H X, Lin X C, Wu X P, Chen G N. Anal. Chem., 2006, 78(15): 5322-5328
24 Thanh D M, Hung V P, Peter C H. Anal. Chim. Acta., 2009, 653(2): 228-233
25 Lin Z, Lin J, Wu X P, Lin X C, Xie Z H. Electrophoresis, 2008, 29(2): 401-409
26 Pusecker K, Schewitz J, Gfrorer P, Tseng L H, Albert K. Anal. Commun., 1998, 35(7): 213-215
27 Klaus P, Jens S, Petra G, Li H T, Klaus A, Ernst B. Anal. Chem., 1998, 70(15): 3280-3285
28 Petra G, Li-H T, Erdmann R, Klaus A, Ernst B. Anal. Chem., 2001, 73(14): 3234-3239
29 Deterding L J, Moseley M A, Tomer K B, Jorgenson J W. Anal. Chem., 1989, 61(22): 2504-2511
30 Moseley M A, Deterding L J, Tomer K B, Jorgenson J W. J. Chromatogr. A , 1989, 480: 197- 209
31 Moseley M A, Deterding L J, Tomer K B, Jorgenson J W. Anal. Chem., 1991, 63(141): 467-1473
32 Norton D, Zheng J, Danielson N D, Shamsi S A. Anal. Chem., 2005, 77(21): 6874-6886.
33 Cheng Y J, Huang S H, Chiu J Y, Liu W L, Huang H Y. J. Chromatogr. A , 2013, 1313(SI): 132-138
34 Lord G A, Gordon D B, Myers P, King B W. J. Chromatogr. A, 1997, 768(1): 9-16
35 J. Fred Banks. Electrophoresis, 1997, 18(12-13)2: 255-2266
36 Gargi C, Csaba H, Fred B. J. Chromatogr. A, 1998, 828(1-2): 469-480
37 Masaru K, Yuko O, Masashi S, Masakuni D, Toshimasa T. J. Chromatogr. A, 2009, 1216(47): 8277-8282
38 D′Orazio G, Fanali S. J. Chromatogr. A, 2010, 1217(25): 4079-4086
39 D′Orazio G, Fanali S. J. Chromatogr. A, 2013, 1317(SI) : 67-76
40 Simpson D C, Yates A J, Knox J H, Smith L. Int. J. Mass Spectrom., 2014, 363: 8-15
41 YAN Chao, CHEN Chang-Gong, WANG Yan, GU Xue, WU Qian, YU Xin-Wei, PAN Zhe-Min, HOU Yu-Jie. China Patent, ZL20425422.9, 2014
闫 超, 陈长功, 王彦, 谷 雪, 吴 谦, 余欣尉, 潘喆敏, 侯玉洁. 中国专利, ZL 2 0425422.9, 2014
42 Wu Q, Yu X W, Wang Y, Gu X, Ma X Q, Lv W, Chen Z, Yan C. Electrophoresis, 2014, 35(17): 2470-2478
43 ZHOU Wen-li, KAN Wen-bin, WANG Yu-hong, ZHANG Lin, WANG Yan, YAN Chao. Journal of Instrumental Analysis, 2015, 34(3): 321 -327
周文莉, 阚文彬, 王玉红, 张 琳, 王 彦, 阎 超. 分析测试学报, 2015, 34(3): 321-327
44 GAO Hong-Xiu, ZHOU Wen-Li, WANG Yu-Hong, LI Peng, GU Xue, WANG Yan, LI Jing, YAN Chao. Chinese J. Anal. Chem., 2014, 42(5): 766-772
高红秀, 周文莉, 王玉红, 李 鹏, 谷 雪, 王 彦, 闫 超. 分析化学, 2014, 42(5): 766-772

