超高效液相色谱法同时鉴定育发化妆品中17种植物提取物标识成分
谭建华+李慧勇+席绍峰+郭长虹+王继才+熊小婷+冼燕萍+郭新东
摘 要 建立了同时鉴定育发化妆品中芍药苷、羟基红花黄色素A、毛蕊异黄酮葡萄糖苷、阿魏酸等17种植物提取物标识成分的超高效液相分析方法。不同基质的样品经80%甲醇溶液涡旋振荡、超声提取及NaCl法破乳后,提取液经高速离心处理。选用Waters ACUITY UPLC CSH C18反相色谱柱(50 mm×2.1 mm, 1.7 μm),以甲醇/0.05% H3PO4为流动相,梯度洗脱,然后采用二极阵列管检测器(PDA)进行测定。考察了方法的灵敏度、线性范围、回收率、日内和日间精密度。在本方法条件下,17种标识功效成分在0.2~25 mg/L的浓度范围内呈良好线性关系,相关系数均大于0.999;方法检出限为0.3~1.5 mg/kg,方法定量限为1.0~4.0 mg/kg。样品的回收率为93.5%~105.0%,日内精密度(n=6)为0.4%~4.5%,日间精密度(n=6)为0.8%~4.6%。本方法简单、快速、准确,已成功用于实际样品中17种标识功效成分的鉴定检测。
关键词 超高效液相色谱;植物提取物标识成分;育发化妆品
1 引 言
中草药类植物提取液治疗脱发是我国中医传统文化遗留的宝贵财富之一。许多研究证明,中草药植物提取液外用对于治疗脱发,特别是脂溢性脱发,疗效显著[1~4]。Seo等[3]在C57BL/6雄性小鼠背上进行生毛试验,证实侧柏、首乌、浙贝和墨西哥辣椒4种植物提取液具有生发作用。然而,随着各类新品牌的中草药育发化妆品不断出现,植物提取物概念正在不断被许多企业滥用,虚假添加植物提取物或采用低廉、易得的植物提取物为原料,欺骗消费者,甚至危害了消费者的健康。因此,亟需建立相应的标准检测方法,对植物提取物类育发化妆品进行鉴定。
本研究以市场上育发化妆品最常使用以及可能使用的17种植物提取物为鉴定目标,并依据中华人民共和国药典第一部(2010版)[5]选择1~2种与各植物药材及提取物相对应的功效化合物为标识成分,进行鉴定研究。目前,关于植物提取物类功效化合物的检测研究主要针对药液[6,7]、植物提取物[8,9]和化妆品等[10~12],然而对于育发化妆品中植物提取物标识成分的鉴定方法研究尚未见报道。由于育发化妆品, 特别是育发洗发液的产品中, 含有大量的各类表面活性剂,给样品前处理和仪器分析方法造成困难。本研究针对常见的育发洗发乳(膏)和精华液两种基质,通过优化前处理条件,比较不同的检测方法(包括二极管阵列检测和质谱检测法),建立一种简单、快速、高通量定性和定量鉴定育发化妆品中17种植物提取物标识成分的方法。
2 实验部分
2.1 仪器、试剂与材料
ACQUITYTM超高效液相色谱仪配二极阵列管检测器和Waters XevoTM TQ MS 三重四极杆串联质谱仪(美国Waters公司);Allegra 64R高速冷冻离心机(Beckman公司);MS3 basic漩涡混合器(德国IKA公司);超纯水系统(Milli-Q,美国Millipore公司)。
甲醇、乙腈(HPLC级,Spectrum公司);甲酸、磷酸(分析纯,上海安谱公司)。
17种标准品:芍药苷(PF)、羟基红花黄色素A(HYA)、毛蕊异黄酮葡萄糖苷(CG)、阿魏酸(FA)、甘草苷(LT)、何首乌苷(THS-GLU)、柚皮苷(NG)、芦丁(RT)、补骨脂素(PL)、异补骨脂素(IPL)、槲皮苷(QR)、6-姜辣素(GR)、异欧前胡素(IIPR)、欧前胡素(IPR)、天然辣椒素(CSC)、芝麻素(SM)、丹参酮ⅡA(TSN) ,纯度大于99.0%,均购自上海诗丹德生物技术有限公司。
2.2 标准溶液的配制
分别称取17种标准品10.0 mg于10 mL棕色容量瓶中,用甲醇溶解并定容,配成1 g/L的单标标准储备液,再用80%甲醇溶液将单标标准储备液配制成所需系列混合标准工作溶液,4 ℃避光保存。
2.3 样品的制备与提取
准确称取0.5 g (精确至0.001 g)试样,于10 mL具塞比色管中,用80%甲醇溶解并定容,加入1.0 g NaCl,置于漩涡振荡器上混合,使样品分散2 min,超声提取5 min,取上清液10000 r/min离心5 min, 过滤后待测。
2.4 仪器分析条件
色谱柱:CSH C18( 50 mm×2.1 mm, 1.7 μm, Waters公司);柱温:25 ℃;进样体积:5 μL;流速:0.3 mL/min; 流动相A为0.05% H3PO4溶液,流动B为甲醇。梯度洗脱:0~1 min,10% B,1~12 min,10%~100% B; 12~13 min,100% B; 13~16 min,100%~10% B。检测波长:210~400 nm,多波长定量:PF (231 nm), RT, QR(255 nm), CG, PL, IPL,IPR, IIPR (247 nm), HYA (399 nm), LT, NG, GR, CSC, SM (281 nm), FA, THS-GLU (321 nm), TSN (268 nm)。
3 结果与讨论
3.1 提取溶剂的选择
本研究选用不同浓度(V/V)的甲醇溶液(20%,30%,50%,80%,100%)为提取溶剂,以洗发膏为样品基质,进行加标回收实验。结果表明,在提取油脂或增稠剂含量较高的洗发膏时,均会产生十分明显的乳化现象,且提取液不均匀,导致大多数化合物的样品加标回收率小于50%,重现性差。因此,本研究考虑采用NaCl破乳法和亚铁氰化钾-醋酸锌溶液沉淀法,对样品溶液进行预处理。结果表明,采用亚铁氰化钾-醋酸锌溶液沉淀法,可能引起部分化合物吸附沉淀,导致回收率降低。采用NaCl破乳法,能得到较为澄清的提取液,在甲醇浓度高于80%时,所有化合物都能得到完全提取。但是,随着甲醇浓度增高,NaCl破乳所析出的油脂类物质减少,即样品进样液中的杂质过高,会在柱头累积,进而所造成进样溶剂效应增强。因此,本实验选取80%甲醇溶液为提取溶剂。
3.2 超高效液相色谱条件的优化
3.2.1 色谱柱的选择
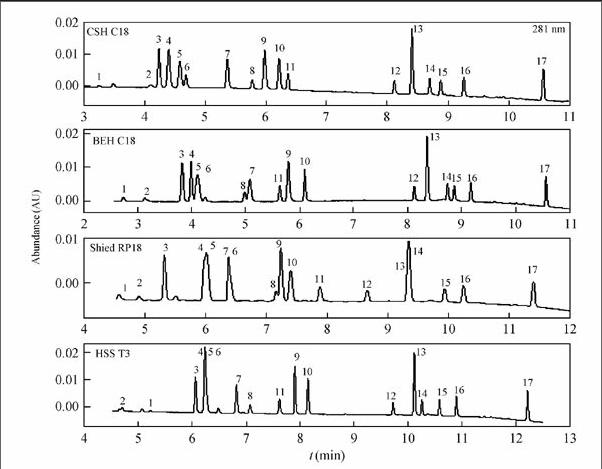
比较了4种不同填料色谱柱CSH C18(50 mm×2.1 mm, 1.7 μm), BEH C18(50 mm × 2.1 mm, 1.7 μm), HSS T3(100 mm × 2.1 mm, 1.8 μm), Shield RP18(100 mm × 2.1 mm, 1.7 μm) 的分离效果。结果表明,反相保留能力强的CSH C18和BEH C18色谱柱对于17种化合物的分离效果优于亲水色谱柱Shield RP18和HSS T3。由于CSH颗粒是在亚乙基桥杂化颗粒(BEH)基础上,在其表面控制少量电荷,因此CSH C18对于可能带电荷化合物的保留与BEH C18表现出不同的选择性,可将17种化合物进行有效分离(图1)。因此,本实验选用CSH C18为色谱柱。
3.2.2 柱温条件的选择 比较了柱温(22 ℃,25 ℃,30 ℃,40 ℃)对17种目标化合物色谱分离的影响。结果表明,柱温的变化对HYA/CG, THS-GLU/LT的色谱分离影响十分明显。随着柱温升高,THS-GLU和LT的分离度下降,但HYH和CG色谱峰的分离度增加。比较4种柱温条件下的分离效果,在柱温为25 ℃时,17种目标化合物的色谱峰均能达到基本分离。因此,本实验选用25 ℃为柱温条件。
3.2.3 检测条件的选择 比较了三重四极杆串联质谱仪(UPLC-MS/MS)和二极管阵列检测器(UPLC-PDA)两种检测方法对育发化妆品中17种中草药标识成分的检测结果。结果表明,UPLC-MS/MS虽然具有更高的灵敏度,但是由于17种化合物离子化方式不同,需采用不同的方法进行采集分析。另外,由于育发化妆品特别是育发洗发乳类产品中常添加有高含量的表面活性剂(如十二烷基硫酸铵、月桂醇聚醚硫酸酯钠等),造成目标化合物严重的基质抑制或基质增强作用, 且可能造成质谱的持续污染。因此,考虑到育发化妆品基质的特殊性,为了保证方法的简单、快速且高通量性,本研究采用UPLC-PDA检测器, 根据各个化合物的紫外吸收特性,选用多波长监测模式对17种中草药标识成分进行定量分析。
3.3 线性与方法检出限
分别配制质量浓度为0.20~25 mg/L的系列标准溶液,在本方法实验条件下,对17种中草药标识成分进行测定,根据其色谱峰面积积分值(Y)和相应的质量浓度(X, mg/L)响应关系,得线性回归方程及相关系数。结果表明,在0.20~25 mg/L范围内,17种化合物的线性关系良好,R2>0.999。本研究采用基质样品加标方法,通过计算其标样的响应与背景噪音的比值(S/N=3)确定方法检出限,得到PF, LT, NG, RT, QR, GR, CSC和SM和TSN的方法检出限为4.0 mg/kg,HYA, CG, FA和THS-GLU的方法检出限为2.0 mg/kg,PL, IPL, IIPR和IPR的方法检出限为1.0 mg/kg。
3.4 方法回收率和精密度
选用洗发膏和精华液两种空白育发化妆品为加标基质,按本实验条件进行低、中、高(4.0, 8.0, 20 mg/kg)添加水平的回收率与精密度实验。结果表明,精华液样品的回收率为93.5%~103.9%,日内精密度(n=6)和日间精密度(n=6)分别为0.4%~3.4%和0.8%~3.6%;洗发膏样品的回收率为94.0%~105.0%,日内精密度(n=6)和日间精密度(n=6)分别为0.7%~4.5%和1.2%~4.6%。表明方法具有较高的回收率,准确度和精密度良好。
3.5 实际样品的测定
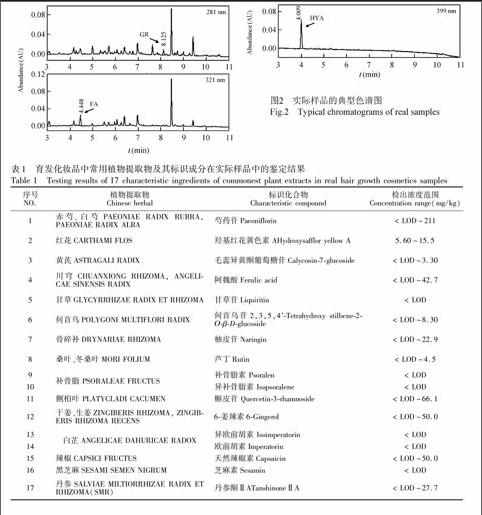
采集广东地区市售的28份植物提取物类育发化妆品,涉及17个品牌,包括标称有育发、防脱、浓发、固发等功效的产品,典型色谱图及实验结果分别见图2和表1。结果表明,标识成分的检出浓度范围在小于方法检出限(LOD)至211 mg/kg之间,大部分产品,特别是洗发产品中,植物提取物实际添加的含量较低,其标识成分浓度甚至低于方法检出限。目前市场上产品中添加植物提取物更偏重广告效应,而实际上植物提取物在育发化妆品中的功能效果有待值得进一步研究和探讨。
References
1 REN Fang, WEI Yue-Gang. Journal of Zhejiang Chinese Medical, 2012, 36(3): 350-352
任 芳, 魏跃钢. ?浙江中医药大学学报, 2012, ?36(3): 350-352
2 WANG Jian-Da, YANG En-Pin. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, ?2009, ?30(7): 69-70
王剑达, 杨恩品. 云南中医中药杂志, 2009, ?30(7): 69-70
3 Seo S R, Kang G, Ha J W, Kim J C. Journal of Industrial and Engineering Chemistry, ?2013, ?19: 1331-1339
4 Park H J, Zhang N N, Park D K. Journal of Ethnopharmacology, ?2011, ?135: 369-375
5 Pharmacopoeia Commission of People′s Republic of China. Pharmacopoeia of People′s Republic of China (Part1). Beijing: ?Chemical Industry Press, ?2010: 3-347
国家药典委员会. 中华人民共和国药典(一部). 北京: 化学工业出版社, ?2010: 3-347
6 GUO Dan, CHEN Na-Na, YANG Xi-Xiao, HOU Lian-Bing. Chinese Traditional Patent Medicine, ?2005, ?27(4): 402-404
郭 丹, 陈娜娜, 杨西晓, 侯连兵. 中成药, 2005, ?27(4): 402-404
7 XUAN Tie-Feng. China Pharmaceuticals, ?2012, ?21(18): 37-38
宣铁锋. 中国药业, 2012, ?21(18): 37-38
8 HAN Chao, YE Li-Ru, CAI Xiao-Jun, ZHU Zhen-Ou, LIU Cui-Ping, SHEN Yan. Chinese Journal of Pharmaceutical Analysis, ?2012,
32(8): 1365-1369
韩 超, 叶丽如, 蔡小军, 朱振瓯, 刘翠平, 沈 燕. 药物分析杂志, 2012, ?32(8): 1365-1369
9 FENG Ying, HE Jun, LIU Hong, WANG Tao. Lishizhen Medicine and Materia Medica Research, ?2013, ?24(3): 572-574
冯 颖, 何 俊, 刘 虹, 王 涛. 时珍国医国药, 2013, ?24(3): 572-574
10 CHEN Wei, WANG Chao, CHENG Yan, XUE Yi-Mei, ZHANG Qing. Chinese Journal of Chromatography, ?2007, ?25(5): 768-769
陈 伟, 王 超, 程 艳, 薛一梅, 张 青. 色谱, 2007, ?25(5): 768-769
11 CHEN Jie, XU Juan, XIONG Li-Hua. Chinese Journal of Chromatography, ?2011, ?29(5): 454-457
陈 捷, 徐 娟, 熊莉华. 色谱, 2011, ?29(5): 454-457
12 XIAN Yan-Ping, GUO Xin-Dong, MU Tong-Na, TAN Jian-Hua, ZHANG Yan, LUO Hai-Ying, WU Yu-Luan. Chinese Journal of Analysis Laboratory, ?2014, ?33(2): ?171-174
冼燕萍, 郭新东, 穆同娜, 谭建华, 张 岩, 罗海英, 吴玉銮. 分析试验室, 2014, 33(2): 171-174
Determination of 17 Characteristic Ingredients of Plant
Extracts in Hair Growth Cosmetics by Ultra High
Performance Liquid Chromatography
TAN Jian-Hua1,2, LI Hui-Yong1, XI Shao-Feng1,2, GUO Chang-Hong1,
WANG Ji-Cai1, XIONG Xiao-Ting1, XIAN Yan-Ping1, GUO Xin-Dong1
1(Guangzhou Products Quality Supervision and Testing Institute,
National Center for Quality Supervision and Testing of Cosmetics, Guangzhou 510110, China)
2(The College of Natural Resources and Environment of South China Agricultural University, Guangzhou 510642, China)
Abstract A method was developed for the simultaneous determination of 17 characteristic ingredients of plant extracts, including paeoniflorin, hydroxysafflor yellow A, calycosin-7-glucoside ferulic acid, etc., in hair growth cosmetics using ultra high performance liquid chromatography (UPLC). Different cosmetic samples were extracted by ultrasonic-assisted extraction with the solvent of methanol/water (4∶1, V/V) solution. After demulsified by the addition of appropriate amount of NaCl and high speed centrifugation, the supernatant was transferred and analyzed with UPLC. The separation was conducted on a Waters reversed phase column of ACQUITY UPLC CSH C18 (50 mm×2.1 mm, 1.7 μm), and the mobile phases were methanol and the solution of 0.05% phosphate in water. The detection was performed with a photodiode-array (PDA) detector. The linear range was 0.2-25 mg/L with correlation coefficients higher than 0.999. The limits of detection were within 0.3-1.5 mg/kg, and the limits of quantification were from 1.0 to 4.0 mg/kg. The average recoveries of 17 characteristic ingredients were within 93.5%-105.0%, with the intra-and inter-day precision (n=6) less than 4.6%. This method was simple, rapid, with good-repeatability, and had been applied to the analysis of real samples.
Keywords Ultra-high performance liquid chromatography; Characteristic ingredients of plant extracts; Hair growth cosmetics
(Received 16 June 2014; accepted 12 September 2014)


摘 要 建立了同时鉴定育发化妆品中芍药苷、羟基红花黄色素A、毛蕊异黄酮葡萄糖苷、阿魏酸等17种植物提取物标识成分的超高效液相分析方法。不同基质的样品经80%甲醇溶液涡旋振荡、超声提取及NaCl法破乳后,提取液经高速离心处理。选用Waters ACUITY UPLC CSH C18反相色谱柱(50 mm×2.1 mm, 1.7 μm),以甲醇/0.05% H3PO4为流动相,梯度洗脱,然后采用二极阵列管检测器(PDA)进行测定。考察了方法的灵敏度、线性范围、回收率、日内和日间精密度。在本方法条件下,17种标识功效成分在0.2~25 mg/L的浓度范围内呈良好线性关系,相关系数均大于0.999;方法检出限为0.3~1.5 mg/kg,方法定量限为1.0~4.0 mg/kg。样品的回收率为93.5%~105.0%,日内精密度(n=6)为0.4%~4.5%,日间精密度(n=6)为0.8%~4.6%。本方法简单、快速、准确,已成功用于实际样品中17种标识功效成分的鉴定检测。
关键词 超高效液相色谱;植物提取物标识成分;育发化妆品
1 引 言
中草药类植物提取液治疗脱发是我国中医传统文化遗留的宝贵财富之一。许多研究证明,中草药植物提取液外用对于治疗脱发,特别是脂溢性脱发,疗效显著[1~4]。Seo等[3]在C57BL/6雄性小鼠背上进行生毛试验,证实侧柏、首乌、浙贝和墨西哥辣椒4种植物提取液具有生发作用。然而,随着各类新品牌的中草药育发化妆品不断出现,植物提取物概念正在不断被许多企业滥用,虚假添加植物提取物或采用低廉、易得的植物提取物为原料,欺骗消费者,甚至危害了消费者的健康。因此,亟需建立相应的标准检测方法,对植物提取物类育发化妆品进行鉴定。
本研究以市场上育发化妆品最常使用以及可能使用的17种植物提取物为鉴定目标,并依据中华人民共和国药典第一部(2010版)[5]选择1~2种与各植物药材及提取物相对应的功效化合物为标识成分,进行鉴定研究。目前,关于植物提取物类功效化合物的检测研究主要针对药液[6,7]、植物提取物[8,9]和化妆品等[10~12],然而对于育发化妆品中植物提取物标识成分的鉴定方法研究尚未见报道。由于育发化妆品, 特别是育发洗发液的产品中, 含有大量的各类表面活性剂,给样品前处理和仪器分析方法造成困难。本研究针对常见的育发洗发乳(膏)和精华液两种基质,通过优化前处理条件,比较不同的检测方法(包括二极管阵列检测和质谱检测法),建立一种简单、快速、高通量定性和定量鉴定育发化妆品中17种植物提取物标识成分的方法。
2 实验部分
2.1 仪器、试剂与材料
ACQUITYTM超高效液相色谱仪配二极阵列管检测器和Waters XevoTM TQ MS 三重四极杆串联质谱仪(美国Waters公司);Allegra 64R高速冷冻离心机(Beckman公司);MS3 basic漩涡混合器(德国IKA公司);超纯水系统(Milli-Q,美国Millipore公司)。
甲醇、乙腈(HPLC级,Spectrum公司);甲酸、磷酸(分析纯,上海安谱公司)。
17种标准品:芍药苷(PF)、羟基红花黄色素A(HYA)、毛蕊异黄酮葡萄糖苷(CG)、阿魏酸(FA)、甘草苷(LT)、何首乌苷(THS-GLU)、柚皮苷(NG)、芦丁(RT)、补骨脂素(PL)、异补骨脂素(IPL)、槲皮苷(QR)、6-姜辣素(GR)、异欧前胡素(IIPR)、欧前胡素(IPR)、天然辣椒素(CSC)、芝麻素(SM)、丹参酮ⅡA(TSN) ,纯度大于99.0%,均购自上海诗丹德生物技术有限公司。
2.2 标准溶液的配制
分别称取17种标准品10.0 mg于10 mL棕色容量瓶中,用甲醇溶解并定容,配成1 g/L的单标标准储备液,再用80%甲醇溶液将单标标准储备液配制成所需系列混合标准工作溶液,4 ℃避光保存。
2.3 样品的制备与提取
准确称取0.5 g (精确至0.001 g)试样,于10 mL具塞比色管中,用80%甲醇溶解并定容,加入1.0 g NaCl,置于漩涡振荡器上混合,使样品分散2 min,超声提取5 min,取上清液10000 r/min离心5 min, 过滤后待测。
2.4 仪器分析条件
色谱柱:CSH C18( 50 mm×2.1 mm, 1.7 μm, Waters公司);柱温:25 ℃;进样体积:5 μL;流速:0.3 mL/min; 流动相A为0.05% H3PO4溶液,流动B为甲醇。梯度洗脱:0~1 min,10% B,1~12 min,10%~100% B; 12~13 min,100% B; 13~16 min,100%~10% B。检测波长:210~400 nm,多波长定量:PF (231 nm), RT, QR(255 nm), CG, PL, IPL,IPR, IIPR (247 nm), HYA (399 nm), LT, NG, GR, CSC, SM (281 nm), FA, THS-GLU (321 nm), TSN (268 nm)。
3 结果与讨论
3.1 提取溶剂的选择
本研究选用不同浓度(V/V)的甲醇溶液(20%,30%,50%,80%,100%)为提取溶剂,以洗发膏为样品基质,进行加标回收实验。结果表明,在提取油脂或增稠剂含量较高的洗发膏时,均会产生十分明显的乳化现象,且提取液不均匀,导致大多数化合物的样品加标回收率小于50%,重现性差。因此,本研究考虑采用NaCl破乳法和亚铁氰化钾-醋酸锌溶液沉淀法,对样品溶液进行预处理。结果表明,采用亚铁氰化钾-醋酸锌溶液沉淀法,可能引起部分化合物吸附沉淀,导致回收率降低。采用NaCl破乳法,能得到较为澄清的提取液,在甲醇浓度高于80%时,所有化合物都能得到完全提取。但是,随着甲醇浓度增高,NaCl破乳所析出的油脂类物质减少,即样品进样液中的杂质过高,会在柱头累积,进而所造成进样溶剂效应增强。因此,本实验选取80%甲醇溶液为提取溶剂。
3.2 超高效液相色谱条件的优化
3.2.1 色谱柱的选择
比较了4种不同填料色谱柱CSH C18(50 mm×2.1 mm, 1.7 μm), BEH C18(50 mm × 2.1 mm, 1.7 μm), HSS T3(100 mm × 2.1 mm, 1.8 μm), Shield RP18(100 mm × 2.1 mm, 1.7 μm) 的分离效果。结果表明,反相保留能力强的CSH C18和BEH C18色谱柱对于17种化合物的分离效果优于亲水色谱柱Shield RP18和HSS T3。由于CSH颗粒是在亚乙基桥杂化颗粒(BEH)基础上,在其表面控制少量电荷,因此CSH C18对于可能带电荷化合物的保留与BEH C18表现出不同的选择性,可将17种化合物进行有效分离(图1)。因此,本实验选用CSH C18为色谱柱。
3.2.2 柱温条件的选择 比较了柱温(22 ℃,25 ℃,30 ℃,40 ℃)对17种目标化合物色谱分离的影响。结果表明,柱温的变化对HYA/CG, THS-GLU/LT的色谱分离影响十分明显。随着柱温升高,THS-GLU和LT的分离度下降,但HYH和CG色谱峰的分离度增加。比较4种柱温条件下的分离效果,在柱温为25 ℃时,17种目标化合物的色谱峰均能达到基本分离。因此,本实验选用25 ℃为柱温条件。
3.2.3 检测条件的选择 比较了三重四极杆串联质谱仪(UPLC-MS/MS)和二极管阵列检测器(UPLC-PDA)两种检测方法对育发化妆品中17种中草药标识成分的检测结果。结果表明,UPLC-MS/MS虽然具有更高的灵敏度,但是由于17种化合物离子化方式不同,需采用不同的方法进行采集分析。另外,由于育发化妆品特别是育发洗发乳类产品中常添加有高含量的表面活性剂(如十二烷基硫酸铵、月桂醇聚醚硫酸酯钠等),造成目标化合物严重的基质抑制或基质增强作用, 且可能造成质谱的持续污染。因此,考虑到育发化妆品基质的特殊性,为了保证方法的简单、快速且高通量性,本研究采用UPLC-PDA检测器, 根据各个化合物的紫外吸收特性,选用多波长监测模式对17种中草药标识成分进行定量分析。
3.3 线性与方法检出限
分别配制质量浓度为0.20~25 mg/L的系列标准溶液,在本方法实验条件下,对17种中草药标识成分进行测定,根据其色谱峰面积积分值(Y)和相应的质量浓度(X, mg/L)响应关系,得线性回归方程及相关系数。结果表明,在0.20~25 mg/L范围内,17种化合物的线性关系良好,R2>0.999。本研究采用基质样品加标方法,通过计算其标样的响应与背景噪音的比值(S/N=3)确定方法检出限,得到PF, LT, NG, RT, QR, GR, CSC和SM和TSN的方法检出限为4.0 mg/kg,HYA, CG, FA和THS-GLU的方法检出限为2.0 mg/kg,PL, IPL, IIPR和IPR的方法检出限为1.0 mg/kg。
3.4 方法回收率和精密度
选用洗发膏和精华液两种空白育发化妆品为加标基质,按本实验条件进行低、中、高(4.0, 8.0, 20 mg/kg)添加水平的回收率与精密度实验。结果表明,精华液样品的回收率为93.5%~103.9%,日内精密度(n=6)和日间精密度(n=6)分别为0.4%~3.4%和0.8%~3.6%;洗发膏样品的回收率为94.0%~105.0%,日内精密度(n=6)和日间精密度(n=6)分别为0.7%~4.5%和1.2%~4.6%。表明方法具有较高的回收率,准确度和精密度良好。
3.5 实际样品的测定
采集广东地区市售的28份植物提取物类育发化妆品,涉及17个品牌,包括标称有育发、防脱、浓发、固发等功效的产品,典型色谱图及实验结果分别见图2和表1。结果表明,标识成分的检出浓度范围在小于方法检出限(LOD)至211 mg/kg之间,大部分产品,特别是洗发产品中,植物提取物实际添加的含量较低,其标识成分浓度甚至低于方法检出限。目前市场上产品中添加植物提取物更偏重广告效应,而实际上植物提取物在育发化妆品中的功能效果有待值得进一步研究和探讨。
References
1 REN Fang, WEI Yue-Gang. Journal of Zhejiang Chinese Medical, 2012, 36(3): 350-352
任 芳, 魏跃钢. ?浙江中医药大学学报, 2012, ?36(3): 350-352
2 WANG Jian-Da, YANG En-Pin. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, ?2009, ?30(7): 69-70
王剑达, 杨恩品. 云南中医中药杂志, 2009, ?30(7): 69-70
3 Seo S R, Kang G, Ha J W, Kim J C. Journal of Industrial and Engineering Chemistry, ?2013, ?19: 1331-1339
4 Park H J, Zhang N N, Park D K. Journal of Ethnopharmacology, ?2011, ?135: 369-375
5 Pharmacopoeia Commission of People′s Republic of China. Pharmacopoeia of People′s Republic of China (Part1). Beijing: ?Chemical Industry Press, ?2010: 3-347
国家药典委员会. 中华人民共和国药典(一部). 北京: 化学工业出版社, ?2010: 3-347
6 GUO Dan, CHEN Na-Na, YANG Xi-Xiao, HOU Lian-Bing. Chinese Traditional Patent Medicine, ?2005, ?27(4): 402-404
郭 丹, 陈娜娜, 杨西晓, 侯连兵. 中成药, 2005, ?27(4): 402-404
7 XUAN Tie-Feng. China Pharmaceuticals, ?2012, ?21(18): 37-38
宣铁锋. 中国药业, 2012, ?21(18): 37-38
8 HAN Chao, YE Li-Ru, CAI Xiao-Jun, ZHU Zhen-Ou, LIU Cui-Ping, SHEN Yan. Chinese Journal of Pharmaceutical Analysis, ?2012,
32(8): 1365-1369
韩 超, 叶丽如, 蔡小军, 朱振瓯, 刘翠平, 沈 燕. 药物分析杂志, 2012, ?32(8): 1365-1369
9 FENG Ying, HE Jun, LIU Hong, WANG Tao. Lishizhen Medicine and Materia Medica Research, ?2013, ?24(3): 572-574
冯 颖, 何 俊, 刘 虹, 王 涛. 时珍国医国药, 2013, ?24(3): 572-574
10 CHEN Wei, WANG Chao, CHENG Yan, XUE Yi-Mei, ZHANG Qing. Chinese Journal of Chromatography, ?2007, ?25(5): 768-769
陈 伟, 王 超, 程 艳, 薛一梅, 张 青. 色谱, 2007, ?25(5): 768-769
11 CHEN Jie, XU Juan, XIONG Li-Hua. Chinese Journal of Chromatography, ?2011, ?29(5): 454-457
陈 捷, 徐 娟, 熊莉华. 色谱, 2011, ?29(5): 454-457
12 XIAN Yan-Ping, GUO Xin-Dong, MU Tong-Na, TAN Jian-Hua, ZHANG Yan, LUO Hai-Ying, WU Yu-Luan. Chinese Journal of Analysis Laboratory, ?2014, ?33(2): ?171-174
冼燕萍, 郭新东, 穆同娜, 谭建华, 张 岩, 罗海英, 吴玉銮. 分析试验室, 2014, 33(2): 171-174
Determination of 17 Characteristic Ingredients of Plant
Extracts in Hair Growth Cosmetics by Ultra High
Performance Liquid Chromatography
TAN Jian-Hua1,2, LI Hui-Yong1, XI Shao-Feng1,2, GUO Chang-Hong1,
WANG Ji-Cai1, XIONG Xiao-Ting1, XIAN Yan-Ping1, GUO Xin-Dong1
1(Guangzhou Products Quality Supervision and Testing Institute,
National Center for Quality Supervision and Testing of Cosmetics, Guangzhou 510110, China)
2(The College of Natural Resources and Environment of South China Agricultural University, Guangzhou 510642, China)
Abstract A method was developed for the simultaneous determination of 17 characteristic ingredients of plant extracts, including paeoniflorin, hydroxysafflor yellow A, calycosin-7-glucoside ferulic acid, etc., in hair growth cosmetics using ultra high performance liquid chromatography (UPLC). Different cosmetic samples were extracted by ultrasonic-assisted extraction with the solvent of methanol/water (4∶1, V/V) solution. After demulsified by the addition of appropriate amount of NaCl and high speed centrifugation, the supernatant was transferred and analyzed with UPLC. The separation was conducted on a Waters reversed phase column of ACQUITY UPLC CSH C18 (50 mm×2.1 mm, 1.7 μm), and the mobile phases were methanol and the solution of 0.05% phosphate in water. The detection was performed with a photodiode-array (PDA) detector. The linear range was 0.2-25 mg/L with correlation coefficients higher than 0.999. The limits of detection were within 0.3-1.5 mg/kg, and the limits of quantification were from 1.0 to 4.0 mg/kg. The average recoveries of 17 characteristic ingredients were within 93.5%-105.0%, with the intra-and inter-day precision (n=6) less than 4.6%. This method was simple, rapid, with good-repeatability, and had been applied to the analysis of real samples.
Keywords Ultra-high performance liquid chromatography; Characteristic ingredients of plant extracts; Hair growth cosmetics
(Received 16 June 2014; accepted 12 September 2014)

