阻断PI3K/AKT/mTOR通路增强顺铂诱导的人皮肤黑素瘤细胞株A375凋亡的机制研究
张斌斌 王湘琦 赵超然 熊爱兵

[摘要]目的:本实验探讨抑制PI3K/AKT/mTOR通路对顺铂诱导人皮肤黑素瘤细胞株A375细胞凋亡作用及其机制。方法:用顺铂处理人皮肤黑素瘤细胞株A375细胞后Western blot检测细胞凋亡、PI3K/AKT/mTOR通路的活化情况以及细胞增殖-毒性检测试剂盒(Cell Counting Kit-8,CCK-8)。用PI3K的抑制剂LY294002(LY)和mTOR的抑制剂雷帕霉素(Rapamycin,Rap)分别预处理以研究其对顺铂处理后人皮肤黑素瘤细胞株A375细胞凋亡的协同作用。为进一步探索阻断PI3K/AKT/mTOR通路对顺铂处理后人皮肤黑素瘤细胞株A375细胞凋亡的协同作用机制,采用Western blot检测阻断PI3K/AKT/mTOR后联用顺铂处理人皮肤黑素瘤细胞株A375细胞中Bcl-2、Bcl-xl蛋白表达。结果:顺铂处理后的A375黑素瘤细胞中PARP的活化剪切体表达量水平呈浓度和时间依赖性增加,细胞活力呈浓度和时间依赖性降低(P<0.05)。顺铂处理A375黑素瘤细胞后PI3K/AKT/mTOR通路的活化。阻断PI3K/AKT/mTOR通路再用顺铂联合处理A375黑素瘤细胞后PARP的活化剪切体表达量明显上调以及细胞活力明显降低(P<0.05)。阻断PI3K/AKT/mTOR通路后再用顺铂联合处理A375黑素瘤细胞发现Bcl-2蛋白和Bcl-xl表达水平下调。结论:阻断PI3K/AKT/mTOR通路对顺铂诱导的细胞凋亡具有协同作用,该协同作用可能与Bcl-2和Bcl-xl蛋白下调有关。
[关键词]PI3K/AKT/mTOR;Bcl-2;黑素瘤细胞;A375;顺铂;凋亡
[中图分类号]R732.2? ? [文献标志码]A? ? [文章编号]1008-6455(2019)08-0072-05
黑素瘤(melanoma)是起源于黑素细胞的恶性肿瘤,常发生在皮肤、黏膜等。近年来,黑素瘤的发病率和死亡率正在逐步增加[1-4]。它的发生、发展与紫外线照射时间延长、女性激素、砷化物、酒精、辐射和饱和脂肪等有关[5-6]。目前对于黑素瘤的治疗方案有手术治疗、药物治疗和分子靶向治疗。尽管手术切除治疗黑素瘤是一种有效的手段,但是术后往往容易导致肿瘤的复发、患者生存率不尽人意[7-8]。此外,近年来对于黑素瘤的药物化疗研究逐渐增多,但是由于其肿瘤产生的耐药性、药物化疗效果并不理想,所以有必要探讨新的治疗策略。有研究报道显示,药物化疗与分子靶向治疗在抗肿瘤中具有很好的抑制作用[9-10]。因此,本文探讨药物与分子靶向在黑素瘤中的作用及机制。
顺铂(cisplatin)是中心以二价铂同两个氯原子和两个氨分子结合的重金属络合物,类似于双功能烷化剂,可抑制DNA的复制过程,也是肿瘤治疗中的常用化疗药物,其诱导肝癌、肺癌和卵巢癌等各种肿瘤细胞凋亡[11-12]。但是,顺铂诱导人皮肤黑素瘤細胞凋亡及凋亡耐受的具体机制却少有人报道。磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶(phosphatidylinositol-3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/AKT/mTOR)是近年来研究较为广泛的信号通路之一,该通路可抑制多种毒性刺激诱导的细胞死亡,其作用在各类肿瘤细胞都有所体现[13-17]。因此,探讨黑素瘤细胞耐受顺铂的机制是否与PI3K/AKT/mTOR通路有关具有重要意义。
本实验通过Western blotting、CCK-8等方法分析顺铂对A375黑素瘤细胞的影响,阻断PI3K/AKT/mTOR通路后再用顺铂对A375黑素瘤细胞的凋亡和细胞活力影响及阻断PI3K/AKT/mTOR通路增强顺铂对A375黑素瘤细胞凋亡的机制进行研究。
1? 材料和方法
1.1 药品与抗体:PI3K抑制剂(LY294002,LY)、mTOR抑制剂Rapamycin(Rap)购自美国Santa Cruz公司,顺铂(Cisplatin)购自美国Selleck Chemicals公司。抗PARP(PARP,poly ADP-ribose polymerase)、p-AKT(Ser473) 、AKT、p-P70S6K、P70S6K、Bcl-2、Bcl-xl一抗购自美国Cell Signaling Technology公司,GAPDH一抗购自美国Santa Cruz公司,CCK-8试剂盒购自碧云天生物技术有限公司。人皮肤黑素瘤细胞株A375购自中国科学院上海生命科学研究院。
1.2 细胞培养:人皮肤黑素瘤细胞用含10%胎牛血清、1%青霉素/链霉素的DMEM完全培养基培养于5% CO2,37℃孵箱。视细胞生长情况换液,待细胞生长达到对数生长期时进行实验研究。
1.3 Western blot分析:十二烷基硫酸钠-聚丙烯凝胶( SDS-PAGE)电泳分离蛋白质,采用hoefer半干电转移将蛋白分子转移到PVDF膜上,转膜后将PVDF膜加入5%牛血清白蛋白进行封闭,室温轻摇封闭1h。待封闭结束后,1×TBST洗涤3次(5min/次)后,PVDF膜与一抗稀释液室温下轻摇动孵育30min,4℃冰箱过夜,回收一抗,1×TBST洗涤3次(5min/次)。PVDF膜与荧光二抗稀释液于室温下轻摇动孵育1h,回收二抗,1×TBST洗涤3次(5min/次) 。Odyssey-CLX扫描显影。
1.4 蛋白提取:采用不同浓度顺铂(0、5、10、20mg/ml)刺激A375黑素瘤细胞24h后提取蛋白;采用顺铂(10mg/ml)处理A375黑素瘤细胞12h、24h、36h,分别提取每个时间点的蛋白;LY294002(PI3K通路抑制剂)预处理黑素瘤细胞A375中1h后联用顺铂(10mg/ml)处理12h,24h,提取蛋白;Rap(mTOR通路抑制剂)预处理黑素瘤细胞A375中1h后联用顺铂(10mg/ml)处理12h,24h,提取蛋白;依据以上实验分组情况,待药物处理达到预定时间后,弃掉六孔板中培养液,PBS冲洗3次,随即向各孔中加入适量含蛋白酶抑制剂的IP裂解液(约100μl),轻微晃动,使IP裂解液覆盖所有细胞,将六孔板置于冰上约15min。用细胞刮将细胞刮下并用1.5ml EP管收集,用超声波细胞粉碎冰上超声破碎细胞,超声3次(5s/次)。用4℃低温离心机12 000rpm离心15min,取离心后上清液装入新的1.5ml EP管中,置于冰上。样品变性:根据EP管中取得的蛋白样品总体积,加入1/5总体积的5×蛋白loading buffer,充分混匀后,在100℃蜂窝炉煮变性5~10min,最后放在冰上约3min。
1.5 细胞活力检测(CCK-8):①根据实验设计将不同浓度顺铂(0、5、10、20mg/ml)刺激A375黑素瘤细胞24h后,取出培养板;②倒掉培养基,向待检测孔中加20?l的CCK-8溶液;③将CCK-8溶液处理后的培养板,直接放入37℃孵箱继续培养2h;④采用多功能微孔板检测仪测定每孔490nm处的吸光度,得到每孔的OD值;⑤测得的每个孔中OD值,制作时间点-活细胞率曲线图。实验重复至少3次。
采用CCK-8分别检测:顺铂(10mg/ml)处理A375黑素瘤細胞0h、24h、48h、72h的OD值;LY294002(PI3K通路抑制剂)预处理黑素瘤细胞A375中1h后联用顺铂(10mg/ml)处理0h、24h、48h、72h的OD值;Rap(mTOR通路抑制剂)预处理黑素瘤细胞A375中1h后联用顺铂(10mg/ml)处理0h、24h、48h、72h的OD值;根据测得的OD值制作时间点-活细胞率曲线图。
1.6 统计学分析:所有结果均采用SPSS 23.0软件进行统计分析。
2? 结果
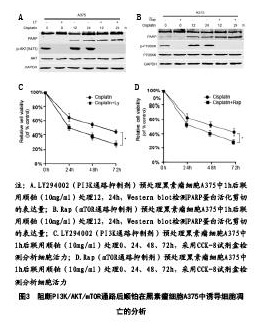
2.1 顺铂诱导黑素瘤A375细胞凋亡具有浓度和时间依赖性:为研究黑素瘤A375细胞在不同浓度顺铂(0、5、10、20mg/ml)刺激24h下的凋亡情况,笔者采用Western blot检测不同浓度顺铂(0、5、10、20mg/ml)刺激下黑素瘤A375细胞PARP的活化剪切体表达,发现随着顺铂浓度的增加,剪切的PARP表达增加,这说明细胞凋亡增加(图1A)。与此同时,用顺铂(10mg/ml)处理黑素瘤A375细胞12h、24h、36h,结果显示随着时间的推移,PARP的活化剪切体表达水平增加,说明顺铂诱导的细胞凋亡随着时间的推移而增加(图1B)。 此外,为了进一步验证顺铂对黑素瘤A375具有抑制作用,采用CCK-8试剂盒检测不同浓度顺铂(0、5、10、20mg/ml)处理黑素瘤24h后的细胞活性影响,发现随着浓度的增加,细胞活性减弱,这提示细胞凋亡(图1C)。同时采用顺铂(10mg/ml)处理黑素瘤A375细胞0h、24h、48h、72h,结果提示随着时间的推移,细胞活力也减弱(图1D)。这些进一步论证顺铂诱导的细胞凋亡随着时间的推移而增加。
2.2 顺铂诱导黑素瘤A375细胞PI3K/AKT/mTOR通路的活化:为研究顺铂(10mg/ml)处理黑素瘤A375细胞在不同时间点(12h、24h)后的PI3K/AKT/mTOR通路的影响,笔者通过Western blot检测黑素瘤A375细胞在顺铂(10mg/ml)处理12h、24h后,p-AKT(S473) 、p-P70S6K均表达上调。说明顺铂诱导PI3K/AKT/mTOR通路的活化,见图2。
2.3 抑制PI3K/AKT/mTOR通路增强顺铂在黑素瘤A375细胞中诱导的细胞凋亡:为了研究PI3K/AKT/mTOR通路在顺铂诱导黑素瘤A375细胞的细胞凋亡中的作用,采用PI3K抑制剂LY294002预处理1h阻断PI3K/AKT通路后再用顺铂(10mg/ml)处理黑素瘤A375细胞24h,36h,Western blot结果显示,预处理后联用顺铂组与顺铂组相比,PARP蛋白的活化剪切表达量明显上调,说明阻断PI3K/AKT增强顺铂诱导的细胞死亡。(图3)。与此同时,用mTOR的抑制剂Rap预处理1h阻断mTOR通路后再用顺铂(10mg/ml)处理黑素瘤A375细胞24h,36h,Western blot结果显示,预处理后联用顺铂组与顺铂组相比PARP蛋白的活化剪切表达量明显上调。
此外,为了进一步验证PI3K/AKT/mTOR通路在顺铂诱导黑素瘤A375细胞的细胞凋亡中的作用,采用PI3K抑制剂LY294002预处理1h阻断PI3K/AKT通路后再用顺铂(10mg/ml)处理黑素瘤A375细胞0h、24h,48h、72h,CCK-8结果显示预处理后联用顺铂组与顺铂组相比,细胞的活力明显减弱(图3A)。与此同时,用mTOR的抑制剂Rap预处理1h阻断mTOR通路后再用顺铂(10mg/ml)处理黑素瘤A375细胞0h、24h,48h、72h,CCK-8结果显示预处理后联用顺铂组与顺铂组相比,细胞的活力明显减弱(图3B)。总之,抑制PI3K/AKT/mTOR通路增强顺铂在黑素瘤A375细胞中诱导的细胞凋亡。
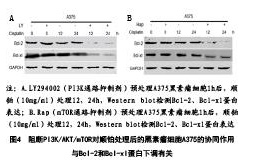
2.4 抑制PI3K/AKT/mTOR通路增强了顺铂在黑素瘤A375细胞凋亡,可能与Bcl-2、Bcl-xl表达水平下调有关;为了研究抑制PI3K/AKT/mTOR通路增强了顺铂在黑素瘤A375细胞凋亡的可能机制,笔者在黑素瘤A375细胞中先用LY294002和Rap分别预处理1h分别阻断PI3K/AKT和mTOR通路后,再用顺铂处理24h,36h,Western blot检测Bcl-2、Bcl-xl蛋白表达。结果显示,LY294002/Rap预处理联用顺铂组与单用顺铂组相比,Bcl-2和Bcl-xl表达量明显下调,说明阻断PI3K/AKT/mTOR通路可能通过下调Bcl-2和Bcl-xl蛋白增强的顺铂诱导的凋亡,见图4。
3? 讨论
黑素瘤是好发于皮肤的恶性肿瘤,目前的治疗方案有手术治疗、放化疗、免疫治疗、分子靶向治疗等[18-19]。对于药物化疗治疗黑素瘤往往缺乏有效的药物靶点,且对靶向药物的耐药性限制了黑素瘤患者长期治疗的疗效[20]。尽管有报道一些药物在一定程度上改善了黑素瘤的治疗效果,但是黑素瘤对药物的敏感性下降往往是化疗药物耐药的关键原因之一,其与PI3K/AKT/mTOR作用于黑素瘤细胞息息相关[21-24]。本研究证实顺铂在A375黑素瘤细胞中诱导细胞凋亡,实验在不同浓度顺铂处理下PARP的活化剪切表达随着浓度的增加而增加,剪切的parp还随时间推移而增加;此外,CCK-8细胞活力检测分析表明随着顺铂浓度增加和时间的推移A375黑素瘤细胞活力减弱(P<0.05)。这说明顺铂在A375黑素瘤细胞中诱导细胞凋亡。这与他人报道的顺铂在多种癌细胞中的细胞毒性作用结论一致[25-26]。本实验也证实了阻断PI3K/AKT/mTOR通路对顺铂诱导的A375细胞具有协同作用,本实验采用PI3K/AKT/mTOR通路的抑制剂与顺铂联合处理A375细胞,与单独使用顺铂组相比,剪切的PARP蛋白表达量明显上调,CCK-8实验检测分析细胞活力减弱(P<0.05),这说明阻断PI3K/AKT/mTOR通路增强顺铂诱导A375细胞凋亡[27]。为了进一步探索该协同作用的机制,采用PI3K/AKT/mTOR通路抑制剂与顺铂联合处理A375细胞后检测Bcl-2和Bcl-xl蛋白表达,发现Bcl-2和Bcl-xl蛋白表达明显下调。因此推测阻断PI3K/AKT/mTOR通路对顺铂诱导细胞凋亡中的协同作用可能与Bcl-2和Bcl-xl下调有关。
本研究揭示了阻斷PI3K/AKT/mTOR对顺铂诱导的细胞凋亡具有协同作用,这种保护作用可能与Bcl-2和Bcl-xl蛋白下调有关。
[参考文献]
[1]Tsutsumida A,Furukawa H,Yamamoto Y,et al.Treatment strategy for cutaneous malignant melanoma[J].Int J Clin Oncol,2005,10(5):311-317.
[2]Chung ES,Sabel MS,Sondak VK.Current state of treatment for primary cutaneous melanoma[J].Clin Exp Med,2004,4(2):65-77.
[3]Jemal A.Cancer statistics[C].CA Cancer J Clin,2004,54(1):8-29.
[4]Balch CM,Soong SJ,Gershenwald JE,et al.Prognostic factors analysis of 17 600 melanoma patients:validation of the American Joint Committee on Cancer melanoma staging system[J].J Clin Oncol,2001,19(16):3622-3634.
[5]Oliveria S,Saraiya M,Geller A,et al.Sun exposure and risk of melanome[J].Arch Dis Child,91(2):131-138.
[6]Sladden MJ,Balch C,Barzilai DA,et al.Surgical excision margins for primary cutaneous melanome[J].Cochrane Database Syst Rev,2009,129(4):56.
[7]Mohs FE,Mikhail GR.Mohs micrographic surgery[J].WB Saunders,2016(1):13-14.
[8]Pasquali S,Hadjinicolaou AV,Chiarion SV,et al.Systemic treatments for metastatic cutaneous melanoma [J].Mocellin S,2018.
[9]Berger M,Riching G,Kashofer K,et al.The window of opportunities for targeted therapy inBRAFwt/NRASws/KITwt melanoma:biology and clinic implications of fusion proteins and other mutations[J].G Ital Dermatol Venereol,2018,153(3):349-360.
[10]Buzaid AC.Management of metastatic cutaneous melanoma[J].Oncology,2004,18(11):1443-1450.
[11]Sancho-Martínez SM,Prieto-García L,Prieto M,et al.Subcellular targets of cisplatin cytotoxicity:an integrated view[J].Pharmacol Ther,2012,136(1):35-55.
[12]Mouawad R,Sebert M,Michels J,et al.Treatment for metastatic malignant melanoma:old drugs and new strategies[J].Crit Rev Oncol Hematol,2010,74(1):27-39.
[13]Qiao J,WJ Wang,Y Zhang.Aclidinium inhibits proliferation and metastasis of ovarian cancer SKOV3 cells via downregulating PI3K/AKT/mTOR signaling pathway[J].Oncol Lett,2018,16(5):6417-6422.
[14]Lin YT,Wang HC,Chuang HC,et al.Pre-treatment with angiotensin-(1-7) inhibits tumor growth via autophagy by downregulating PI3K/Akt/mTOR signaling in human nasopharyngeal carcinoma xenografts[J].Mol Med(Berl),2018,34(12):79-86.
[15]Ou X,Zhang GT,Xu Z,et al.Desumoylating Isopeptidase 2 (DESI2) inhibits proliferation and promotes apoptosis of pancreatic cancer cells through regulating PI3K/AKT/mTOR signaling pathway[J].Pathol Oncol Res,2018.
[16]Santarpia L,SM Lippman,AK El-Naggar.Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy[J].Expert Opin Ther Targets,2012,16(1):103-119.
[17]Mi YJ,Liang YJ,Huang HB,et al.Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters[J].Cancer Res,2010,70(20):7981-7991.
[18]Donahue AC,Fruman DA.PI3K signaling controls cell fate at many points in B lymphocyte development and activation[J].Semin Cell Dev Biol,2004,15(2):183-197.
[19]Swetter SM,Tsao H,Bichakjian CK,et al.Guidelines of care for the management of primary cutaneous melanoma[J].J Am Acad Dermatol,2019,80(1):208-250.
[20]Hambright HG,Meng P,Kumar AP,et al.Inhibition of PI3K/AKT/mTOR axis disrupts oxidative stress-mediated survival of melanoma cells[J].Oncotarget,2015,6(9):7195-7208.
[21]Vella LJ,Andrews MC,Behren A,et al.Immune consequences of kinase inhibitors in development,undergoing clinical trials and in current use in melanoma treatment[J].Expert Rev Clin Immunol,2014,10(8):1107-1123.
[22]Calero R,Morchon E,Martinez-Argudo I,et al.Synergistic anti-tumor effect of 17AAG with the PI3K/mTOR inhibitor NVP-BEZ235 on human melanoma[J].Cancer Lett,2017,406:1-11.
[23]Li J,F Huang.JTC-801 suppresses melanoma cells growth through the PI3KAktmTOR signaling pathways[J].Med Sci (Paris),2018,34(1):8-14.
[24]Makino E,Gutmann V,Kosnopfel C,et al.Melanoma cells resistant towards MAPK inhibitors exhibit reduced TAp73 expression mediating enhanced sensitivity to platinum-based drugs[J].Cell Death Dis,2018,9(9):930.
[25]Su PF,SQ Song.Regulation of mTOR by miR-107 to facilitate glioma cell apoptosis and to enhance cisplatin sensitivity[J].Eur Rev Med Pharmacol Sci,2018,22(20):6864-6872.
[26]Wang H,Fang L,Jiang J,et al.The cisplatin-induced lncRNA PANDAR dictates the chemoresistance of ovarian cancer via regulating SFRS2-mediated p53 phosphorylation[J].Cell Death Dis,2018,9(11):1103.
[27]Yao ZF,Zhang XM,Wu Y.The effect of mTOR inhibitors on overcoming multidrug resistance in human melanoma cells[J].Clin Dematol,2014,43(3):136-139.
[收稿日期]2019-01-03
本文引用格式:張斌斌,王湘琦,赵超然,等.阻断PI3K/AKT/mTOR通路增强顺铂诱导的人皮肤黑素瘤细胞株A375凋亡的机制研究[J].中国美容医学,2019,28(8):72-76.

