
摘 要:本文研究了LiHCO3溶液热分解结晶过程中Li+含量、热分解温度、搅拌速率以及晶种对Li2CO3产率和杂质含量的影响。试验结果表明,热分解温度越高,Li2CO3产率越大,而不同热解温度会影响到Li2CO3中的杂质含量;热分解时LiHCO3溶液中Li+浓度越高,得到的Li2CO3产率越大,还可以减轻“黏壁”现象;搅拌速率能够显著的影响到热分解过程的“黏壁”现象,较大的搅拌速率会使“黏壁”现象明显减轻;晶种和添加剂的加入可以有效地解决“黏壁”现象,从而提高Li2CO3的产率;LiHCO3溶液经过离子交换精制,然后再热分解可以提高Li2CO3的纯度。经过试验得到的较佳热分解条件为:热分解温度70℃、LiHCO3溶液中Li+浓度为8.5g/L、搅拌速率为500rpm,热分解前加入晶种。在此条件下,经过离子交换精制后LiHCO3溶液通过热分解结晶得到的Li2CO3的纯度及杂质含量均能满足电池级碳酸锂的要求。
关键词:碳酸锂;碳酸氢锂;热分解
中图分类号: TQ131.11 ? ? ? ? 文献标识码: A ? ? ? ? ? ?文章编号: 1673-1069(2016)33-181-3
0 ?引言
我国在高纯碳酸锂(Li2CO3)领域相对于发达国家还有一定的差距。近年来,将工业级碳酸锂经过分离纯化制备高纯碳酸锂的方法主要有苛化法、重结晶法、尿素沉淀法、碳酸氢铵沉淀法及碳化分解法等。碳化法是在粗碳酸锂的悬浮中通入二氧化碳,将难容的碳酸锂转化为溶解度较高的碳酸氢锂(LiHCO3),碳酸氢锂溶液经过热分解反应得到高纯的碳酸锂,这种方法的优点是二氧化碳不会引入其他的杂质离子,经过纯化后得到的碳酸锂产品纯度较高,有着广阔的应用前景。
1 ?试验材料及仪器
1.1 主要试验材料
碳酸氢锂溶液中主要成分含量见表1。
表1 ?碳酸氢锂溶液主要成分含量表
[成分\&Ba2+\&Ca2+\&K+\&Mg2+\&Na+\&Li+\&SO42-\&含量(mg/L)\&22.380\&5.109\&0.933\&14.610\&51.590\&8533.000\&-\&]
1.2 主要仪器
试验中用到的主要仪器见表2。
表2 ?主要仪器
[仪器名称\&型号\&生产厂家\&电感耦合等离子体发射光谱仪
电子天平
全自动合成工作站
颗粒录影显微镜
聚焦光束反射测量仪\&ICAP6300
XS204
OptiMax
V819
D600L\&赛默飞世尔科技公司
梅特勒-托利多仪器(上海)有限公司
梅特勒-托利多仪器(上海)有限公司
梅特勒-托利多仪器(上海)有限公司
梅特勒-托利多仪器(上海)有限公司\&]
2 ?试验方法
2.1 试验装置图
碳酸氢锂溶液热分解结晶过程试验装置如图1所示:
2.2 试验步骤
①取400ml碳化液,加入到全自动合成工作站的玻璃反应釜内,盖好反应釜盖,并插入FBRM及PVM探头。
②设定反应温度,搅拌转速等参数,开始试验。
③试验结束后,迅速将反应后的混合液过滤,洗涤数次,将所得Li2CO3产品烘干,称量后计算产率。
④取一定量烘干的碳酸锂产品,用ICAP6300测定其杂质含量。
3 ?分析方法
3.1 碳酸锂产品中锂离子含量以及主要杂质离子的测定
本试验中杂质离子以及锂离子含量均使用电感耦合等离子体原子发射光谱仪(ICAP6300)测定,ICAP具有灵敏度高,检测速度快,仅需要少量样品,能一次分析多种离子的分析等优点,钢铁、食品、材料、环境、化工、地质等领域中应用广泛。
3.2 碳酸锂结晶的粒度分布等参数的测定
粒度分析可以使用激光粒度仪和聚焦光束反射测量仪(FBRM)等仪器来测定。本试验中采用FBRM来测定分析碳酸锂结晶的粒度。
FBRM原理是利用以一固定速度旋转(通常是2m/s)的聚焦激光束在FBRM的探头窗口及待测体系之间扫描,当聚焦激光束扫过时,激光束会在颗粒上发生反射,使得激光以反射散射光的形式反射回FBRM,这些反射散射光的脉冲信号与扫描速率通过简单计算即可以转化为颗粒的一边到另一边的直线距离,即弦长,从而得到颗粒的粒度分布。FBRM可以迅速灵敏地、用实时在线的方式跟踪颗粒的变化,这样在反应过程中就可以不用取样分析,另外由于这种测量方式没有假设颗粒的形状,所以可以避免测量的时候引入较大误差。
4 结果与讨论
碳酸氢锂溶液(LiHCO3)中杂质含量较低,为了检测的方便以及为了使热分解条件对产品的影响更加明显,在做单因素试验时碳酸氢锂溶液未用离子交换处溶液而直接进行热分解试验。
4.1 Li+含量对热分解过程的影响
固定试验条件:热分解搅拌速率为300rpm、热分解温度为70℃和热分解反应时间为5h;改变LiHCO3溶液中的Li+浓度分别为:3.6g/L、4.3g/L、5.8g/L、8.5g/L。通过实验可知,随着LiHCO3溶液中初始Li+浓度的升高,Li2CO3的产率显著上升,Li+浓度在8.5g/L时碳酸锂的收率最大。若从产率方面考虑,初始Li+浓度应该尽可能高,其中LiHCO3溶解度限制了碳化液中Li+浓度的进一步提高。Li+浓度不同会影响到热分解后产品的纯度,Li+浓度小于6g/L的时候,热分解得到碳酸锂中Ba2+、Ca2+、Mg2+含量随Li+浓度上升显著下降,但是当Li+浓度大于5.8g/L后,Li2CO3产品中的Ba2+、Mg2+含量变化不明显,而Ca2+含量有上升的趋势,这说明Li+浓度过小不利于产品中Ba2+和Mg2+的分离,若为了控制产品中的Ca2+含量, Li+的初始浓度应该在5.8g/L左右;碳化液中初始Li+浓度对于产品中Na+和K+浓度并无明显的影响。
试验中发现,热分解时若Li+浓度较高时,产品“黏壁”的现象有所减轻,考虑到LiHCO3溶液中Li+浓度在8.5g/L的溶液已经接近饱和,所以选择Li+的浓度为8.5g/L。
4.2 温度对热分解过程的影响
热分解温度在50℃的时候,Li2CO3的产率很低。经过过滤烘干后产率仅有4%左右,随着热解温度继续的升高,Li2CO3的产率明显增加。造成这一现象的原因是LiHCO3分解成Li2CO3的反应是一个吸热反应,温度越高越有利于LiHCO3的分解从而生成更多的Li2CO3,另一方面,Li2CO3的溶解度是逆溶解度,温度越高溶解度越小,故高温更有利于Li2CO3的析出。所以从产率方面来说,热分解时候温度应该尽量的高。
热分解温度也可以影响到Li2CO3中杂质的含量。随着热分解温度的上升,Li2CO3中Ba2+含量总体上呈现下降的趋势,90℃时Ba2+的含量不到60℃时含量的50%,这是由于碳酸钡溶解度随温度升高而升高,高温有利于抑制Ba2+进入到Li2CO3之中;Ca2+含量在60℃到80℃时较低,而50℃和90℃时含量较高,若为了控制Li2CO3中的Ca2+含量,热分解温度应该选在60℃到80℃之间;随热分解温度的上升,K+含量先没有明显变化,之后呈现下降的趋势,在70℃的时候K+含量的变化就再不明显;对于Mg2+,热分解温度在50℃时含量最高,随后升高到60℃,Li2CO3中Mg2+含量大幅下降,热分解温度在60℃到80℃时Mg2+含量相对较低,但是继续升温Mg2+含量又有所增加,故若为了控制Li2CO3中的Mg2+含量,温度控制在60℃到70℃为宜;热解温度在60℃时Na+含量最高,随后随着温度的上升,Na+含量逐渐降低,所以若为了控制产品中的Na+含量,热分解温度需要在60℃以上,且温度尽可能的高。
试验中发现,热分解时“黏壁”现象非常严重,Li2CO3产品大量黏附于搅拌桨和反应釜上,而PVM的探头也因为被Li2CO3遮挡而无法正常使用,同样也导致了FBRM无法正常测量,这也是导致产率较低的原因之一,如果需要将产率提高,需要解决黏壁现象。另外温度升高以后,过滤烘干后得到产品更易结块而形成大颗粒。综合考虑,选定70℃为热解温度。
4.3 搅拌速率对热分解过程的影响
固定试验条件:热分解温度为70℃,LiHCO3溶液中的Li+浓度为8.5g/L,反应时间5h;改变搅拌速率为100rpm、300rpm、500rpm和700rpm,试验结果如图2、图3和图4。
图2 ?Li2CO3产率随搅拌速率的变化
图3 ?搅拌速率对产品中杂质含量的影响
由图2可知,随着搅拌速率的增加,Li2CO3的产率也随之增加,在500rpm后趋于平缓。造成这一现象的原因是搅拌速率的提高能有效的抑制“黏壁”现象,从而产率有所提高,搅拌速率在500rpm时“黏壁”现象就已经明显减轻,之后转速的提高影响不再明显。较高的搅拌速率得到的Li2CO3不易结块。因而从黏壁现象和产率等上考虑,应选择较高的搅拌速率进行热分解反应。
由图3可知,搅拌速率在300rpm以下时,搅拌转速对Ba2+含量影响并不明显,当转速大于300rpm后,随搅拌速率增加Ba2+含量略有下降,这说明较高搅拌速率有利于Ba2+的去除;搅拌转速对Ca2+含量略有影响,对Mg2+、Na+、K+含量的影响不明显。综合考虑,搅拌转速选择在500rpm为宜。
4.4 晶种对热分解过程的影响
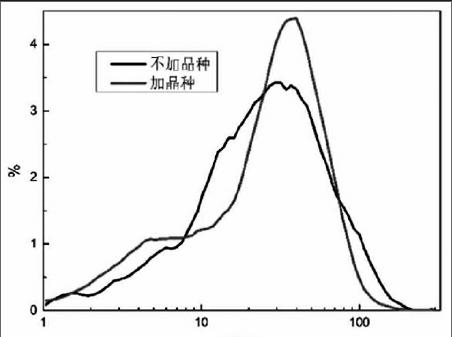
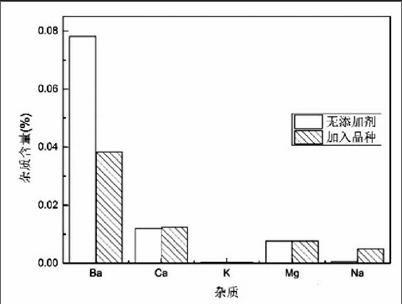
固定试验条件:热分解温度为70℃,LiHCO3溶液中的Li+浓度为8.5g/L,搅拌速率为500rpm,反应时间为5h;向LiHCO3溶液中分别加入晶种进行试验,试验结果如图4、图5、图6。
由图4可知,加入晶种后Li2CO3中Ba2+含量有较明显的下降,下降约50%。加入晶种对Li2CO3中Ca2+、K+、Mg2+的含量影响不大;而晶种的加入会使得产品中Na+的含量有一定的上升。对比电池级Li2CO3标准发现,热分解得到的Li2CO3除了Ca2+含量超出标准以外,其余杂质离子含量都符合标准的要求。由图5可知,晶种的加入可以使得Li2CO3的粒度分布更窄,这表明加入晶种后得到的颗粒更加均匀。由图6可知,当加入晶种和添加剂后,Li2CO3的黏壁现象得到了有效地减轻。
4.5 经过离子交换后碳酸氢锂溶液热分解试验
取盐湖某企业生产的碳酸锂,在较佳条件下(碳化温度为20℃,液固比为20:1,搅拌转速为400rpm,CO2气体流量为1.0L/min)碳化制取LiHCO3溶液;取751树脂3.0g,装填于直径1cm的离子交换柱中,采用动态吸附试验的方法,在室温下将碳化液以4ml/min流量流经离子交换柱,将精制后的LiHCO3溶液收集于试剂瓶中;精制的溶液在热解温度70℃、搅拌速率500rpm、热分解时间5h、加入晶种和添加剂的情况下,进行热分解反应得到的Li2CO3经过过滤、洗涤及干燥后,测定纯度和主要杂质的含量。
通过实验可知,经过离子交换精制后热分解得到的Li2CO3产品中的主要杂质含量均达到了电池级碳酸锂的要求。Li2CO3的单程收率为66.7%。
5 结论
试验结果表明,热分解温度越高,Li2CO3产率越大,而不同热解温度会影响到Li2CO3中的杂质含量;热分解时LiHCO3溶液中Li+浓度越高,得到的Li2CO3产率越大,还可以减轻“黏壁”现象;搅拌速率能够显著的影响到热分解过程的“黏壁”现象,较大的搅拌速率会使“黏壁”现象明显减轻;晶种和添加剂的加入可以有效地解决“黏壁”现象,从而提高Li2CO3的产率;LiHCO3溶液经过离子交换精制,然后再热分解可以提高Li2CO3的纯度。经过试验得到的较佳热分解条件为:热分解温度70℃、LiHCO3溶液中Li+浓度为8.5g/L、搅拌速率为500rpm,热分解前加入晶种。在此条件下,经过离子交换精制后LiHCO3溶液通过热分解结晶得到的Li2CO3的纯度及杂质含量均能满足电池级碳酸锂的要求。
参 考 文 献
[1] 伊文涛,闫春燕,戴志锋,等.高纯碳酸锂的应用与制备方法评述[J].化工矿物与加工,2005,34(11):5-8.
[2] 邓小川,霍闪,马培华,等.一种碳酸氢锂溶液的制备方法[P].中国专利:CN104211097A,2014-12-17.
[3] 伊文涛,闫春燕,马培华.碳酸锂常压鼓泡碳化宏观反应动力学研究[J].化工矿物与加工,2009,38(3):1-4.
[4] 吴鉴,戴永年,姚耀春.氢化条件对碳酸锂提纯的影响[J].材料导报,2011,25(14):82-84.
- 探析对风湿病患者进行血液检验的临床意义
- 心律失常诊断中应用动态心电图的价值分析
- 心脏彩超在诊断多病因慢性心力衰竭时的临床应用分析
- 丙肝病毒核心抗原与抗体联合检测在丙型肝炎早期诊断中的应用
- 肌电图及神经电图在急性格林-巴利综合征中的应用
- 动态心电图与运动平板心电图诊断冠心病心肌缺血的对比
- 腹部全面超声检查在急腹症诊断中的价值
- 心内科护理中开展协同护理方案的应用体会研究
- 探究中医教学中大学生研究能力的培养方法 ?
- 合《伤寒论》探讨柴胡桂枝汤治疗胃疾的机理分析
- 对中医治疗消化内科疾病临床效果研究
- 浅析中医外治法从热敏灸治疗癌性疼痛
- 参附汤合苓桂术甘汤加味治疗冠心病心力衰竭的临床研究
- 温针灸治疗对慢性非特异性下背痛患者疼痛症状及患者QOL评分的影响
- 中医针灸治疗中风患者失眠症的疗效观察
- 加减地黄饮子治疗脑血栓形成恢复期的临床疗效
- 老年钙化性心脏瓣膜病的超声诊断效果探究
- 64层螺旋CT在心血管病诊断中应用探究
- 超声引导下泡沫硬化剂闭合交通静脉治疗下肢静脉性溃疡的临床应用研究
- 结节性甲状腺肿与甲状腺癌的超声鉴别诊断分析
- 多层螺旋CT在周围性肺癌与肺结核患者中的诊断鉴别研究
- 大便常规检验在季节性腹泻诊治中的应用
- 超声心动诊断老年性高血压心脏病临床诊断价值分析
- 核磁共振成像技术用于颅脑疾病诊断中的疗效评价
- 左西孟旦治疗急性失代偿性心力衰竭的疗效观察
- sizeableness
- sizeablenesses
- sizeably
- sized
- sizeist, sizist
- sizeless
- sizes
- size sb/sth up
- size sb/sth ↔ up
- size²
- size¹
- sizing
- sizzle
- sizzled
- sizzles
- sizzlingly
- skate
- skateable
- skateboard
- skateboarded
- skateboarder
- skateboarders
- skateboarding
- skateboardings
- skateboards
- x·o
- xì
- xìn
- xìng
- xìnɡ
- xí
- xíng
- xínɡ
- xù
- xùn
- xú
- xún
- xī
- xīn
- xīng
- xīnɡ
- xū
- xūn
- xǐ
- xǐng
- xǐnɡ
- xǔ
- x-〈
- x一代
- x型人才