杨重晖 尹程程 宋文博

摘要 目的:基于细胞色素C氧化酶亚基Ⅰ(COⅠ)序列建立一种新的PCR鉴定方法,以快速鉴别出梅花鹿、马鹿茸片与驯鹿茸片。方法:采集不同来源的鹿茸片共60批。通过比较梅花鹿、马鹿与驯鹿等其他伪品的COⅠ基因序列差异,根据SNP鉴别位点设计梅花鹿茸、马鹿茸同驯鹿茸的鉴别引物Cne-F、Rt-F、Co-R,并对影响聚合酶链反应(PCR)结果的主要因素变性时间、退火温度、退火时间、延伸时间等进行方法学考察和优化。结果:该实验构建的双位点特异PCR鉴别体系,基于COⅠ的鉴别位点,可通过PCR扩增获得294 bp的梅花鹿、马鹿特异片段,而产生514 bp的驯鹿特异片段,伪品及阴性对照无条带。结论:该实验建立对梅花鹿、马鹿及驯鹿等其他伪品鹿茸的PCR鉴别方法简便、可靠。
关键词 鹿茸;细胞色素C氧化酶亚基Ⅰ;DNA;位点特异性;聚合酶链反应;分子鉴定
Abstract Objective:To establish a new PCR identification method based on COI sequence to quickly identify sika deer,Malurong Tablets and Xunlurong Tables.Methods:A total of 60 batches of Lurong Tablets from different sources were collected.By comparing the difference of COI gene sequences between fakes such as sika deer,red deer and reindeer,the identification primers Cne-F,Rt-F and Co-R of sika deer,red deer and reindeer velvet antler were designed according to the SNP identification location site.The main factors of polymerase chain reaction (PCR) results,such as denaturation time,annealing temperature,annealing time,and extension time,were investigated and optimized.Results:The two-site specific PCR identification system constructed in this study,based on the COI identification site,can obtain 294 bp sika deer and red deer specific fragments by PCR amplification,and produce 514 bp reindeer deer specific fragments,New Zealand red deer and other pseudo-pars and negative and control strip-free band.Conclusion:This experiment established a simple and reliable PCR identification method for other fake Cornu Cervi Pantotrichum such as sika deer,red deer and reindeer.
Keywords Cornu Cervi Pantotrichum; COⅠ; DNA; Site-specific PCR; Polymerase chain reaction; Molecular identification
鹿茸為鹿科动物梅花鹿Cervus nippon Temminck或马鹿Cervus elaphus Linnaeus的雄鹿未骨化密生鸾毛的幼角[1],是吉林省名贵道地中药材,具有壮肾阳,益精血,强筋骨,调冲任,托疮毒等功效。鹿茸含有蛋白多肽类、糖类、生物胺类、甾体类等多种活性成分,具有提高机体免疫力、提高性功能、促进骨折的愈合、抗衰老等功能[2-6]。截至2019年12月,在国家食品药品监督管理总局(http://samr.saic.gov.cn/)查询到含鹿茸的药品已有107种,含鹿茸的保健食品已有15种。鹿茸药材的供不应求导致大量伪品药材流入市场,而与之相对应的鹿茸药材鉴定与产品质量控制体系并不完善。传统鉴定鹿茸的方法存在主观性较大、特异性不强、通用性差、对观察者经验的要求高等缺陷,不利于规范化、标准化方法的建立及普及[7-8]。近几年来,分子鉴定技术迅猛发展,成为传统鉴定方法的强有力补充。DNA条形码(DNA barcoding)技术是分子鉴定的最新发展,即通过比较一段通用DNA片段,对物种进行快速、准确的识别和鉴定[9-10]。DNA条形码技术不受物种、性别、发育阶段的影响,便于操作,易于标准化,准确性高,可以一次性快速鉴定大量样本。应用DNA条形码技术能够快速、准确鉴定鹿茸的真伪[11-15]。本研究基于鹿科动物COⅠ序列,在同一PCR反应体系中检测梅花鹿茸、马鹿茸与驯鹿茸,以期达到快速、准确的鉴定鹿茸真伪的目的,从源头控制鹿茸药材质量。
1 材料与仪器
1.1 材料
鹿茸样品购自吉林、新疆、河北、陕西等地,共计60份。样品材料基本情况见表1。
1.2 试剂
血液/细胞/组织基因组DNA提取试剂盒(天根生化科技有限公司,目录号:DP304-03);Ex Taq DNA Polymerase(宝日医生物技术有限公司,目录号:R060Q);2 000 bp DNA Marker(全式金生物技术有限公司,目录号:BM101-01);10×Loading Buffer(Takara,日本,目录号:9127),琼脂糖(Biowest,法国,目录号:YZQZT),溴化乙锭(源叶生物,目录号:R20975),50×TAE Buffer(Meilunbio,目录号:MA 0004);实验所需引物由吉林省库美生物技术有限公司合成。
1.3 仪器
恒温水浴锅(江南实验仪器厂,HH-2型);离心机(德国Eppendorf公司,MiniSpin型);电泳仪(日本TAKARA公司,Mupid-One型);凝胶成像系统(美国Wealtec公司,Dolphin-Doc型);核酸蛋白分析仪(日本岛津公司,Biospec-nano型)。
2 方法
2.1 鹿茸样品基因组DNA的提取
取鹿茸样品0.1 g,依次用1 mL 75%乙醇、l mL灭菌超纯水清洗,吸干表面水分,置于研钵中,加入液氮研磨成极细粉。取鹿茸样品极细粉70 mg,置于1.5 mL离心管中,使用天根血液/细胞/组织基因组DNA提取试剂盒提取DNA。提取步骤详见说明书,将DNA溶液收集到离心管中,即为鹿茸样品基因组DNA,置于-20 ℃冰箱中备用。
2.2 PCR扩增及序列测定
使用COI序列通用引物HCO2198:5′GGTCAACAAATCATAAAGATATTGG 3′,LCO1490:5′TGATTTTTTGGTCACCCTGAAAGTTTA 3′扩增鹿茸样品的COI序列,PCR反应体系在200 μL离心管中进行,反应总体积为25 μL,反应体系包括10×PCR缓冲液2.5 μL,MgCl2(0.002 5 mol/L)2 μL,dNTP(0.002 5 mol/L)2 μL,上游和下游引物(0.01 mol/L)各0.25 uL,模板DNA 500 ng,Taq DNA聚合酶1.0 U,加无菌双蒸水至25 μL,PCR反应参数为:94 ℃ 1 min;94 ℃ 1 min,45 ℃ 1.5 min,72 ℃ 1.5 min,5个循环;94 ℃ 1 min,50 ℃ 1.5 min,72 ℃ 1 min,35个循环;72 ℃ 5 min。将PCR产物送至吉林省库美生物技术有限公司进行序列测定。
2.3 系统邻接树构建
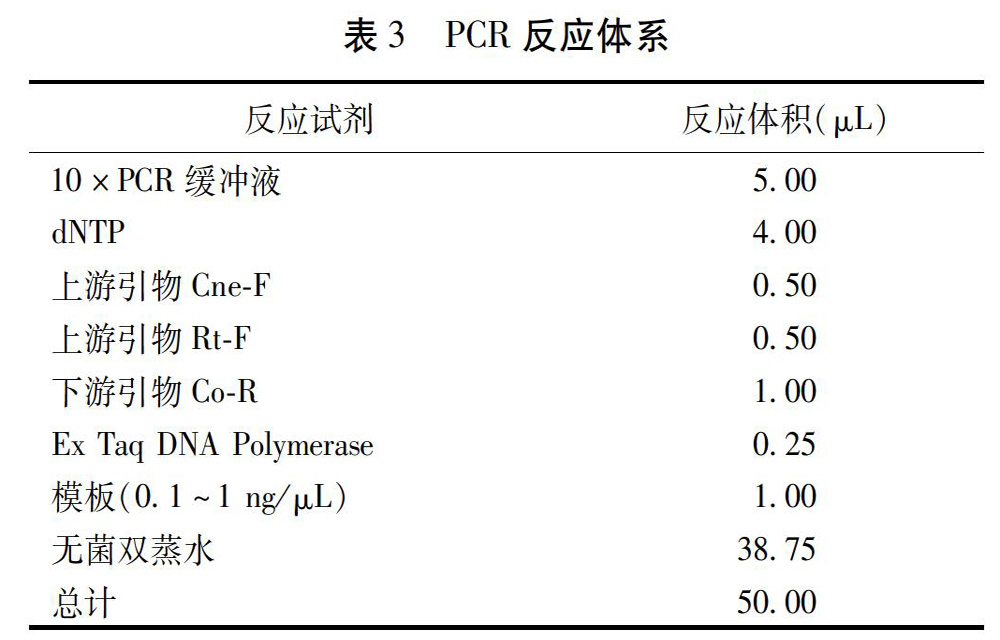
在NCBI中下载3条梅花鹿COI基因序列,3条马鹿COI基因序列,1条驯鹿COI基因序列。使用BioEdit软件将下载的序列同COI序列通用引物扩增产物测序结果进行序列比对;使用MEGA软件对序列比对结果进行系统邻接树(NJ树)的构建。通过系统邻接树信息分析,得到市售鹿茸真伪鉴定结果。
2.4 位点特异性PCR引物设计及PCR条件考察
根据测定的序列结果以及从NCBI中下载的梅花鹿茸、马鹿茸、驯鹿茸的COⅠ序列,使用BioEdit软件对COⅠ序列进行同源对齐,校对后分析梅花鹿茸、马鹿茸与伪品驯鹿茸的物种差异SNP位点,利用DNAman软件设计梅花鹿茸与马鹿茸,驯鹿茸的位点特异性鉴别引物,引物信息见表2。
为获得最优的位点特异性PCR反应条件,对其反应条件进行优化,分别考察DNA模板浓度(0.005 ng/μL、0.01 ng/μL、0.02 ng/μL、0.05 ng/μL、0.1 ng/μL、0.2 ng/μL、0.25 ng/μL、0.5 ng/μL、1 ng/μL、2 ng/μL)、退火时间(30 s、60 s、90 s)、退火温度(54 ℃、56 ℃、58 ℃、60 ℃、62 ℃)、PCR循环次数(31次循环、33次循环、35次循环、37次循环)、延伸时间(1 min、5 min、10 min)、聚合酶种类(2×Taq PCR MasterMix Polymerase、transFast Taq DNA Polymerase、Ex Taq DNA Polymerase、PrimeSTAR Max DNA Polymerase)对PCR反应的影响。反应体系为:DNA模板约500 ng,DNA聚合酶1.25~2.5 U,上游与下游引物各0.2 μmol/L,0.2 mmol/LdNTP,1×PCR Buffer(含Mg2+),加无菌水补足至25 μL。
2.5 鹿茸片PCR鉴别方法验证
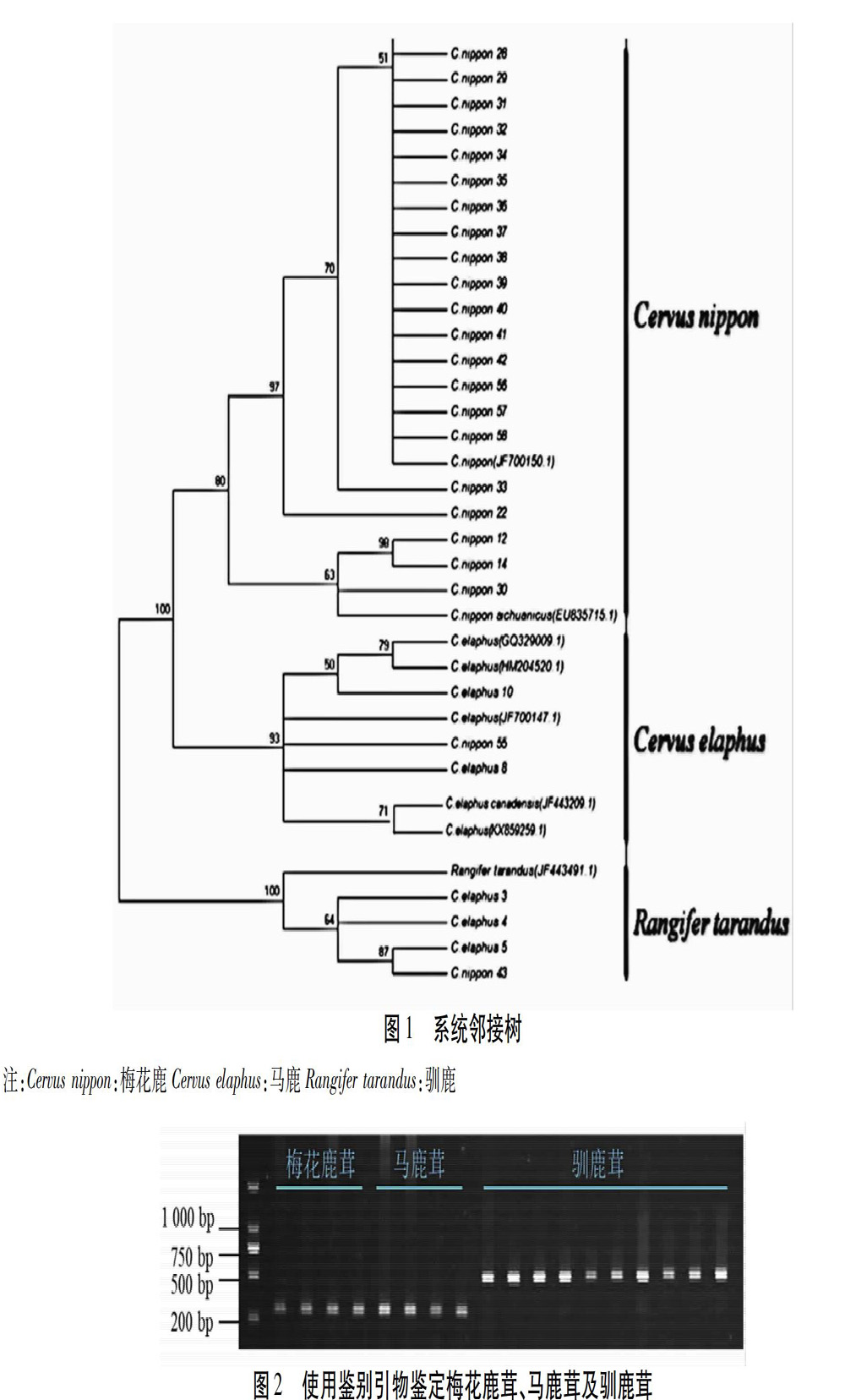
以4批梅花鹿茸、4批马鹿茸及10批驯鹿茸样品总DNA为模板,使用鉴别引物Cne-F、Rt-F及Co-R进行PCR扩增,参照《中华人民共和国药典》2015版[1]四部琼脂糖凝胶电泳法(通则0541),使用1%琼脂糖凝胶电泳检测PCR产物,PCR产物的上样量为2.5 μL,DNA分子量标记(400 ng/5 μL)上样量为2 μL。电泳结束后,取凝胶片在凝胶成像仪上或紫外透射仪上检视。
3 结果
3.1 系统邻接树信息分析结果
由于购买的市售鹿茸药材中一些鹿茸药材贮存状况不佳,导致基因组DNA降解,从收集的60份中仅成功提取到42份鹿茸样品DNA,经测序,得到36个鹿茸样品DNA测序结果,经鉴定,有4个鹿茸药材的实际鹿茸品种为驯鹿,与其商品标签标示鹿茸品种不符。而其他市售的的马鹿茸及梅花鹿茸种源明确,皆为正品。见图1。
3.2 PCR反应条件以及体系
最终确定PCR反应参数为:94 ℃预变性3 min,循环反应35次(94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min),72 ℃延伸5 min。PCR反应体系见表3。
3.3 鹿茸片PCR鉴别方法验证
梅花鹿茸及马鹿茸在凝胶电泳图谱中,应在294 bp处有单一DNA条带,常见伪品驯鹿茸在凝胶电泳图谱中,在514 bp处應有单一条带,空白对照无条带。见图2。
4 讨论
中国是世界上养鹿最早的国家,也是将鹿茸应用于医药保健事业最早的国家。目前,鹿茸作为一种名贵的中药材,已被广泛应用于我国中医、中药、生物制药、保健药品、保健食品等行业中。《中华人民共和国药典》2015版中明确规定梅花鹿茸及马鹿茸为鹿茸正品,由于市场需求连年增加,鹿场鹿茸产出量有限,一些不法分子利用驯鹿茸等其他鹿茸伪品以假乱真,伪品鹿茸与正品鹿茸同价不同效,导致临床应用以及相关产品疗效大打折扣,严重威胁着临床用药安全以及中药药品质量安全,传统的鹿茸鉴别手段主要有性状鉴别、理化鉴别等,这些鉴别手段一定程度上能够区分鹿茸正品与伪品[16-18],但是由于方法本身存在的局限性,仍然有一些伪品以及掺伪品无法准确鉴定。为了解决这一困境,急需开发一种高效、快速、准确的鹿茸鉴别方法。
DNA条形码技术是近年来迅速兴起的快速准确鉴定中药材的分子生物技术,已经广泛应用于动植物药的鉴别中,尤其适用于鉴别多基原中药。将分子鉴定技术应用于鹿茸鉴别,采用DNA条形码高效准确的鉴别鹿茸是近年来的研究热点。研究者开展了相关的研究:李明月等[19]针对梅花鹿茸及新西兰鹿鹿茸进行了特异性PCR鉴别研究,结果在相同条件下,2种鹿茸可以扩增出不同数目的条带,从而进行区分;钱润等[20]根据Cytb片段上的3个单核苷酸多态性(Single Nucleotide Polymorphism,SNP)变异位点建立了鹿茸鹿角特异性PCR鉴别方法以鉴别鹿茸、鹿角正品与其他伪品;魏艺聪等[21]基于COⅠ与SRY序列建立了梅花鹿、马鹿及其杂交鹿茸的分子鉴别方法;高丽君等[22]采用双重引物对鹿茸正伪品进行扩增鉴别,以上研究不同程度的实现了梅花鹿茸、马鹿茸的真伪鉴别。
驯鹿(Rangifer tarandus),又名角鹿,是鹿科驯鹿属下的唯一的动物。由于驯鹿茸片价格偏低并且外观容易与正品鹿茸片混淆,故而市售的商品鹿茸片中驯鹿茸片占有很大比例,有必要对其加以区分。本研究广泛收集了不同产地、厂家、批号的60批鹿茸样品,利用通用引物扩增测序,构建了系统邻接树,对市售鹿茸片进行了真伪鉴别;从NCBI中下载了梅花鹿、马鹿、驯鹿的COⅠ序列,设计出了梅花鹿茸和马鹿茸,驯鹿茸的位点特异性鉴别引物,考察了PCR反应条件及体系组成,同一个PCR反应体系中,可同时检测梅花鹿、马鹿茸和驯鹿茸的存在,建立了一种新的梅花鹿、马鹿茸片与伪品驯鹿茸片的PCR鉴定方法,实现了对鹿茸片的正品鉴别及伪品检出。本方法能够明确区分鹿茸正品与驯鹿伪品,鉴别结果与测序结果一致,说明所开发的PCR鉴别鹿茸方法准确可信。
该方法简单、快速,结果可靠,易于推广应用。
参考文献
[1]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:17.
[2]张蓉,刘春生,黄璐琦,等.鹿茸饮片的DNA条形码鉴别研究[J].中国药学杂志,2011,46(4):263-266.
[3]郭晓晗,程显隆,李明华,等.鹿茸的化学成分及质量控制方法研究进展[J].药物分析杂志,2018,38(4):551-565.
[4]王楠,高晓霞,代子彦,等.鹿茸药效物质基础、药理作用、临床应用及质量控制的研究进展[J].中草药,2017,48(22):4784-4790.
[5]王亚苹,张凯月,张辉,等.鹿茸炮制方法、化学成分以及药理作用研究进展[J].吉林中医药,2019,39(4):484-486.
[6]王玥玥,黄琼,庞宇涵,等.鹿茸药理作用及活性成分研究进展[J].现代养生(下半月版),2017,24(2):104-105.
[7]董世武,王磊,周永娜,等.鹿产品鉴别的研究进展[J].经济动物学报,2018,22(4):237-244.
[8]祝之友.鹿茸的药材鉴别[J].中国中医药现代远程教育,2018,16(18):90.
[9]Hebert PD,Ratnasingham S,deWaard JR.Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J].Proc Biol Sci,2003,270,24(1):S96-99.
[10]Hebert PD,Cywinska A,Ball SL,et al.Biological identifications through DNA barcodes[J].Proc Biol Sci,2003,270(1512):313-321.
[11]张辛宁,许亮,才丽平,等.鹿源中药材的DNA条形码鉴定研究进展[J].中国中医药现代远程教育,2017,15(16):144-146.
[12]崔丽娜,杜鹤,刘新成,等.基于COI条形码序列的鹿茸及其混伪品的DNA分子鉴定[J].吉林中医药,2012,32(4):384-387.
[13]姚辉,张辉,陈士林.《中国药典》收载动物药材DNA条形码鉴定研究策略与方法[J].中国现代中药,2019,21(9):1137-1146.
[14]贾静,石林春,徐志超,等.市售鹿茸粉药材的DNA条形码鉴定[J].药学学报,2015,50(10):1356-1361.
[15]高晓晨,刘冬,崔丽娜,等.市售鹿茸饮片及鹿茸粉的DNA条形码鉴定[J].吉林中医药,2016,36(7):706-708.
[16]张小冬,李垠含,刘颖.鹿茸的性状及显微鉴别[J].甘肃医药,2018,37(2):162-163.
[17]何琴.鹿茸及其伪品的性状鉴别[J].实用中医药杂志,2017,33(9):1102-1104.
[18]尹冬冬.鹿茸鑒别方法的比较研究[J].现代畜牧科技,2016(9):16.
[19]李明月,王倩雯,石瑶,等.梅花鹿鹿茸片及近源品种真伪鉴别[J].中国林副特产,2019,34(1):14-15.
[20]钱润,田娜,张雪艳,等.鹿茸、鹿角的位点特异性PCR鉴别[J].中国实验方剂学杂志,2019,25(17):118-123.
[21]魏艺聪,蒋超,袁媛,等.基于COI与SRY序列建立梅花鹿、马鹿及其杂交鹿茸的分子鉴别方法[J].中国中药杂志,2017,42(23):4588-4592.
[22]高丽君,何程远,李盈诺,等.基于双重PCR技术的鹿茸及其伪品DNA指纹特征和鉴定[J].吉林大学学报:医学版,2018,44(4):839-844.
- WTO“蓝箱”规则改革的新进展及我国的对策
- 公开固然重要,说理更显公正
- 论“后劳教时代”我国轻罪制度的建构
- 法益解释机能的司法实践
- 论程序性监督之嬗变
- 诉讼事件非诉讼化新探
- 审判阶段非法证据排除问题实证考察
- 转型中的中国犯罪论体系
- 论我国版权争议调解机制的基本模式及其治理路径
- 我国机动车之间交通事故归责原则之检讨
- 《侵权责任法》第54条解释论之基础
- 个案举证释明研究
- 通往“合理期间”之路
- 论法院的非司法化社会治理
- 论情理裁判的可普遍化证成
- 罗马破产法研究
- 现代性与后现代性之间的中国司法
- “卖契”概念应引入我国船舶登记法律
- 国际投资领域“间接征收”扩大化的成因及法律应对
- 再论卡尔沃主义的复活
- 论“因侵权而犯罪”与“因犯罪而侵权”
- 消费者反垄断诉讼的本源与我国应然之探
- 未决羁押人员人身安全保障制度研究
- 我国《国家审计准则》规范设置研究
- 行政法上请求权的体系及功能研究
- de-licensed
- de-licenses
- de-licensing
- delicious
- deliciouses
- deliciously
- deliciousness
- deliciousnesses
- delight
- communicativeness
- communicativenesses
- communicator
- communicators
- communing
- communion
- communionable
- communional
- communionist
- communions
- communique
- communiques
- communiqué
- communiqués
- communism
- communism, communism
- 饬正
- 饬治
- 饬法
- 饬禁
- 饬纳
- 饬蛊
- 饬装
- 饬诫
- 饬责
- 饬身
- 饬驾
- 饭
- 饭q
- 饭、菜等变质而发出酸臭味
- 饭不想吃,茶不思饮
- 饭不熟不揭锅
- 饭不熟,不揭锅
- 饭丸
- 饭交活动
- 饭人
- 饭会
- 饭僧
- 饭养身,歌养心
- 饭前便后洗净手,各种病菌不入口
- 饭前先喝汤,胜过良药方