王宽 刘慧荣 吴焕淦 张英英 翁志军 秦秀娣 赵继梦 吴璐一

摘要? 目的:從维生素D参与免疫调节作用角度探讨隔药灸治疗UC的作用机制。方法:采用4%葡聚糖硫酸钠制备UC大鼠模型。将动物随机分为:正常组、模型组、隔药灸组和SASP组。观察各组大鼠DAI评分、结肠大体形态损伤评分及结肠组织病理学(HPS)评分、大鼠血清及结肠组织25(OH)D3、VDR浓度;检测大鼠结肠组织炎性细胞因子IFN-γ、TNF-α的表达和大鼠结肠组织VDR、RXRα mRNA的表达;分析25(OH)D3与治疗后DAI评分、结肠IFN-γ、TNF-α表达之间的相关性。结果:隔药灸显著降低UC大鼠DAI评分、结肠大体形态损伤评分及HPS评分( P <0.05);隔药灸显著升高UC大鼠血清和结肠中25(OH)D3、VDR浓度( P <0.05),以及结肠组织中VDR、RXRαmRNA表达( P <0.05);隔药灸降低UC大鼠结肠组织中IFN-γ、TNF-α表达水平( P <0.05)。大鼠血清25(OH)D3浓度与治疗后DAI评分呈负相关,结肠25(OH)D3浓度分别与结肠IFN-γ、TNF-α表达呈显著负相关。结论:隔药灸可抑制UC大鼠结肠IFN-γ、TNF-α的表达,升高其血清和结肠中的维生素D及其受体的浓度;UC大鼠肠道炎症与低浓度的维生素D呈负相关。
关键词? 隔药灸;溃疡性结肠炎;25羟基维生素D3;维生素D受体;γ干扰素;肿瘤坏死因子-α
Study on the Effects of Vitamin D Participation in Herb-partitioned Moxibustion of Rats with Ulcerative Colitist
WANG Kuan1,LIU Huirong1,WU Huangan1,ZHANG Yingying1,WENG Zhijun1,QIN Xiudi1,ZHAO Jimeng1,WU Luyi2
(1 Key Laboratory of Acupuncture-Moxibustion and Immunological Effects,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China; 2 Shanghai Qigong Research Institure,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract Objective: From the perspective of vitamin D′s participation in immune regulation,the mechanism of herb-partitioned moxibustion in the treatment of UC was discussed. Methods: The UC rat model was prepared with 4% dextran sodium sulfate.The animals were randomly divided into:a normal group,a model group,a herb-partitioned moxibustion group and a SASP group.Observe the DAI score,gross morphological damage score of the colon,and histopathology(HPS)score of each group of rats,the concentration of 25(OH)D3 and VDR in rat serum and colon tissue; detect the inflammatory cytokine IFN-,TNF-α in rat colon tissue and the expression of TNF-α and the expression of VDR and RXRα mRNA in rat colon tissue; analyze the correlation between 25(OH)D3 and DAI score,colon IFN-γ and TNF-α expression after treatment. Results: Herb-partitioned moxibustion significantly reduced the DAI score,gross morphological damage score and HPS score of UC rats( P <0.05); herb-partitioned moxibustion significantly increased the concentration of 25(OH)D3 and VDR in the serum and colon of UC rats( P <0.05),and the expression of VDR and RXRαmRNA in colon tissue( P <0.05); herb-partitioned moxibustion reduced the expression levels of IFN-γ and TNF-α in colon tissue of UC rats( P <0.05).The serum 25(OH)D3 concentration in rats was negatively correlated with the DAI score after treatment,and the colonic 25(OH)D3 concentration was significantly negatively correlated with the expression of colon IFN-γ and TNF-α. Conclusion: Herb-partitioned moxibustion could inhibit the expression of IFN-γ and TNF-α,and significantly increase the concentration of vitamin D and its receptors in the serum and colon; intestinal inflammation in UC rats is negatively correlated with low concentrations of vitamin D.
Keywords? Herb-partitioned Moxibustion; Ulcerative Colitis; 25(OH)D3; Vitamin D receptor; IFN-γ; TNF-α
中图分类号:R245.8 文献标识码:A? doi: 10.3969/j.issn.1673-7202.2020.14.007
溃疡性结肠炎(Ulcerative Colitis,UC)属炎症性肠病(Inflammatory Bowel Disease,IBD)范畴。UC是一种以反复发作的腹痛、腹泻,伴黏液脓血便和不同程度的全身症状为主要临床表现的慢性非特异性炎症性肠道疾病,主要发生在直肠、结肠黏膜和黏膜下层等部位,主要表现为溃疡形成,隐窝脓肿或炎性反应,杯状细胞减少以及各类炎性反应细胞浸润等非特异性病理改变。该病为消化内科常见疑难病,病程漫长,且逐年加重,久治难愈。目前UC的病因和发病机制仍不完全清楚,临床对于UC也缺乏特异性的治疗手段,而中医针灸可有效改善UC的炎性反应表现,对治疗UC具有一定的优势[1-3]。
新近的流行病学调查研究显示[4-5],IBD的发生正呈现出全球化的变化趋势,在亚洲及亚太地区国家,UC的发生较CD更为普遍,而且随着人类生活水平的不断提高,UC患者病例的报道数量也不断增多,UC的发病率和患病率已经呈现出了逐年上升的趋势[6]。在近10年里,越来越多的国内外研究学者对维生素D与免疫学的关系表现出了极大的科学兴趣和研究热潮, 维生素D参与治疗机体免疫系统相关疾病(如炎症性肠病)的课题也逐渐被人们所关注并加以深入研究[7]。维生素D除了传统的调节机体钙、磷代谢的作用外,其在炎症性肠病的发生发展过程中所起到的抗感染以及免疫调节的作用也具有十分重要的地位[8-9]。因此,本研究拟从维生素D参与免疫调节作用角度探讨隔药灸治疗UC的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物
40只健康成年雄性SD大鼠,体质量(170±10)g,SPF级,由上海中医药大学动物实验中心提供[动物许可证号:SCXK(京)2012-0001],适应性喂养7 d。饲养环境为12 h昼夜节律交替、室内温度控制在(20±2)℃,室内湿度控制在50% ~70%。所有实验流程均经上海中医药大学动物研究伦理委员会批准。
1.1.2 药物
柳氮磺砒啶肠溶片(SASP,上海信谊天平药业有限公司,国药准字H31020557)。
1.1.3 试剂与仪器
葡聚糖硫酸钠(DSS)(分子量:36 000~50 000,MP Biomedicals公司,美国,货号:9011-18-1),液体石蜡(国药集团化学试剂有限公司,货号:30139828),戊巴比妥钠(Sigma公司,美国,货号:P3761),苏木素-伊红(南京建成科技有限公司, 货号:D006),中性树胶(国药集团化学试剂有限公司,货号:10004160),大鼠VDR ELISA试剂盒(上海源叶生物科技有限公司,货号:S0000-96T),大鼠25(OH)D3 ELISA试剂盒(上海源叶生物科技有限公司,货号:S0000-96T),IFN-γ抗体(北京博奥森生物技术有限公司,货号:bs-0480R),TNF-α抗體(武汉博士德生物工程有限公司,货号:BA14901),二抗[基因科技(上海)有限公司,货号:GP016029],Trizol(Invitrogen公司,美国,货号:15596026),RNase-free Water(QIAGEN公司,德国,货号:129112),随机引物(Invitrogen公司,美国,货号:48190011),RNA酶抑制剂(Invitrogen公司,美国,货号:AM2684),RT-PCR试剂盒(AMV)(Invitrogen公司,美国,货号:12594100),2×Sybrgreen PCR mix(QIAGEN公司,德国,货号:330520),TBE缓冲液(上海威奥生物科技有限公司,货号:WH1183),6×上样缓冲液(上海威奥生物科技有限公司,货号:RT201),多功能酶标仪(BioTek公司,美国,型号:Synergy H4 Hybrid),高速冷冻离心机(Thermo Fisher公司,美国,型号:ST16R),通用台式离心机(Thermo Fisher公司,美国,型号:ST16),凝胶图像分析系统(Bio-Rad公司,美国,型号:ChemiDocTM XRS+),酶标仪数据获取及分析软件(BioTek公司,美国),Real-time检测仪(Applied Biosystems,美国,型号:ABI-7300)。
1.2 方法
1.2.1 分组与模型制备
将40只SD大鼠完全随机分为2部分:正常大鼠( n =10)和UC模型大鼠( n =30)。根据国际公认的方法[10-11]来制备UC大鼠模型,具体方法为:将DSS(MPBIO,美国)溶于大鼠每日的饮用水中,配置成4% DSS(wt/vol)溶液,自由饮用7 d。造模过程中模型组大鼠先后有2只死亡,造模结束后随机抽取2只模型组和2只正常组,观察大鼠体质量及大便性状,观察大鼠DAI及大体形态损伤评分,并做HE染色观察结肠组织病理学变化,以确认模型是否制备成功,待UC大鼠模型制备成功后,依据大鼠DAI评分及体质量、便血情况,对模型组大鼠进行筛选处理(弃掉2只),确保24只UC模型大鼠后再继续下一步实验。
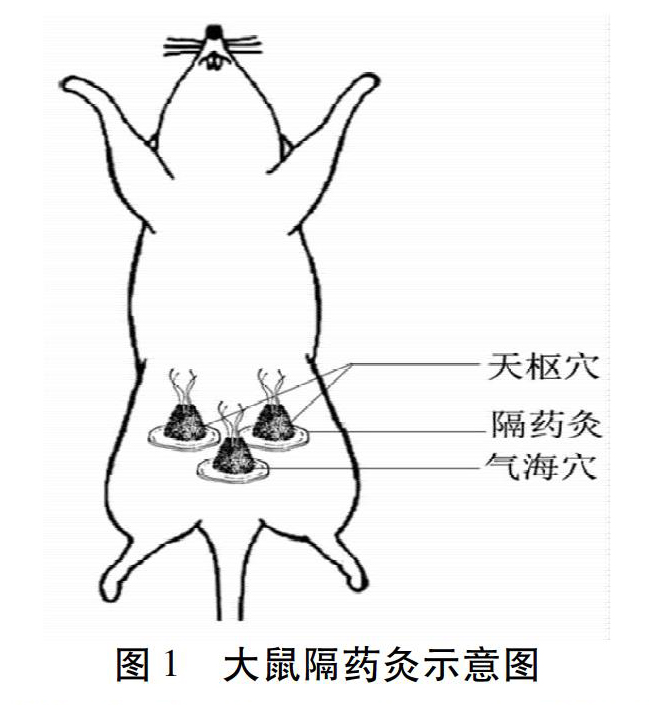
在成功制备实验性UC大鼠模型的基础上,采用随机设计方法,将模型大鼠随机分成模型组、隔药灸组和SASP组,同时设立正常组,每组8只。1)正常组:与隔药灸组同样抓取固定,不做其他处理。2)模型组:继续以1%DSS溶液维持大鼠UC的状态。与隔药灸组同样抓取固定,不做其他处理。3)艾灸组:采用隔药灸,取天枢穴(双)和气海穴,具体定位参照《实验针灸学》[12]及相关文献[13-14]。神阙穴定位在腹正中线上,剑突与耻骨联合上缘连线的上2/3与下1/3交点处。天枢穴定位在脐中旁开约0.5 cm。气海穴定位在脐下约1.0 cm。4)SASP组:参照《药理实验方法学》[15],每日称量大鼠体质量,并根据体质量按27 mg/100 g计算SASP剂量,通过大鼠灌胃的方式补充SASP,1次/d,共治疗7 d。
1.2.2 干预方法
选择天枢穴(双)和气海穴实施隔药灸,详细治疗方案参考有关文献[23-25]制定。药饼是将含有附子、肉桂、丹参、红花、木香、黄连等中药成分的药粉配以适量的黄酒,调和均匀,用相同规格的模具做成直径1.0 cm,厚0.5 cm大小的药饼备用。艾炷以精制艾绒(南阳汉医艾绒有限责任公司)制成,直径0.6 cm、高0.6 cm,重约90 mg,呈圆锥状。施灸时,先将药饼置于大鼠穴位上,再将艾炷放置于药饼上,点燃施灸。灸治1次/d,每次每穴各灸2壮,共治疗7 d。
干预结束后,以2%戊巴比妥钠腹腔注射(0.2 mL/100 g)麻醉大鼠,待大鼠麻醉完全后,迅速剖开大鼠腹腔并充分暴露腹主动脉,用10 mL注射器取血,取血量在5~8 mL,缓慢移至10 mL离心管中,室温静置2 h后移至4 ℃离心机中,按3 000 r/min离心20 min,取上清液并分装至EP管中,统一转移至-80 ℃保存;大鼠取完血之后,马上截取大鼠回盲部至肛门上3 cm处的全结肠,并沿肠系膜纵行剖开,用冰生理盐水清洗,观察结肠大体形态,并拍照记录;在结肠大体形态评分完成后,将取下的结肠平均切成长1 cm的结肠段,除距肛门4~5 cm结肠段放于4%多聚甲醛溶液中固定外,其余结肠段均分别放于冻存管中,编号保存至-80 ℃冰箱中备用。
1.2.3 检测指标与方法
1.2.3.1 疾病活动指数(DAI)
每天观察大鼠的精神状态、体质量、活动情况、毛发光泽度、食欲、大便性状等,并依据Lagishetty V等[16]制定的DAI评分标准,每日测量大鼠的体质量,大便性状和潜血情况(肉眼血便),并记录。见表1。
1.2.3.2 组织学观察和病理学评分
1)结肠大体形态损伤评分:大鼠处死后,截取大鼠回盲部至肛门上3 cm处的全结肠,并沿肠系膜纵行剖开,用冰生理盐水清洗,依据Wallace JL等[17]制定的标准对结肠进行大体形态损伤评分。见表2。
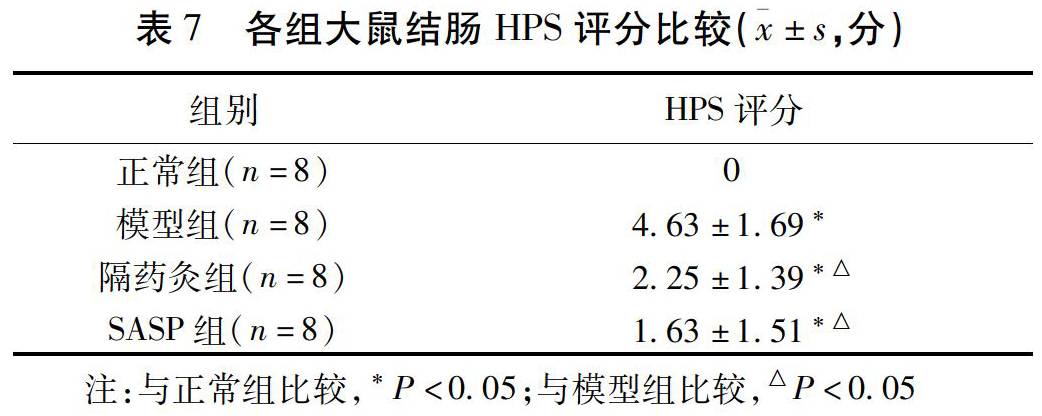
2)结肠组织病理学评分(HPS):大鼠结肠组织经4%多聚甲醛固定液固定24 h后,脱水,进行石蜡包埋及石蜡切片,切片厚4 μm,进行HE染色,观察结肠组织的病理学改变,并按照Cooper HS等[18]制定的组织病理学评分标准进行评分记录。见表3。
1.2.3.3 苏木精-伊红染色法(Hematoxylin-eosin Staining,HE)
结肠组织切片常规脱蜡至水;苏木素(南京建成生物有限公司)染色90 s;流水冲10 min;盐酸乙醇分化2 s;流水冲洗5 min;伊红(南京建成生物有限公司)染色5 min;梯度乙醇脱水;二甲苯透明;中性树胶封片;Olympus-BX53显微镜下观察,采集图片。
1.2.3.4 酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)
分别将不同浓度的标准品 依次加入微孔酶标板(96孔)中(50 μL);除空白孔外,酶标板样本孔中依次加入待测样本各10 μL,再加入样本稀释液各40 μL;然后,依次加入HRP标记的一抗25(OH)D3和VDR(上海源叶生物科技有限公司),空白孔不加;将酶标板置于37 ℃恒温箱中温育60 min后,将酶标板倒置在吸水纸上适当拍打,直至拍干;每孔中加入稀释好的洗涤液,静置1 min后棄去洗涤液,拍干,如此重复5次;每个孔中依次加入试剂盒底物A、B,将酶标板置于37 ℃恒温箱中避光孵育15 min;最后加入终止液50 μL,置于酶标仪中检测每孔的OD值(波长450 nm),根据标准曲线计算出样本浓度。
1.2.3.5 RT-PCR
结肠组织总RNA抽提,组织匀浆,采用Trizol法提取总RNA,检测浓度、纯度、完整性,取相等量的总RNA,采用SYBRGreen PCR试剂盒(QIAGEN,德国,货号:208052)、cDNA synthesis试剂盒(Invitrogen,美国)逆转录cDNA,所用引物序列如下:GAPDH-F,GGCAAGTTCAACGGCACAGT;GAPDH-R,ATGACATACTCAGCACCGGC;VDR-F,AAGCTGGTGGAAGCCATTCA;VDR-R,TCGGCCAGTTTCTGGATCAT;RXRα-F,TCGCTGTTGAGCCCAAGACT;RXRα-R,GGCCCACTCCACAAGAGTGA。扩增条件为:95 ℃ 2 min,94 ℃ 10 s,60 ℃ 10 s,72 ℃ 40 s,40个循环。
1.2.3.6 免疫组织化学法(Immunohistochemistry,IHC)
采用免疫组织化学(IHC)方法检测大鼠结肠IFN-γ、TNF-α炎性细胞因子的表达情况。组织切片用磷酸盐缓冲液(PBS)冲洗3次5 min,室温下暴露于3%H2O2中15 min,以抑制内源性过氧化物酶。用0.01 m PBS洗涤3次5 min后,标本滴加已稀释的一抗IFN-γ(北京博奥森生物技术有限公司)和TNF-α(武汉博士德生物工程有限公司),4 ℃孵育过夜。将标本加热30 min,用0.01 mol/L PBS洗涤3次5 min,在室温下与二抗(基因科技(上海)有限公司)孵育30 min,用0.01 M PBS洗涤3次5 min后,加入3,3-二氨基联苯胺(DAB)显色液。然后,用中性胶密封切片,在光镜下进一步观察,使用Image-Pro Plus 6.0图像分析系统进行半定量分析。
1.3 统计学方法
采用SPSS 21.0统计软件进行统计学分析。若实验数据服从正态分布,则用来表示;若实验数据不服从正态分布,则用M(QU-QL)表示。数据同时满足正态性及方差齐性条件时,统计方法采用单因素方差分析(One-way ANOVA),并进一步作多个样本均数间的两两比较(LSD检验)。数据不同时满足正态性及方差齐性时,采用非参数检验中的Kruskal-Wallis H检验,多个样本间的两两比较采用Nemenyi法。(Deluca and Cantorna 2001)对实验数据进行相关性分析,若2个变量均为连续性变量,则用Pearson相关分析;若2个变量均为分类变量,或其中一个为分类变量,或对原始数据总体分布不明,则用Spearman相关分析。以r表示相关系数,以α=0.05为检验水准,以 P <0.05为差异有统计学意义。
2.8 相关性分析
经Spearman相关分析,结果表明大鼠血清25(OH)D3浓度与治疗后大鼠DAI评分之间呈负相关(r=-0.479, P =0.006)。经Pearson相关分析,结果表明大鼠结肠25(OH)D3浓度与结肠组织IFN-γ、TNF-α表达之间均呈负相关关系(r=-0.442, P =0.011、r=-0.362, P =0.042)。见图12。
3 讨论
UC是消化内科的常见疾病,属西医病名,古代中医典籍中并没有明确的病名记载,亦无结肠炎称谓。由中华中医药学会脾胃病分会于2010年审定的“溃疡性结肠炎中医诊疗共识意见” 中指出,可将其归属于“休息痢”“久痢”“肠澼”等 病范畴[19]。艾灸疗法是中医特色针灸疗法中的重要组成部分,灸法在临床上的应用甚为广泛,而且疗效显著[20-22]。通过分析针灸干预UC的随机对照试验的相关文献报道[23-24],指出针灸治疗UC疗效优于西药,且具有不良反应少、安全性高等优势。Kim SY等[25]专门针对1998—2008年PubMed上有关灸法的随机对照研究进行了系统的评价,明确指出艾灸治疗UC的疗效明显优于药物治疗。Wu HG等[26]将46例UC患者纳入研究,并随机分为隔药灸组和SASP组,结果显示,2组治愈率比较差异有统计学意义( P <0.01)。宋宸宇等[27]研究中共纳入脾肾阳虚型UC患者60例,分别经艾灸治疗和口服SASP治疗,结果显示,2组间疗效比较差异有统计学意义( P <0.05),这些研究提示艾灸治疗脾肾阳虚型UC疗效显著。我们的研究结果提示,隔药灸显著降低了UC大鼠的疾病活动指数,缓解了结肠黏膜炎性反应,其治疗效应与SASP相当,这与以往研究结果一致。
在艾灸治疗UC相关的免疫学机制研究方面,Zhou EH等[28]研究中共纳入UC患者109例作为研究对象,随机分为隔药灸组和隔麸灸组,指出隔药灸对IL-8、ICAM-1及其mRNA表达的抑制作用可能是艾灸改善UC肠道炎性反应的重要途径之一。刘慧荣等[29]观察隔药灸对UC患者结肠黏膜TNF-α及COX-2表达的影响,结果发现隔药灸可通过抑制结肠黏膜中TNF-α表达,减少COX-2产生,进而改善UC患者肠道炎性反应。此外,Wu HG等[30-34]多项研究表明,隔药灸治疗UC可能是通过抑制结肠上皮细胞凋亡,促进中性粒细胞凋亡, 改善结肠黏膜中促炎细胞因子与抗炎细胞因子之间的平衡状态,调节结肠Bcl-2、Bax及Fas、FasL蛋白表达,从而修复结肠黏膜损伤,减轻或消除UC肠道炎性反应。本研究结果显示,隔药灸显著抑制了结肠IFN-γ、TNF-α炎性细胞因子释放,缓解UC大鼠肠道炎性反应。
维生素D可以通过调节机体免疫系统的发育和功能,直接或间接抑制IBD致病T细胞的功能,从而减弱或抑制IBD的进一步发展[35]。维生素D3通过与血浆中的维生素D结合蛋白(Vitamin D Binding Protein,DBP)结合,经肝脏转化为25(OH)D3,后经肾脏最终转化为1,25-(OH)2D3[36-37]。25(OH)D3是维生素D在人体内的主要循环形式,1,25-(OH)2D3则是维生素D在人体内的主要效应形式。而1,25-(OH)2D3需依赖于维生素D受体(Vitamin D Receptor,VDR)来发挥它的生物学效应[38]。1,25-(OH)2D3可以直接作用于Th1和Th17细胞等,下调IL-17和IFN-γ等促炎性细胞因子,同时上调Th2细胞因子IL-4等[39-40],从而抑制体内的炎性反应。在众多与UC发生发展相关的因素中,感染和免疫异常是目前比较公认的可影响UC发病的关键因素[41]。维生素D除了可以调节机体免疫系统紊乱的功能之外,还具有一定的抗感染作用,在发挥抗感染和调节机体免疫紊乱的相互作用下,维生素D可具体参与调节UC肠道炎性反应及相关Th亚群细胞炎性因子水平,抑制疾病状态,同时促进肠道黏膜修复,调节机体免疫稳态,从而进一步达到缓解或治疗目的。体外实验表明,CD4+T细胞在缺乏维生素D时,可诱发IL-17细胞的大量分泌,而1,25-(OH)2D3则可以抑制Th17细胞的功能,具體表现在可下调IL-17mRNA表达,IL-17细胞分泌受到抑制,炎性反应即可得到一定的改善[42-43]。本实验结果显示,模型组大鼠血清及结肠组织中25(OH)D3、VDR浓度明显低于正常组,而模型组大鼠结肠IFN-γ、TNF-α表达明显高于正常组;隔药灸组大鼠血清及结肠组织中25(OH)D3、VDR浓度明显高于模型组,而隔药灸组大鼠结肠IFN-γ、TNF-α表达明显低于模型组。表明隔药灸可显著调节UC大鼠血清及结肠25(OH)D3、VDR浓度,能明显抑制UC大鼠结肠IFN-γ、TNF-α表达,提示维生素D可能参与隔药灸对UC大鼠结肠IFN-γ、TNF-α促炎性细胞因子的抑制作用,维生素D的免疫调节作用可能是隔药灸对UC起效机制的重要环节。
机体维生素D与某些免疫系统紊乱性疾病之间存在较高的易感性,而维生素D缺乏在处于活动期和缓解期的IBD患者中均普遍存在,而且维生素D缺乏与疾病的活动程度具有一定的相关性[44]。本实验中,相关性分析结果表明大鼠血清25(OH)D3浓度与治疗后大鼠DAI评分之间呈负相关,这说明随着大鼠DAI评分的升高,大鼠血清25(OH)D3浓度则会保持下降的趋势,这与UC患者中普遍存在维生素D缺乏的结论相一致;大鼠结肠25(OH)D3浓度与结肠组织IFN-γ、TNF-α表达之间均呈负相关,IFN-γ、TNF-α均为促炎性细胞因子,可介导机体多种免疫反应,参与破坏肠道黏膜屏障,加重UC的肠道的炎性反应以及疾病活动程度,而IFN-γ、TNF-α与25(OH)D3的负相关关系则说明维生素D可通过抑制炎性细胞的增值分泌参与调节机体的免疫反应,改善UC的疾病状态;大鼠结肠VDR mRNA水平与结肠组织IFN-γ、TNF-α表达之间也呈负相关,说明维生素D与VDR均参与了上述调节IFN-γ、TNF-α炎性细胞因子的过程。
本研究主要通过研究维生素D在隔药灸治疗UC大鼠过程中对结肠IFN-γ及TNF-α炎性细胞因子表达所发挥的相关免疫调节作用,初步探讨了维生素D与免疫之间的关系,证实UC大鼠中存在维生素D缺乏。因受时间、技术等因素所限,相关免疫学指标不够全面,维生素D相关的免疫学作用机制未能完全阐明,有关维生素D在隔药灸治疗UC过程中具体作用途径的研究也未能深入展开,后续可结合多种现代科学技术,交叉并借鉴多学科理论,从不同角度对维生素D的免疫调节作用加以探讨,维生素D的补充标准及其安全性也需开展相关研究加以规范和完善。继续深入研究维生素D与UC之间的关系,将有助于进一步揭示UC的发病机制,同时也将为进一步阐释灸法作用的起效机制提供一定的理论与实践依据,以期提高艾灸临床疗效。
参考文献
[1] Song G,Fiocchi C,Achkar JP.Acupuncture in inflammatory bowel disease [J].Inflamm Bowel Dis,2019,25(7):1129-1139.
[2]Stein DJ.Massage Acupuncture,Moxibustion,and Other Forms of Complementary and Alternative Medicine in Inflammatory Bowel Disease [J].Gastroenterol Clin North Am,2017,46(4):875-880.
[3]Cheifetz AS,Gianotti R,Luber R,et al.Complementary and Alternative Medicines Used by Patients With Inflammatory Bowel Diseases[J].Gastroenterology,2017,152(2):415-429.
[4]de Silva P,Korzenik J.The changing epidemiology of inflammatory bowel disease:identifying new high-risk populations [J].Clin Gastroenterol Hepatol,2015,13(4):690-692.
[5]Ng S C.Epidemiology of inflammatory bowel disease:focus on Asia [J].Best Pract Res Clin Gastroenterol,2014,28(3):363-372.
[6]中華医学会消化病学分会炎症性肠病学组.我国炎症性肠病诊断与治疗的共识意见[J].内科理论与实践,2013,8(1):61-75.
[7]Hewison M.Vitamin D and the Immune System:New Perspectives on an Old Theme [J].Endocrinology and Metabolism Clinics of North America,2010,39(2):365-379.
[8]Ham NS,Hwang SW,Oh EH,et al.Influence of Severe Vitamin D Deficiency on the Clinical Course of Inflammatory Bowel Disease [J].Dig Dis Sci,2020,6:313.
[9]Aksan A,Tugal D,Hein N,et al.Measuring Vitamin D Status in Chronic Inflammatory Disorders:How does Chronic Inflammation Affect the Reliability of Vitamin D Metabolites in Patients with IBD? [J].J Clin Med,2020,9(2):E547.
[10] Kimura I,Nagahama S,Kawasaki M,et al.Study on the experimental ulcerative colitis(UC)model induced by dextran sulfate sodium(DSS)in rats(2)[J].Nihon Yakurigaku Zasshi,1995,105(3):145-152.
[11]Ren K,Yuan H,Zhang Y,et al.Macromolecular glucocorticoid prodrug improves the treatment of dextran sulfate sodium-induced mice ulcerative colitis [J].Clin Immunol,2015,160(1):71-81.
[12]李忠仁.实验针灸学[M].北京:中国中医药出版社,2007.242-257.
[13]李春华,刘玉祁,张鹏,等.“十一五”期间国内腧穴定位研究进展[J].中华中医药学刊,2013,31(2):261-262.
[14]王海军,冀来喜.关于大鼠“神阙”穴的定位[J].针刺研究,2007,32(5):312.
[15]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2001:1859-1861.
[16]Lagishetty V,Misharin A V,Liu N Q,et al.Vitamin D deficiency in mice impairs colonic antibacterial activity and predisposes to colitis [J].Endocrinology,2010,151(6):2423-2432.
[17]Wallace J L,Keenan C M.An orally active inhibitor of leukotriene synthesis accelerates healing in a rat model of colitis [J].Am J Physiol,1990,258(4 Pt 1):G527-G534.
[18]Cooper H S,Murthy S N,Shah R S,et al.Clinicopathologic study of dextran sulfate sodium experimental murine colitis [J].Lab Invest,1993,69(2):238-249.
[19]张声生.溃疡性结肠炎中医诊疗共识意见[J].中华中医药杂志,2010,25(6):891-895.
[20]黄琴峰,吴焕淦,刘婕,等.灸法疾病谱现代文献计量分析与评价[J].上海针灸杂志,2012,31(1):1-5.
[21]吴焕淦,马晓芃,周次利,等.灸法研究现状与战略思考[J].世界中医药,2013,8(8):845-851.
[22]朱学亮,檀占娜,李伯英,等.基于数据挖掘的不同灸法临床应用病种的比较研究[J].中国针灸,2014,34(9):879-883.
[23]穆敬平,吴焕淦,张志权,等.针灸治疗溃疡性结肠炎的Meta分析[J].中国针灸,2007,27(9):687-690.
[24]Joos S,Wildau N,Kohnen R,et al.Acupuncture and moxibustion in the treatment of ulcerative colitis:a randomized controlled study [J].Scand J Gastroenterol,2006,41(9):1056-1063.
[25]Kim S Y,Chae Y,Lee S M,et al.The effectiveness of moxibustion:an overview during 10 years [J].Evid Based Complement Alternat Med,2011,2011:306515.
[26]Wu H G,Zhou L B,Shi D R,et al.Morphological study on colonic pathology in ulcerative colitis treated by moxibustion [J].World J Gastroenterol,2000,6(6):861-865.
[27]宋宸宇,劉丽爽.艾灸治疗脾肾阳虚型溃疡性结肠炎30例临床体会[J].亚太传统医药,2015,11(18):98-99.
[28]Zhou E H,Liu H R,Wu H G,et al.Down-regulation of protein and mRNA expression of IL-8 and ICAM-1 in colon tissue of ulcerative colitis patients by partition-herb moxibustion [J].Dig Dis Sci,2009,54(10):2198-2206.
[29]刘慧荣,施达仁,吴焕淦,等.隔药灸对溃疡性结肠炎患者结肠黏膜COX-2 TNF-α表达的影响[J].中医药学刊,2005,23(6):989-992.
[30]Wu H G,Zhou L B,Pan Y Y,et al.Study of the mechanisms of acupuncture and moxibustion treatment for ulcerative colitis rats in view of the gene expression of cytokines [J].World J Gastroenterol,1999,5(6):515-517.
[31]Wu H G,Zhou L B,Shi D R,et al.Morphological study on colonic pathology in ulcerative colitis treated by moxibustion [J].World J Gastroenterol,2000,6(6):861-865.
[32]Wu H G,Gong X,Yao L Q,et al.Mechanisms of acupuncture and moxibustion in regulation of epithelial cell apoptosis in rat ulcerative colitis [J].World J Gastroenterol,2004,10(5):682-688.
[33]Wu H,Liu H,Tan L,et al.Electroacupuncture and Moxibustion Promote Neutrophil Apoptosis and Improve Ulcerative Colitis in Rats [J].Digestive Diseases and Sciences,2007,52(2):379-384.
[34]吴焕淦,黄臻,刘慧荣,等.针灸对大鼠溃疡性结肠炎结肠上皮细胞凋亡影响的实验研究[J].中国针灸,2005,25(2):51-54.
[35]Reich K M,Fedorak R N,Madsen K,et al.Vitamin D improves inflammatory bowel disease outcomes:basic science and clinical review [J].World J Gastroenterol,2014,20(17):4934-4947.
[36]Holick M F.Vitamin D Deficiency [J].New England Journal of Medicine,2007,357(3):266-281.
[37]Raman M,Milestone A N,Walters J R F,et al.Vitamin D and gastrointestinal diseases:inflammatory bowel disease and colorectal cancer [J].Therapeutic advances in gastroenterology,2011,4(1):49-62.
[38]Pike J W,Meyer M B.The vitamin D receptor:new paradigms for the regulation of gene expression by 1,25-dihydroxyvitamin D3 [J].Rheum Dis Clin North Am,2012,38(1):13-27.
[39]Jeffery L E,Burke F,Mura M,et al.1,25-Dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3 [J].J Immunol,2009,183(9):5458-5467.
[40]Colin E M,Asmawidjaja P S,van Hamburg J P,et al.1,25-dihydroxyvitamin D3 modulates Th17 polarization and interleukin-22 expression by memory T cells from patients with early rheumatoid arthritis [J].Arthritis Rheum,2010,62(1):132-142.
[41]王宽,黄任佳,吴焕淦,等.维生素D在炎症性肠病中的作用機制[J].世界华人消化杂志,2015,23(35):5655-5661.
[42]Bruce D,Yu S,Ooi J H,et al.Converging pathways lead to overproduction of IL-17 in the absence of vitamin D signaling [J].Int Immunol,2011,23(8):519-528.
[43]Ikeda U,Wakita D,Ohkuri T,et al.1alpha,25-Dihydroxyvitamin D3 and all-trans retinoic acid synergistically inhibit the differentiation and expansion of Th17 cells [J].Immunol Lett,2010,134(1):7-16.
[44]Ulitsky A,Ananthakrishnan A N,Naik A,et al.Vitamin D deficiency in patients with inflammatory bowel disease:association with disease activity and quality of life [J].JPEN J Parenter Enteral Nutr,2011,35(3):308-316.
(2020-04-30收稿 责任编辑:徐颖)
基金项目:国家自然科学基金项目(81674074,81973955);上海市青年科技英才扬帆计划项目(17YF1417600);上海市青年科技启明星计划项目(16QA1403400);上海市卫生计生委优秀人才培养计划项目(2018YQ11)
作者简介:王宽(1989.07—),男,硕士,医师,研究方向:针灸治疗胃肠道疾病,E-mail:wangkuan271@163.com
通信作者:赵继梦(1986.04—),女,博士,助理研究员,研究方向:针灸治疗炎症性肠病的临床与基础研究,E-mail:zhaojm0414@163.com;吴璐一(1984.07—),女,博士,副研究员,研究方向:针灸治疗胃肠疾病的临床与基础研究,E-mail:luyitcm@163.com
- 基于学习型组织理论的企业改革研究
- 商业银行流动性风险在险价值的实证研究
- “特色产业+旅游”助推淮河生态经济带建设
- 基于游客满意视角下古街发展影响因子研究
- 中国在国际金融体系改革中的策略分析
- 新形势下黑龙江省民营经济发展的政策含义与对策研究
- 生态经济要求背景下的农业经济发展
- 黑龙江省绿色农业转型升级存在的问题及对策研究
- 乡村振兴战略下旅游城市非景区区域经济发展研究
- 科技创新驱动经济发展方式转变研究
- “一带一路”下跨境电商与跨境物流发展几点思考
- 木门电商的江浙沪农村市场调研
- 跨境电商平台下对大学生创新创业模式研究
- 新形势下农村电商培训对新型农民专业化发展的策略研究
- 冷链运输装备柔性化生产线工艺规划研究
- 中俄跨境物流成本控制问题研究
- 浅析“智能物流”人才培养模式研究
- 丰巢自助快递服务发展策略研究
- 跨境电商保税物流运营模式研究
- 电商卖家和第三方物流企业的委托代理分析
- 论互联网时代机场展示广告发展的趋势解析
- 供应商绩效管理综合评价模型研究
- 食品行业社会责任会计信息披露问题分析
- 黑龙江省粮食仓储管理合理化设计与研究
- 供应链管理模式下的采购管理研究?
- screw your eyes, face, etc up
- screw your eyes up / screw your face up
- screw²
- screw¹
- scribblative
- scribble
- scribbled
- scribblement
- scribbles
- scribbling
- scribblingly
- scribblings
- scribbly
- scribe
- scrimp
- scrimp and save
- scrimped
- scrimper
- scrimpier
- scrimpiest
- scrimping
- scrimply
- scrimp on sth
- scrimps
- scrip
- 伏法受诛
- 伏波聚米
- 伏流
- 伏火
- 伏特
- 伏特加
- 伏特计
- 伏犀鼻
- 伏猎侍郎
- 伏猎弄獐
- 伏猛
- 伏生
- 伏生之寿
- 伏生之年
- 伏生传书
- 伏甲
- 伏着休息
- 伏祠
- 伏突
- 伏窜
- 伏竄
- 伏章申表
- 伏笔
- 伏笔显露
- 伏线