吕娟 黄昊 赵燕田

[摘要] 目的 觀察髓源性抑制细胞(MDSC)在靶向肝再生磷酸酶-3(PRL-3)小鼠乳腺肿瘤基因免疫中的表达,探讨MDSC的数量与肿瘤生长的关系。 方法 将40只雌性BALB/c小鼠分为5大组(8小组),空载对照组[pVAX1(-)组]、无佐剂组PRL-3组(K-PRL3组)、佐剂-PRL-3融合蛋白组(K-T-PRL3组和K-PRL3-MT组)及MDSC对照抗体删除组(K-T-PRL3+Ab control组和K-PRL3-MT+Ab control组),MDSC特异性抗体删除组(K-T-PRL3+Gr-1Ab组和K-PRL3-MT+Gr-1 Ab组),通过流式细胞术检测免疫表型CD45、Gr-1及CD11b,分析MDSC在各免疫组外周血、肿瘤、脾脏中的表达水平,观察MDSC与肿瘤生长的相关性。 结果 荷瘤后第28天K-PRL3组、K-T-PRL3组和K-PRL3-MT组肿瘤体积均小于pVAX1(-)组,差异均有统计学意义(均P < 0.05);K-PRL3-MT组和K-T-PRL3组与K-PRL3组肿瘤体积比较,差异无统计学意义(P > 0.05)。佐剂-PRL-3融合蛋白组小鼠外周血或肿瘤组织中MDSC表达均高于K-PRL3组,差异有统计学意义(P < 0.05)。MDSC特异性抗体删除组(K-T-PRL3+Gr-1 Ab组和K-PRL3-MT+Gr-1 Ab组)与MDSC对照抗体删除组(K-T-PRL3 + Ab control组和K-PRL3-MT+Ab control组)肿瘤体积大小比较,差异无统计学意义(P > 0.05);MDSC特异性抗体删除组、MDSC对照抗体删除组肿瘤体积均大于无佐剂组PRL-3组和佐剂-PRL-3融合蛋白组,差异有统计学意义(P < 0.01);MDSC特异性抗体删除组脾脏、外周血MDSC表达均低于对照抗体删除组,而肿瘤组织中MDSC表达与MDSC对照抗体删除组比较,差异无统计学意义(P > 0.05),且均大于佐剂-PRL-3融合蛋白组,差异有统计学意义(P < 0.01)。 结论 在靶向PRL-3的小鼠乳腺肿瘤基因免疫中佐剂-PRL-3融合蛋白组肿瘤组织中MDSC与肿瘤生长相关,为进一步优化靶向PRL-3的抗肿瘤免疫治疗方案及MDSC相关作用研究提供理论依据。
[关键词] 髓源性抑制细胞;肝再生磷酸酶-3;肿瘤免疫抑制微环境;流式细胞术
[中图分类号] R735.9 ? ? ? ? ?[文献标识码] A ? ? ? ? ?[文章编号] 1673-7210(2020)09(b)-0079-08
[Abstract] Objective To observe the expression of myeloid suppressor cells (MDSC) in targeted phosphatase of regeneratiing liver-3 (PRL-3) mouse breast tumor gene immunity, and to explore the relationship between the number of MDSC and tumor growth. Methods Forty female BALB/c mice were divided into five groups (eight groups): no-load control group (pVAX1 [-] group), adjuvanted PRL-3 group (K-PRL3 group), adjuvanted PRL-3 fusion protein group (K-T-PRL3 group and K-PRL3-MT group), and MDSC control antibody deletion group (K-T-PRL3+Ab control group and K-PRL3-MT+Ab control group). In the MDSC specific antibody deletion group (K-T-PRL3+ GR-1AB group and K-PRL3-MT+ GR-1 Ab group), immunophenotypes CD45, GR-1 and CD11b were detected by flow cytometry to analyze the expression levels of MDSC in peripheral blood, tumor and spleen of each immune group, and the correlation between MDSC and tumor growth was observed. Results On the 28th day after tumor-bearing, the tumor volume of K-PRL3 group, K-T-PRL3 group and K-PRL3-MT group was all smaller than pVAX1 (-) group, with statistically significant differences (all P < 0.05).There was no significant difference in tumor volume between the K-PRL3-mt group and K-T-PRL3 group and K-PRL3 group (P > 0.05). The expression of MDSC in peripheral blood or tumor tissues of the adjuvant -PRL-3 fusion protein group was higher than that of the K-PRL3 group, and the difference was statistically significant (P < 0.05). There was no significant difference in tumor volume between MDSC specific antibody deletion group (K-T-PRL3 + GR-1 Ab group and K-PRL3-mL + GR-1 Ab group) and MDSC Control group (K-T-PRL3 +Ab control group and K-PRL3-MT +Ab control group) (P > 0.05). The tumor volume of the MDSC specific antibody deletion group and the MDSC control antibody deletion group were all larger than those of the adjuvant-free PRL-3 group and the adjuvant-PRL-3 fusion protein group, with statistically significant differences (P < 0.01). The expression of MDSC in spleen and peripheral blood of the MDSC specific antibody deletion group was lower than that of the control antibody deletion group, while the difference between the expression of MDSC in tumor tissues and that of the MDSC control antibody deletion group was not statistically significant (P > 0.05), and was greater than that of the adyuvanted-PRL-3 fusion protein group, with statistically significant difference (P < 0.01). Conclusion MDSC in tumor tissues in the adjuvant-PRL-3 fusion protein group is correlated with tumor growth in breast tumor by DNA vaccination against PRL-3, providing a theoretical basis for further optimization of anti-tumor immunotherapy against PRL-3 and research on the related effects of MDSC.
[Key words] Myeloid-derived suppressor cells; Phosphatase of regenerating liver-3; Tumor immunosuppressive microenvironment; Flow cytometry
髓源性抑制细胞(myeloid-derived suppressor cells,MDSC)是一群具有负向免疫调节功能的异质性细胞群,与调节性T淋巴细胞(regulatory T cells,Treg)等细胞群体一起构成肿瘤细胞对抗免疫系统的屏障,并诱导机体产生肿瘤免疫逃逸,在肿瘤发生发展中起重要作用,在癌症、慢性炎症、感染、自身免疫病、哮喘等发病机制中起关键性作用[1-5]。研究显示[6-8]肿瘤患者及荷瘤鼠中MDSC的表达与肿瘤的发展、转归密切相关,MDSC不仅能够抑制免疫反应,也能促进肿瘤生长,在肿瘤微环境中发挥着重要作用。
肝再生磷酸酶-3(phosphatase of regenerating liver-3,PRL-3)是非跨膜型酪氨酸磷酸酶成员之一,在乳腺癌、胃癌、结直肠癌、肝癌、白血病等多种癌症中高表达,促进肿瘤细胞的侵袭、转移,且与预后呈明显负相关[9-14],已成为潜在的肿瘤治疗靶点[15-18]。本研究前期工作首次从DNA免疫的角度阐述了以PRL-3为靶点的抑瘤效果,通过基因枪免疫方法介导PRL-3相关的DNA来发挥针对高表达PRL-3的小鼠D2F2/PRL-3乳腺肿瘤生长的预防或治疗作用[19]。但是,其中佐剂-PRL-3融合基因DNA免疫(该处佐剂分子为“结核分枝杆菌热休克蛋白TBhsp、结核分枝杆菌T细胞刺激表位MT”等)与无佐剂PRL-3DNA免疫组相比并未表现出明显的抑瘤作用。这一结果提出机体是否在以PRL-3为靶点的不同配伍的DNA免疫反应中建立了肿瘤免疫抑制微环境促进肿瘤生长。
因此,本研究以肿瘤免疫抑制微环境中细胞群之一MDSC为着眼点,通过流式细胞术检测其免疫表型Gr-1及CD11b[8],分析MDSC在各组小鼠外周血、肿瘤、脾脏中的表达水平,并进一步采用注射Gr-1单克隆抗体特异性删除小鼠MDSC细胞,观察联合免疫对肿瘤生长的影响,为MDSC作为肿瘤潜在的诊断、疗效监测指标等提供一定的理论依据,为MDSC进一步的抑制功能试验探索奠定基础,从肿瘤免疫抑制微环境的角度阐述靶向PRL-3的抑瘤机制。
1 材料与方法
1.1 细胞系及实验动物
过表达PRL-3的小鼠乳腺癌细胞系D2F2/PRL3及相关基因免疫所用质粒为北京大学临床肿瘤学院生物化学与分子生物学实验室惠赠。BALB/c小鼠,雌性,6~8周龄(合格证号1100112011003039)购自北京维通利华实验动物技术有限公司,由北京大学临床肿瘤学院动物室饲养,适应性喂养2~3 d。本研究动物实验已获首都医科大学附属北京朝阳医院医学伦理委员会科研课题伦理审批(编号13-科-50)。
1.2 动物分组
靶向PRL-3小鼠乳腺肿瘤基因免疫分为5大组(8小组,5只/组),共40只小鼠:空载对照组[pVAX1(-)组],无佐剂PRL-3组(K-PRL3组),佐剂-PRL-3融合蛋白组(K-PRL3-MT组和K-T-PRL3组),MDSC对照抗体删除组(K-T-PRL3+Ab Control组、K-PRL3-MT+Ab Control组),MDSC特异性抗体删除组(K-T-PRL3+Gr-1 Ab组、K-PRL3-MT+Gr-1 Ab组)。
1.3 靶向PRL-3小鼠乳腺肿瘤基因免疫造模
基因枪免疫方法参照前期工作进行[19]。上述基因免疫各组别基因枪子弹制备包被质粒分别为:pVAX1(-)组包被质粒pVAX1,K-PRL3组包被质粒pVAX1-Igκ-PRL3,K-PRL3-MT组包被质粒pVAX1-Igκ-PRL3-MT,K-T-PRL3组包被质粒pVAX1-Igκ-TBhsp-PRL3。MDSC对照抗体删除组及MDSC特异性抗体删除组根据佐剂类型包被上述相对应的质粒。
BALB/c小鼠腹部备皮,基因枪免疫2次,间隔2周,各组别每只小鼠每次免疫2发包裹有相应分组质粒的子弹,每只小鼠每次免疫量为2.4 μg DNA,第2次免疫后2周,行D2F2/PRL3左侧脂肪垫注射,每只小鼠细胞注射量2×105个细胞(100 μL PBS介质)。D2F2/PRL3细胞脂肪垫注射后14 d每隔3~6 d观察瘤体生长状况,游标卡尺测量肿瘤长短径,按公式V=XY2/2计算肿瘤体积(mm3,X长径,Y短径),绘制肿瘤生长曲线;在荷瘤后第26~28天取外周血、脾细胞及肿瘤组织进行MDSC流式检测。
1.4 免疫小鼠脾脏及肿瘤组织分离
参照小鼠脾消化试剂盒(德国美天旎,Lot:130-095-926)说明书提取脾细胞,参照小鼠肿瘤消化试剂盒(德国美天旎,Lot:130-096-730)说明书提取肿瘤细胞。按照说明书配置裂解酶混合液,脾脏或肿瘤组织剥离后剪碎放置混合液中碾磨,37℃温浴 15 min或2~3 h,过滤30 μm或70 μm滤膜后收集至15 mL管中,300 g(半径r = 18 cm),离心7~10 min,弃上清,流式缓冲液重悬细胞至适当体积待测
1.5 外周血、脾脏、肿瘤组织内MDSC流式检测
荧光标记流式抗体:CD45-FITC(mouse,clone:30-F11,BD,Lot:553079),CD11b-PE(human and mouse,clone:M1/70.15.11.5,德国美天旎,Lot:130-091-240),Gr-1-APC(mouse,clone:RB6-8C5,德国美天旎,Lot:130-102-385),Rat IgG2b-FITC(BD,Lot:553988),Rat IgG2b-PE(clone:ES26-5E12.4,德國美天旎,Lot:130-102-663),Rat IgG2b-APC(clone:ES26-5E12.4,德国美天旎,Lot:130-102-664)。流式染色缓冲液(Ebioscience,00-4222-26),10×红细胞裂解液(BD 555899)。BD Accuri C6分析型流式细胞仪。
脾脏与肿瘤细胞调整浓度至1×107个/mL,流式管底加入5~10 μL MDSC相应抗体,与100 μL上述细胞悬液或100 μL EDTA-K2抗凝外周血混匀,室温避光孵育20 min;每管中加入1×红细胞裂解工作液(现用现配)2 mL,混匀后避光孵育10 min;1500 r/min离心5 min后弃上清;加入2 mL PBS缓冲液重悬细胞,1500 r/min离心5 min后弃上清;加500 μL PBS重悬,待流式分析。收集105个细胞,以CD45+设门,检测CD11b+Gr-1+所占比例,进而得出MDSC表达量。
1.6 MDSC删除实验
MDSC删除用抗体:Purified NA/LE Rat Anti-Mouse Ly-6G and Ly-6C(Anti Gr-1)(BD PMG 553122);对照抗体:Purified NA/LE Rat IgG2b,κ isotype Control(BD PMG 553985)。按“1.3”项下靶向PRL-3小鼠乳腺肿瘤基因免疫流程及DNA用量,选取佐剂-PRL-3融合蛋白组K-PRL3-MT和K-T-PRL3(10只小鼠/组)进行MDSC删除实验,先分别行相应质粒包被的基因枪免疫2次,间隔2周,第2次免疫后2周,行D2F2/PRL3左侧脂肪垫注射,从接种肿瘤细胞当天起,将每组10只小鼠进一步分成两组(5只小鼠/组),腹腔注射特异性删除抗体(Gr-1 Ab)或对照抗体(Ab Control),100 μg/只,后续间隔1~2 d,一共7次抗体注射。每隔3~6 d观察瘤体生长状况,绘制肿瘤生长曲线;在荷瘤后第26~28天取外周血、脾细胞及肿瘤组织进行MDSC流式分析。
1.7 统计学方法
采用软件Graphpad Prism 5(Graphpad software Inc.,San Diego,CA,USA)进行统计分析。计量资料用均数±标准差(x±s)表示。组间肿瘤体积比较及MDSC细胞数用多因素方差分析(ANOVA)统计。以P < 0.05为差异有统计学意义。
2 结果
2.1 靶向PRL-3小鼠乳腺肿瘤基因免疫肿瘤生长及MDSC表达
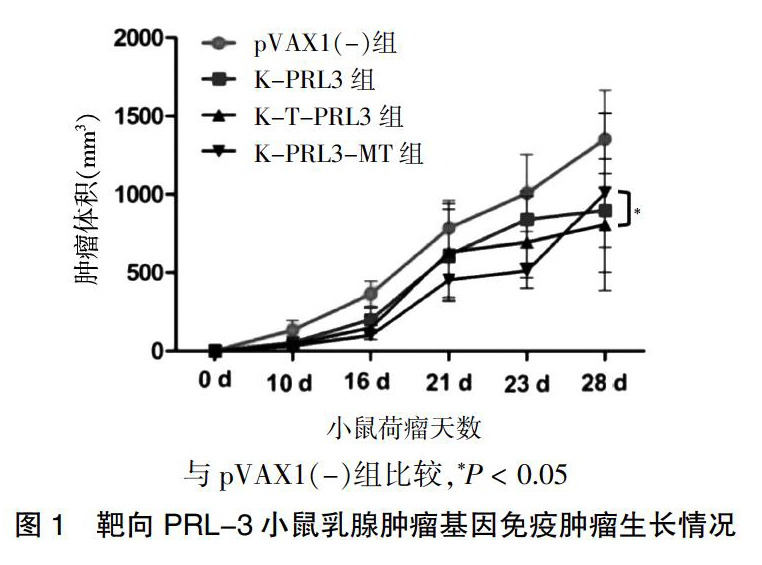
2.1.1 靶向PRL-3小鼠乳腺肿瘤基因免疫肿瘤生长情况 ?pVAX1(-)组肿瘤生长最快,荷瘤后第28天 K-PRL3组、K-T-PRL3组和K-PRL3-MT组肿瘤体积均小于pVAX1(-)组,差异均有统计学意义(均P < 0.05);K-PRL3-MT组和K-T-PRL3组与K-PRL3组肿瘤体积比较,差异无统计学意义(P > 0.05)。见图1。
2.1.2 靶向PRL-3小鼠乳腺肿瘤基因免疫各组织中MDSC表达变化 ?各组脾脏组织中MDSC表达,pVAX1(-)组、K-PRL3组、K-T-PRL3和K-PRL3-MT组比较,差异均无统计学意义(均P > 0.05)(图2A、D)。
各组外周血中MDSC表达,K-T-PRL3组及K-PRL3-MT组均大于pVAX1(-)组,差异有统计学意义(P < 0.05或P < 0.01)。K-T-PRL3组大于K-PRL3组和K-PRL3-MT组,差异有统计学意义(P < 0.05或P < 0.01)。其他组别之间外周血中MDSC表达差异无统计学意义(P > 0.05)(图2B、D)。
各组肿瘤组织中MDSC表达,K-T-PRL3组大于K-PRL3组,差异有統计学意义(P < 0.05)。其他组别之间肿瘤中MDSC表达差异无统计学意义(P > 0.05)(图2C、D)。
2.2 K-T-PRL3组和K-PRL3-MT组MDSC删除实验肿瘤生长及MDSC表达变化
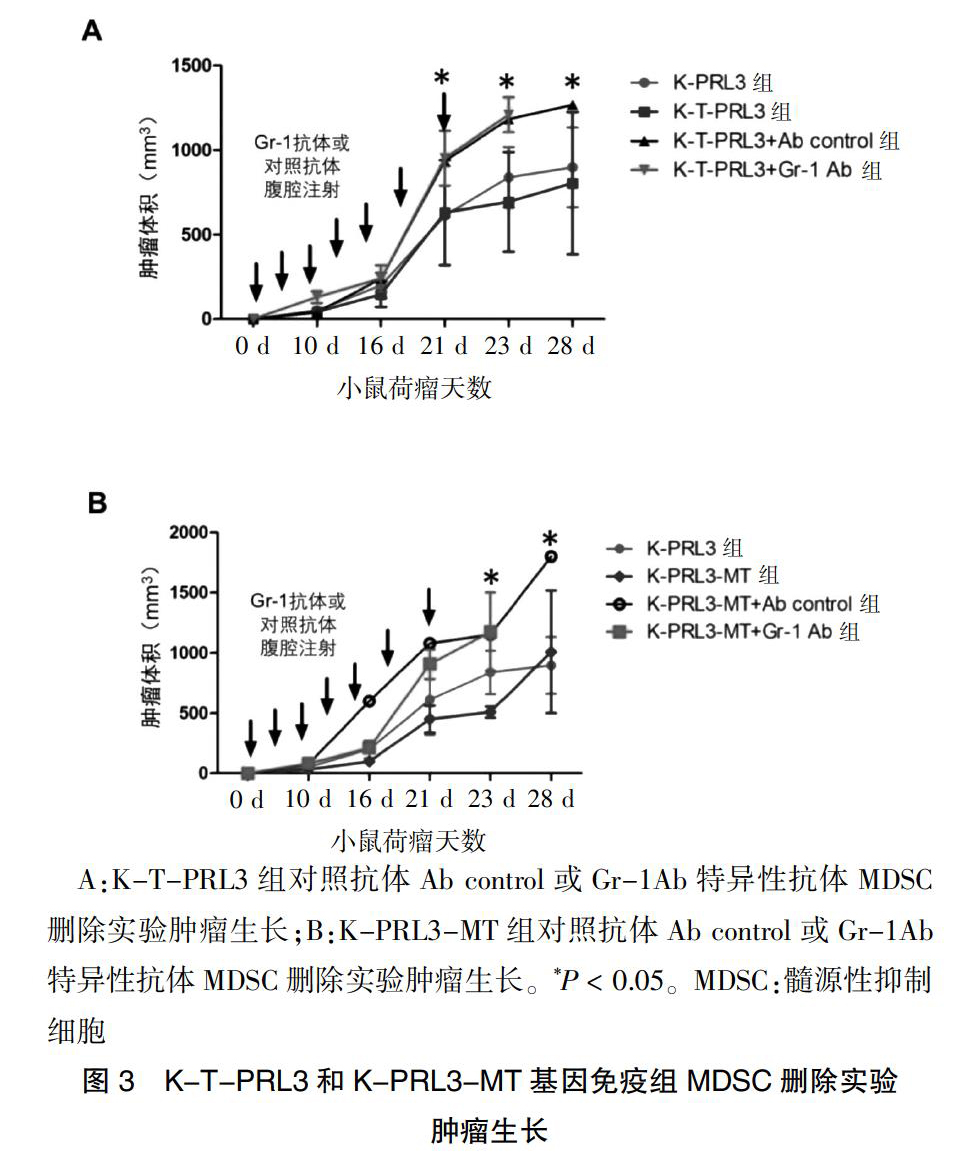
2.2.1 K-T-PRL3组和K-PRL3-MT组MDSC删除实验肿瘤生长 ?荷瘤后21 d及23 d,K-T-PRL3+Ab control组及K-T-PRL3+Gr-1 Ab组肿瘤体积均大于K-PRL3组和K-T-PRL3组,差异有统计学意义(P < 0.05);荷瘤后23~28 d,K-T-PRL3+Gr-1 Ab组小鼠由于体外实验及自然死亡缺失统计,K-T-PRL3+Ab control组肿瘤体积大于K-PRL3组和K-T-PRL3组,差异有统计学意义(P < 0.05)。K-T-PRL3+Ab control组和K-T-PRL3+Gr-1 Ab组间,K-PRL3和K-T-PRL3组间比较,荷瘤后不同时间点肿瘤大小差异均无统计学意义(均P > 0.05)。(图3A)。
荷瘤后23 d,K-PRL3-MT+Ab control组和K-PRL3-MT+Gr-1Ab组肿瘤体积均大于K-PRL3-MT组,差异有统计学意义(P < 0.05);荷瘤后28 d,K-PRL3-MT+Ab control组肿瘤体积大于K-PRL3组和K- PRL3-MT组,差异有统计学意义(P < 0.05)。K-PRL3-MT+Ab control组和K-PRL3-MT+Gr-1 Ab组间、K-PRL3和K- PRL3-MT组间比较,荷瘤后不同时间点肿瘤大小差异均无统计学意义(均P > 0.05)(图3B)。
2.2.2 K-T-PRL3组和K-PRL3-MT组MDSC删除实验中MDSC表达变化 ?各组脾脏组织中MDSC表达,K-PRL3-MT+Ab control组大于K-PRL3组、K-PRL3-MT组、K-PRL3-MT+Gr-1 Ab组,差异均有高度统计学意义(均P < 0.01)。其余不同组别间MDSC表达,差异无统计学意义(P > 0.05)(图4)。
各组外周血中MDSC表达,K-T-PRL3组大于K-T-PRL3+Ab control组、K-T-PRL3+Gr-1 Ab组,差异均有高度统计学意义(均P < 0.01)。K-PRL3-MT大于K-PRL3-MT+Gr-1 Ab,差异有高度统计学意义(P < 0.01)。其余不同组别间MDSC表达,差异无统计学意义(P > 0.05)(图4)。
各组肿瘤组织中MDSC表达,K-T-PRL3+Gr-1 Ab组大于K-PRL3组,差异有高度统计学意义(P < 0.01)。K-PRL3-MT+Gr-1 Ab大于K-PRL3组及K-PRL3-MT组,差异均有高度统计学意义(均P < 0.01)。其余不同组别间MDSC表达,差异无统计学意义(P > 0.05)(图4)。
组间两两比较,K-T-PRL3组与K-PRL3-MT组经Gr-1特异性抗体删除后(K-T-PRL3+Gr-1Ab与K-PRL3-MT+Gr-1Ab),脾脏、外周血MDSC表达均低于删除抗体对照组(K-T-PRL3+Ab Control、K-PRL3-MT+Ab control),而肿瘤组织中MDSC与对照组比较,差异无统计学意义(P > 0.05),且均大于K-PRL3组(P < 0.01)(图4B)。
3 讨论
肿瘤免疫抑制微环境是肿瘤细胞利用机体免疫系统自身的负调控机制,在肿瘤微环境中建立的全方位免疫抑制网络,对促进肿瘤发展和抵抗肿瘤治疗效应起到关键作用[20-22]。该微环境诱导免疫抑制细胞分化、增殖并向肿瘤部位聚集,包括CD4+CD25+ Treg、Gr-1+CD11b+ MDSC、M2 型肿瘤相关巨噬细胞(TAM)等[8,23-24]。MDSC是近二十年来的肿瘤免疫研究领域的热点。MDSC是一群异质性细胞,来源于骨髓祖细胞。在正常个体,骨髓祖细胞迅速分化为成熟的粒细胞、巨噬细胞和树突细胞。相反在病理条件下,如癌症、败血症、创伤、移植等,分化为成熟髓样细胞受阻,导致MDSC大量产生[4]。
本研究在前期工作中将相关病原体源性小肽——TBhsp和MT分别与PRL-3结合构建融合表达基因,以期机体的免疫系统假借识别病原体来对目的蛋白产生反应,从而产生“1+1≥2”的抑瘤增强效应。但是,机体免疫系统的复杂性使得对自身抗原产生免疫力的同时也伴随着对自身免疫的调节作用,佐剂增强机体对自身抗原免疫反应能力越强,限制Ⅰ型免疫反应的自身免疫耐受发生的可能性就越大,佐剂产生的这种免疫抑制效应可限制疫苗的效力[25]。已有研究显示[26],肿瘤自身产生的免疫抑制微环境及免疫抑制分子调控网络的激活成为肿瘤免疫治疗潜藏的最大障碍。如手术后的复发肿瘤和引流淋巴结中有大量M2型巨噬细胞TAM(CD11b+F4/80hiCD206hi和CD11b+F4/80hiCD124hi)和 CD4+Foxp3+Treg 浸润,导致肿瘤免疫抑制微环境的改变解释了术后常规免疫治疗与术前相比失败的原因[24]。又如由于肿瘤组织内浸润有大量免疫抑制类细胞,这一肿瘤免疫抑制微环境的存在抑制了CD8+T细胞反应增强剂IL-15R/IL-15融合蛋白与 HER2/neu单抗的联合治疗的抑瘤免疫效应[27]。
本研究中TBhsp和MT佐剂分子的加入,与单纯PRL-3免疫组相比并未表现出明显的抑瘤优势,其中MDSC在K-T-PRL3组和K-PRL3-MT组小鼠外周血或肿瘤组织中的表达均高于无佐剂的K-PRL3组,差异有统计学意义,而脾脏中的表达差异无统计学意义,这一结果初步提示MDSC在靶向PRL-3的抗肿瘤免疫中发挥抑制作用。肿瘤免疫抑制微环境具有显著的异质性和动态变化的特征,对同一肿瘤的不同干预,肿瘤免疫抑制微环境也会随之发生变化。
肿瘤免疫治疗的主要目标是诱发和增强机体有效的抗肿瘤免疫反应,包括促进肿瘤抗原特异的CTL反应、产生腫瘤特异的抗体、促进CD4+ Th细胞反应、自然杀伤细胞的非抗原特异性反应,引起Treg或MDSC等抑制性细胞的减少,或者产生一些促免疫反应细胞因子等[28]。增强抗肿瘤免疫的同时,需要改善或解除肿瘤免疫抑制反应方有望取得良好的治疗效果[20]。因此,基于上述结果,本研究用Gr-1单抗以期将K-T-PRL3和K-PRL3-MT组中MDSC特异性删除,脾脏、外周血MDSC表达均低于删除抗体对照组,差异有统计学意义,而肿瘤组织中MDSC与对照组比较差异无统计学意义,提示腹腔注射抗体的方式对删除肿瘤内的MDSC作用不明显。特异性抗体删除组与对照抗体删除组、未删除组相比均无明显抑瘤优势,反而有加速肿瘤生长趋势。进一步提示肿瘤组织中的MDSC在靶向PRL-3的抗肿瘤基因免疫中对肿瘤免疫抑制微环境的形成有一定作用,也提示我们下一步在肿瘤局部抑制MDSC的生成来优化靶向PRL-3的抗肿瘤免疫治疗方案。
本研究结果尚需进一步扩大样本量验证,需要值得注意的是具有和MDSC相同表型却没有免疫抑制活性的细胞群命名为未成熟髓样细胞(immature myeloid cells,IMC),这就需要做体外抑制试验和真正具有免疫抑制功能的MDSC相鉴别[8],也提示我们在靶向PRL-3的抗肿瘤研究需进一步提取脾脏、外周血及肿瘤组织中MDSC进行更多免疫标志物的筛选和功能验证,以期更全面地揭示MDSC在机体不同部位组织中的功能。
综上所述,本研究前期工作的基础上,运用流式细胞术和一系列体内、体外实验,明确以PRL-3为靶点的肿瘤模型基因免疫中外周血及肿瘤免疫微环境内MDSC的表达变化,在此基础上,实施特异性细胞删除以期达到免疫预防优化目的,从而为全面认识PRL-3在肿瘤发生发展中的作用、提高和发展新的肿瘤治疗方案奠定基础,同时也有可能为研发针对PRL-3的靶向药物提供一定的理论依据,扩展了PRL-3的研究领域,对于MDSC细胞的相关研究也具有理论参考价值。此次初步探索有助于进一步阐述MDSC与恶性克隆、抗肿瘤效应细胞间的相互关系,为免疫治疗提供新靶点,开拓新思路。
[参考文献]
[1] ?Medzhitov R,Shevach EM,Trinchieri G,et al. Highlights of 10 years of immunology in Nature Reviews Immunology [J]. Nat Rev Immunol,2011,11(10):693-702.
[15] ?Zhang M,Wei Y,Liu Y,et al. Metastatic Phosphatase PRL-3 Induces Ovarian Cancer Stem Cell Sub-population through Phosphatase-Independent Deacetylation Modulations [J]. iScience,2020,23(1):100766.
[16] ?Xu J,Wu W,Tang Y,et al. PRL-3 exerts oncogenic functions in myeloid leukemia cells via aberrant dephosphorylation of stathmin and activation of STAT3 signaling [J]. Aging(Albany NY),2019,11(18):7817-7829.
[17] ?Tanaka T,Kaida T,Yokoi K,et al. Critical relevance of genomic gains of PRL-3/EGFR/c-myc pathway genes in liver metastasis of colorectal cancer [J]. Oncol Lett,2019, 17(1):1257-1266.
[18] ?Lian S,Meng L,Yang Y,et al. PRL-3 promotes telomere deprotection and chromosomal instability [J]. Nucleic Acids Res,2017,45(11):6546-6571.
[19] ?Lv J,Liu C,Huang H,et al. Suppression of breast tumor growth by DNA vaccination against phosphatase of regenerating liver 3 [J]. Gene Ther,2013,20(8):834-845.
[20] ?王盛典,贾明明.肿瘤免疫微环境在肿瘤常规治療效应中的作用[J].中国肿瘤生物治疗杂志,2012,19(3):229-238.
[21] ?Miyazaki T,Ishikawa E,Sugii N,et al. Therapeutic Strategies for Overcoming Immunotherapy Resistance Mediated by Immunosuppressive Factors of the Glioblastoma Microenvironment [J]. Cancers(Basel),2020,12(7).
[22] ?Looi CK,Chung FF,Leong CO,et al. Therapeutic challenges and current immunomodulatory strategies in targeting the immunosuppressive pancreatic tumor microenvironment [J]. J Exp Clin Cancer Res,2019,38(1):162.
[23] ?Jacobs JF,Nierkens S,Figdor CG,et al. Regulatory T cells in melanoma: the final hurdle towards effective immunotherapy? [J] Lancet Oncol,2012,13(1):e32-42.
[24] ?Predina J,Eruslanov E,Judy B,et al. Changes in the local tumor microenvironment in recurrent cancers may explain the failure of vaccines after surgery [J]. Proc Natl Acad Sci USA,2013,110(5):E415-E424.
[25] ?Dang Y,Wagner WM,Gad E,et al. Dendritic cell-activating vaccine adjuvants differ in the ability to elicit antitumor immunity due to an adjuvant-specific induction of immunosuppressive cells [J]. Clin Cancer Res,2012, 18(11):3122-3131.
[26] ?Rabinovich GA,Gabrilovich D,Sotomayor EM. Immunosuppressive strategies that are mediated by tumor cells [J]. Annu Rev Immuno,2007,25:267-296.
[27] ?Xu M,Du X,Liu M,et al. The tumor immunosuppressive microenvironment impairs the therapy of anti-HER2/neu antibody [J]. Protein Cell,2012,3(6):441-449.
[28] ?Kirkwood JM,Butterfield LH,Tarhini AA,et al. Immunotherapy of cancer in 2012 [J]. CA Cancer J Clin,2012,62(5):309-335.
(收稿日期:2020-06-07)
- 优质护理服务在预约挂号服务中的应用
- 高血压脑出血患者采用预防性护理对其术后下肢深静脉血栓形成的影响研究
- 分析预防性护理管理对于降低呼吸内科老年患者感染率的效果
- 对精神分裂症患者实施院外延续护理的护理体会
- 58591例狂犬病暴露后预防处置及护理干预
- 临床护理路径在白内障手术中的护理效果和对患者满意度的影响
- 改良拔尿管法及诱导排尿法在老年患者中的临床效果研究
- 心理护理对儿科患儿静脉穿刺成功率的影响
- 人文关怀护理在CT增强扫描检查患者中的应用
- 康复护理早期介入对盆腔炎患者炎性因子的影响研究
- 针灸联合优质护理对脑卒中后焦虑、抑郁的影响
- 优质护理对老年精神障碍患者生活质量的影响
- 急性脑梗死早期血管介入治疗全程护理的临床及预后价值探讨
- 分析手术室护理对预防胃肠道手术患者术后切口感染的应用价值
- 康复护理在老年股骨粗隆间骨折内固定术患者中的应用
- 参与管理模式在护理管理中的应用分析与研究
- 基于微信APP的延续性护理在预防卧床老人压力性损伤的应用效果
- 右美托咪定对心肌缺血再灌注损伤大鼠的心肌保护作用及机制
- 对比分析胺碘酮、利多卡因在治疗急性心肌梗死院前急救中的效果
- 氨氯地平与厄贝沙坦对患有糖尿病合并高血压的病患进行治疗的临床有效性研究
- 心血管外科手术中“无输血手术”的实施
- 美托洛尔联合曲美他嗪对冠心病心力衰竭患者临床症状及心功能的影响
- 序贯性通气中采取持续湿化高流量氧疗替代无创辅助通气的应用研究
- 替格瑞诺治疗脑动脉狭窄合并小血管病的临床疗效
- 基于“内风”理论观察针药结合治疗原发性高血压亚急症临床研究
- be your own boss
- be your own man/woman
- be your own worst enemy
- be²
- be¹
- beˌginning of year
- beˌlow par
- beˌlow the fold
- beˌlow-the-line
- bf
- b/f
- bfoq
- bi
- bi-
- biannual
- biannually
- bias
- bias (against/for/towards/in favour of sb/sth)
- biased
- biasedly
- biases'
- biases
- biasing
- biasness
- biasnesses
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-