摘要:氢氧化亚铁制备过程中产生的绿色物质是水合氢氧化亚铁或是绿锈,争议颇多。在参阅相关文献基础上,将氢氧化亚铁的制备设计在密封性能好的注射器中进行,探究绿色物质的成分以及能较长时间保存氢氧化亚铁的制备方法。
关键词:氢氧化亚铁;绿锈;水合物;实验探究
文章编号:1005–6629(2015)2–0056–03 中图分类号:G633.8 文献标识码:B
氢氧化亚铁制备实验是高中化学中的重要演示实验之一。为制得白色的氢氧化亚铁,专家作了大量研究,取得很大进展。由于实验条件难以控制,制备氢氧化亚铁时产生的沉淀有时呈现白色,有时灰绿色,有时墨绿色。专家对绿色物质的争议颇多,如上海虹口区鲁迅中学张旭旻老师和重庆巴蜀中学的朱华英老师认为绿色物质是水合氢氧化亚铁[1];河北秦皇岛市第一中学的李俊生老师[2]、张英锋老师[3],邢台学院化学系孟哲[4]等老师则认为是绿锈。绿色物质究竟为何种物质?它是如何形成的?有没有更好的方法制得氢氧化亚铁,并使之长久保存?笔者利用注射器的密封性能好的优点改进氢氧化亚铁的制备,并探究“绿色物质”的成分,寻求能较长时间保存氢氧化亚铁的制备方法。
1 氢氧化亚铁的制备
为防止空气中的氧气的干扰,同时能较长时间地保存沉淀并观察沉淀的变化,笔者利用两支注射器制作了如图1所示的密封反应装置来制备氢氧化亚铁。
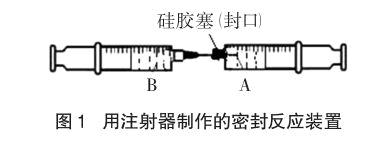
注射器A吸入反应液后用硅胶塞封口,再用注射器B将另一反应液缓慢推入到注射器A中,使两溶液混合反应。
为保证实验的顺利进行,笔者对反应液进行了如下处理:
(1)溶液除氧处理。配制氢氧化钠溶液和硫酸亚铁溶液所用蒸馏水先煮沸再冷却以除去水中的溶解氧。氢氧化钠溶液在反应前再进行一次除氧处理。
(2)防Fe2+被氧化的处理。配制硫酸亚铁溶液加入Vc(100mL溶液中加入半片Vc)防止Fe2+被氧化,加入稀硫酸抑制Fe2+水解。实验前用KSCN溶液检测无Fe3+方可实验。
实验一 用两种不同的滴加方法制取氢氧化亚铁。
方法1:在注射器A中吸入4mL 0.5 mol/L硫酸亚铁溶液,通过注射器B缓慢推入1 mol/L氢氧化钠溶液1mL,得沉淀a。
方法2:在注射器A中吸入4mL 1 mol/L氢氧化钠溶液,通过注射器B缓慢推入0.5 mol/L硫酸亚铁溶液1mL,得沉淀b。
2 两种沉淀成分的探究
两种方法得到的沉淀放置后的颜色变化如下表:



分析:方法1中制得的氢氧化亚铁,在受热情况下分解速率加快,生成的FeO歧化反应速率也加快,故颜色会较快地转变。而方法2得到的“绿锈”相对稳定,受热情况下不发生明显变化。
上述实验进一步证明:在溶解氧含量较大的环境中氢氧化亚铁易迅速转化为相对较稳定的“绿锈”;在溶解氧含量低的环境中氢氧化亚铁会缓慢形成少量绿锈,同时由于氢氧化亚铁的分解、FeO的歧化,会转化生成铁和四氧化三铁。
3 氢氧化亚铁制备的合理方法探究
上述实验分析可以看出常规的溶液处理均无法避免氧气对氢氧化亚铁的影响。为进一步消除氧气的影响,需对上述实验方法作进一步的改进。方法如下:
(1)将方法1、方法2制得的混合液静置。生成的氢氧化亚铁可以除去溶液中的溶解氧,所以可以认为清液中的溶解氧为零。
(2)用针筒从混合液中抽取两种清液。方法1得到的清液中含有较大量的硫酸亚铁溶液,方法2得到的清液中含有较大量的氢氧化钠溶液。
(3)将两种清液在密封反应器中混合,可制得白色的氢氧化亚铁,可保持半小时不变色。
利用两种不同滴液方法制得氢氧化亚铁的同时,获得充分除氧的氢氧化钠溶液和硫酸亚铁溶液,两者混合可得相对较长时间保持白色的氢氧化亚铁,但由于无氧条件下氢氧化亚铁的分解、FeO的歧化等原因,氢氧化亚铁白色沉淀在隔绝空气的无氧环境中依然无法长久保存。
综上所述,制备氢氧化亚铁所涉及的问题是很复杂的,同时由于很难将溶液中的溶解氧全部除去,现有手段又无法阻止氢氧化亚铁的歧化,所以在实验室中基本无法制得长久保存的白色氢氧化亚铁。
参考文献:
[1][5]朱华英. Fe(OH)2制备过程中出现的绿色物质究竟是什么[J].化学教育,2004,(8):59.
[2][6][7][8][9]李俊生,胡志刚.对氢氧化亚铁制备的几个疑难问题的研究[J].化学教学,2011,(11):68.
[3]张英锋,马子川,李顺军.也谈灰绿色物质――绿锈的组成[J].化学教育,2009,(1):71.
[4]孟哲.制备Fe(OH)2过程中出现的绿色物质[J].化学世界,2006,(7):445.
- 多媒体网页制作中页面元素的审美与设计
- 新时期广播电视工程技术人才培养问题研究
- 一种应用于飞行品质研究的缩比模型控制律设计
- 电视台演播室音频系统数字化改造
- 新媒体时代传统编辑出版的应对策略
- 专题类电视节目中细节的作用
- 文化类综艺节目的艺术塑造与价值提升
- 新媒体对新闻播音主持行业的影响研究
- “互联网+”时代下广播电视新闻采编新特点及应对策略探讨
- 新媒体环境下新闻漫画的现状及其发展策略
- 电视社会新闻文字编辑的思维取向及语言驾驭探析
- 科技编辑如何适应科技创新
- 融合时代基层电视节目的发展策略
- 网络媒体环境下高校校报的传播功能
- 基于粉丝文化视域的《奇葩说》植入广告传播策略研究
- 报纸与新媒体共存的发展策略探析
- 网络时代科技传播的碎片化策略
- 新媒体时代报纸编辑的创新意识提升
- 浅谈新媒体环境下对新闻编辑记者的素质要求
- 从地方电视节目创新视角看如何创造美好新家园
- 浅谈省级应急广播的发展对策
- 《党报天天读》主持人的风格探析
- 媒体融合背景下电视新闻评论栏目存在的问题及发展对策
- 泉州晚报广告经营策划的融合创新
- 媒体伦理失范现象及其原因
- self-ordainers
- self-oriented
- self-origination
- self-originations
- self-oscillate
- self-oscillating
- self-outlaw
- self-outlaws
- self-ownership
- self-ownerships
- self-paid
- self-pampered
- self-pampering
- self-parodies
- self-parodist
- self-parodists
- self-peace
- self-peaces
- self-penetration
- self-penetrations
- self-penned
- self-perceiving
- self-perceptive
- self-perfecting
- self-performed
- 税务
- 税名
- 税外方圆
- 税外钱
- 税官
- 税屋
- 税感
- 税感时代
- 税捐
- 税收
- 税收的来源
- 税收负担
- 税改
- 税敛
- 税服
- 税检
- 税款
- 税法
- 税源
- 税率
- 税理
- 税目
- 税盲
- 税票
- 税种