

摘要:基于若干实验试题存在缺乏科学性与实证性的问题,以通常条件下酸化的NO3-是否一定可以氧化强还原性离子Fe2+、I-;Fe(OH)2制备过程中白色沉淀迅速变灰绿色是否—定是因为被氧化成Fe(OH)3; AICl3溶液和MgCl2溶液能否用氨水来进行区别三个典型案例做了系列实验并进行了理论分析,发现这三个案例中大家普遍认为的结论与所做的实验事实不符,存在认识的误区,进而引导实验命题必须关注科学性及实证性。
关键词:实验题;科学性;实证性;NO3-氧化性;Fe(OH)2制备
文章编号:1005-6629(2016)2-0054-05
中图分类号:G633.8
文献标识码:B
1 问题的提出
我国著名化学家傅鹰先生曾说过:“化学是实验的科学,只有实验才是最高的法庭。”然而实际上在许多实验题的命制过程中,经常出现命题者闭门造车,仅凭经验出题,从而出现不少科学性错误的情况。笔者在平时的教学中收集了一些题例,并进行了实验及理论的论证,发现有许多实验题违背科学性,望能与同行共同商榷。
2 实验题缺乏科学性及实证性具体案例
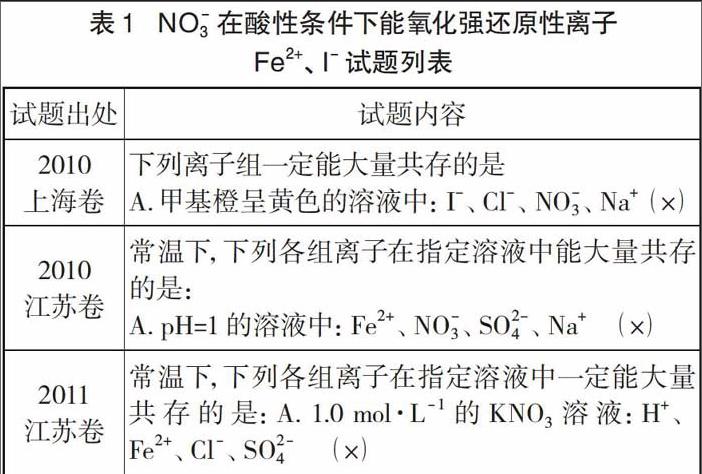
2.1 NO3-在酸性条件下一定能氧化强还原性离子Fe2+、I-吗
普遍认为,通常条件下酸化的N03具有很强的氧化性。强还原性离子Fe2+、I-与NO3-会因发生氧化还原反应而不能大量共存,因此从2010年至今许多高考试题中有了如下试题的命制。
至今很多化学教师都认为NO3-在酸性条件下与Fe2+、I-不能常量或大量共存。事实是否如此呢?我们先看正确的NO3-检验方法:取少量待测样品于试管中,加入新制的约2mL 1 mol·L-1硫酸亚铁铵溶液[称取39.2g硫酸亚铁铵(NH4)2Fe(SO4)2-8H20,溶于95mL水中,加入5mL 6mol·L-1稀硫酸及2药匙还原铁粉,静置30分钟至用0.1 mol·L-1KSCN溶液检验无Fe3+后备用],充分振荡后,沿试管内壁缓慢注入2mL 98%浓硫酸,浓硫酸与上述混合液会分层,若在交界面出现棕色环,说明有NO3-存在,若无棕色环,则无NO3-存在。
在做上述检验时,将NaNO3-溶液与酸性硫酸亚铁(用上述新制硫酸亚铁溶液)混合,用力振荡,可并没有出现黄色,将所得溶液分成两等份,进行如下实验(见表2)。
通过以上实验说明:在上述酸性条件下稀的NO3-并不能氧化Fe2+,NO3-只有在浓硫酸(与混合液接触会放热,且有较高浓度的H+)存在下才能将Fe2+氧化,产生NO,并且NO与Fe2+结合产生棕色物质[Fe(NO)]2+。
同时在教学中还存在这样一个误区,即化合价越高,其氧化性越强,认为稀硝酸的氧化性要强于亚硝酸。事实并非如此。查阅资料有如下描用是相当复杂的,查阅资料,从反应机理上看,硝酸的氧化作用可以认为首先被还原成NO2,但是因为NO2的产量不多,它来不及逸出反应体系又被水反应或被进一步还原成NO或N2、NH4+等。硝酸的氧化性与硝酸光化分解而来的NO2催化作用有关,NO2起着传递电子的作用。
硝酸通过NO2获得还原剂的电子,反应便被加速。
硝酸越浓,酸中溶有的NO2越多,反应速度就越快。而在极稀的硝酸中,NO2的量趋于零,所以反应速率极慢,也就检验不出有Fe3+。而发烟硝酸有很强的氧化性,就是因为在酸中溶解有很多的NO2的缘故。为验证这一解释,再设计如下实验:
将六组实验的溶液均分为两份,一份为对照,另一份同时放入80~90℃水浴中加热10分钟,六支试管的溶液除第一、第二组溶液基本不变外,其他四组均明显变深,其中第六组加热后变得最深(血红色)。通过这些实验现象表明,前面所述的动力学分析是有道理的。极稀的硝酸与Fe2+、I-反应的速率极慢,可认为它们可以共存。因此表1的试题命制均存在缺乏实验实证及科学性错误,在命制有关离子共存的试题时应当回避这类问题。
2.2 Fe(OH)2白色沉淀迅速变灰绿色是因为被氧化成Fe(OH)3吗
有关Fe(OH)2的制备,相信各位同行都非常熟悉,具体操作是:用长滴管吸取煮沸过的氢氧化钠溶液并插入新制的硫酸亚铁溶液的底部,小心注出氢氧化钠溶液。
出现的现象是:产生白色沉淀并迅速变灰绿色,最后变红褐色。
现象解释及结论:Fe(OH)2是白色沉淀,但极易被氧气氧化成Fe(OH)3,所以迅速变灰绿最后变红褐色。
事实上具体操作时很难看到“白色沉淀”这一现象,在分析这一原因时,很多老师认为是碱性条件下Fe(OH)2被溶解氧或空气中的氧气氧化。于是就设计如何在隔绝空气条件下制备白色Fe(OH)2,甚至2003年全国统一高考的实验题考查用Fe与稀H2SO4制FeSO4和H2,并利用H2将装置中的氧气及溶液中的溶解氧驱除出去,再将新制的FeSO4溶液压入NaOH溶液中(如图1);此外还有油封法、电解法等等。笔者对这三种方法均实际操作过,效果最好的是电解法(如图2)(a接电源正极,b接电源负极),但时间长了仍然出现灰绿色(理论上不应该出现,因为电解过程中还在不断产生氢气),而且学生提出这样一个问题:未被氧化的白色氢氧化亚铁与被氧化生成的红褐色氢氧化铁混合按配色原理无法出现灰绿色?
笔者发现产生的灰绿色沉淀是絮状沉淀,由此提出设想:此灰绿色物质并不是Fe(OH)3,而是生成的Fe(OH)2絮状沉淀,性质类似Fe(OH)3、Al(OH)3等金属氢氧化物凝胶,胶粒直径1~lOOnm之间,有较大的表面积,因此有较强的吸附作用,不同的胶体会选择性地吸附溶液中的离子,大家知道,金属氢氧化物胶粒带正电,因此Fe(OH)2胶体吸附了较多的亚铁离子而呈灰绿色。若是如此,①胶体受热时吸附能力会减弱,将已经变灰绿色的Fe(OH)2胶体加热应该会变白;②若减少带浅绿色Fe2+的量,让胶体无Fe2+可吸附,则制出的胶体应该是白色的,因此设计了以下两个验证实验:
(1)取4mL 1 mol·L-1新制的FeSO4溶液于试管中,用长滴管吸取2mL 4 mol·L-1NaOH溶液(煮沸过),插入试管底部,注入NaOH溶液,刚注入时观察到白色沉淀,随后立即变灰绿色沉淀,再将这试管放入50~60℃的水浴中,笔者惊奇地发现,灰绿色沉淀竟然变成了白色(实验现象见图3a、图3b)。这应当是温度升高,胶体吸附能力降低所致。
(2)取4mL浓的NaOH溶液于试管中(煮沸过),用长滴管吸取2mL新制的FeSO4溶液,擂入试管底部,注入FeSO4溶液(注意:不要注完,滴管上方的溶液与空气接触会有部分被氧化),笔者又发现得到的沉淀是白色且长时间不会变灰绿(见图4a、图4b)。说明Fe2+少量时,Fe(OH)2胶体无Fe2+吸附,可长时间见到Fe(OH)2沉淀的真面目。
上述两个实验证明,前面所提出的新制Fe(OH)2呈灰绿色是因其是胶体吸附Fe2+的假设是正确的。因此只要反其道而行之,改变(将少量NaOH溶液挤入过量FeSO4溶液中的)传统的实验操作方法,而把少量FeSO4溶液挤入过量的NaOH溶液中,即实验过程中FeSO4溶液少量,NaOH溶液过量,便可轻而易举地得到白色Fe(OH)2沉淀。从而没必要再命制有关如何改进方法制取Fe(OH)2的有关试题了。
2.3 AlCl3溶液和MgCl2溶液不能用氨水来区别吗
在大家的普遍意识里,由于氨水加入MgCl2、AlCl3这两种溶液中均会出现白色沉淀,不能用氨水来鉴别两种溶液,所以才有了如下试题的命制:
事实真的如此吗?笔者设计实验进行验证。
取少量MgCl2溶液、AlICl3溶液(浓度均为0.1 mol·L-1),当分别滴入少量稀氨水时,AlCl3立即出现白色沉淀,而MgCl2溶液加少量稀氨水并不产生沉淀,需加稀氨水至过量,使溶液pH达到8.87{可依K。。[Mg(OH)2]来进行计算}以上方能出现沉淀。这说明AlCl3、MgCl2与氨水均能产生沉淀不是绝对的,实际上MgCl2与NH3·H2O的反应存在一个平衡,在Mg(OH)2沉淀中加入饱和NH4Cl或CH3COONH4溶液,Mg(OH)2沉淀会完全溶解。稀氨水是可以用来鉴别较稀的AlCl3溶液和MgCl2溶液的。可见,表6所列试题也存在科学性错误。
结语:从上述的三个实验案例我们得到一个启示,在命制中学化学实验题时,应重视实验的实证,尤其是教材之外的实验,不能单纯从理论推导、想象是什么样的现象及结论就进行试题的命制,而应推导加实验的实证后再进行命制。因此,作为命题者在命制实验题时,应尊重科学、注重实证的研究,从而命制出高质量的试题,避免发生科学性错误而误导学生。
- 大学生社会责任与职业道德培养框架和机制研究
- 现代企业社会责任与企业恒久发展的关系研究
- 特色小镇建设中的政企“亲”“清”关系: 一个分析框架
- 有限公司股权对外转让纠纷的审判困境 与路径研究
- 制度环境对董责险治理效应的影响研究
- 党内法规性质研究
- 雨水道路中车辆安全驾驶技巧及车辆维护措施研究
- 果树栽培技术对提高果实品质的影响分析
- CR400BF型动车组中央控制单元停机故障与改进措施探讨
- 一维定态薛定谔方程的理论求解及MATLAB的仿真实现研究
- 基于系统动力学的多供应点、多需求点防汛物资配送研究
- 四川省公园城市试点建设基础评价
- 国内外特色小镇建设经验与启示探讨
- “工作的自我概念”对春节旅游的影响研究
- 基于旅游数字足迹的国内游客旅游行为分析
- 三亚中医药养生旅游决策影响因素研究
- 新县全域旅游发展模式、问题与对策分析
- “互联网+”时代基于游客需求的旅行社 产品创新研究
- 新时代无锡休闲农业的品牌发展研究
- 蛋白组学在肝癌中的应用研究
- 针灸治疗原发性痛经的进展研究
- 海船船员考试与执业医师考试的比较研究与借鉴
- 公务员交流意愿不均衡的现状、成因及对策
- 农村籍大学生返乡创业意愿提升研究
- 基于实训教学平台的“校企精准对接, 精准育人”人才培养机制研究
- nonphonetical
- nonphonetically
- nonphosphate
- nonphosphates
- non-photographic
- nonphotographic
- nonphotographical
- nonphotographically
- non-photosynthetic
- nonphotosynthetic
- non-physical
- non-physically
- nonphysician
- nonphysicians
- nonpictorial
- nonpictorially
- nonpigmented
- nonplacental
- nonplanar
- nonplanetary
- nonplastic
- nonplasticities
- nonplasticity
- nonplastics
- nonplastics'
- 亭亭款款
- 亭亭独立
- 亭亭玉立
- 亭亭玉立玉立亭亭
- 亭亭秀秀
- 亭亭袅袅
- 亭伯投荒
- 亭侯
- 亭匀
- 亭午
- 亭台
- 亭台楼阁
- 亭台楼阁楼台亭阁
- 亭台楼阁等建筑物
- 亭台等建筑呈高耸开张之状
- 亭台轩馆
- 亭子
- 亭子里聊天——讲风凉话
- 亭子里谈心
- 亭子里谈心——讲风凉话
- 亭子间
- 亭式车站
- 亭当
- 亭曈
- 亭榭