
摘要建立了超高效液相色谱-质谱联用(UPLC/PDAQDa)同时对大麻植物中Δ9四氢大麻酚(Δ9THC)、大麻酚(CBN)和大麻二酚(CBD)进行定性与定量分析的方法。缴获的大麻植物用甲醇超声萃取, 采用甲醇(含0.1%甲酸)和超纯水为流动相, 等度洗脱, 流速为0.2 mL/min, 经Waters UPLC BEH C18柱(50 mm×2.1 mm, 1.7 μm)分离, 利用光电二极管阵列检测器(PDA)在220 nm波长下检测, 并通过质谱检测器(QDa)对目标洗脱峰进行追踪确证。在0.5~20 μg/mL浓度范围内, 3种大麻酚类化合物的质量浓度与峰面积呈良好的线性关系, R≥0.999; 低、中、高添加水平的平均回收率为82%~102%, 相对标准偏差(RSD)在0.4%~4.1%之间。本方法稳定、简便、灵敏, 能够满足检测需求。根据Δ9THC、(Δ9THC+CBN)/CBD、Δ9THC/CBD或CBN/CBD表型指数, 区分不同产地大麻的化学表型, 为大麻植物的检测分析和质量控制提供了有效手段。
关键词超高效液相色谱质谱联用; 大麻植物; Δ9四氢大麻酚; 大麻酚; 大麻二酚; 化学表型
1引 言
大麻植物是非法加工制造大麻制品的基本原料。大麻中的大麻酚类化合物是影响中枢神经最重要的成分, 其中作用最强的精神活性物质是Δ9四氢大麻酚(Δ9Tetrahydrocannabinol, Δ9THC), 非精神活性的大麻二酚(Cannabidiol, CBD)可以调节Δ9THC的欣快效应, 大麻酚(Cannabinol, CBN)具有镇静和麻醉功效\[1,2\]。大麻酚类类化合物的含量受遗传、栽培环境、收获时间、储存条件等因素的影响 \[3~5\], 根据以下3种表型指数, 可将大麻分为毒品型大麻(Ⅰ型)和纤维型大麻(Ⅱ型)\[2,6~9\]:(1)依据Δ9THC含量判断。若Δ9THC含量>0.3%, 则为毒品型大麻; 若Δ9THC含量<0.3%, 则为纤维型大麻。(2)依据表型指数计算公式(Δ9THC+CBN)/CBD判断。若表型指数>1, 则为毒品型大麻; 若表型指数<1, 则为纤维型大麻。(3)依据两个表型指数Δ9THC/CBD和CBN/CBD判断。若两个表型指数之一大于1, 则为毒品型大麻; 而如果两个都小于1, 则为纤维型大麻。
目前, 对大麻酚类的分析检测方法主要有气相色谱串联质谱法(GCMS/MS)、液相色谱串联质谱法(LCMS/MS)。气相色谱分析过程需要对大麻样品进行加热衍生化的前处理, 在此过程中, 酸性大麻酚类会脱羧成为它们的中性对应物\[6,8\]; 液相色谱法则不需要加热即可直接分析测定大麻中的酸性和中性大麻酚类\[10~13\], 实现对大麻植物中组成成分的完整分析。Happyana等采用LCMS方法对大麻植物中大麻酚类成分的分析检测, 耗时40 min\[1\]。Ambach等采用HPLCDAD方法, 将时间缩短至16 min\[10\]。本研究的超高效液相色谱采用高压小颗粒填料, 使分析效率和分离度显著提高\[14~17\], 同时借助QDa质谱检测器对目标物分子信息进一步确认。利用此技术, 成功建立了一种可在7 min内完成对大麻植物中3种成分Δ9THC、CBN和CBD检测的分析方法(3种大麻酚类的分子结构式见图1), 从而实现对大麻植物化学表型的分类, 为大麻原植物类毒品犯罪的缉查及从法庭科学角度为大麻原植物类毒品犯罪的定罪量刑提供科学依据和理论参考。
2实验部分
2.1儀器与试剂
ACQUITY UPLC HClass超高效液相色谱仪(Waters EmpowerTM3数据处理系统, 美国Waters公司); ACQUITY光电二极管阵列检测器(PDA, 可操作波长190~500 nm, 光学分辨率1.2 nm)和ACQUITY QDaTM质谱检测器(美国Waters公司); 超声波清洗器(昆山市超声仪器有限公司); 台式高速冷冻离心机(德国Sigma公司); Mettler ToledoXS105电子天平(瑞士Mettler公司); 高速万能粉碎机(天津市泰斯特仪器有限公司); 0.22 μm MCE针头式过滤器(上海岛津技迩商贸有限公司)。
甲醇(美国Fisher Scientific公司)、甲酸(美国Sigma公司)为色谱纯; 实验用水均为超纯水(美国Millipore公司超纯水装置制备); Δ9THC、CBD和CBN标准品(均为1.0 mg/mL甲醇溶液, 美国Cerilliant公司),
Symbolm@@ 20℃避光保存。
混合标准溶液的配制:分别准确移取Δ9THC、CBD和CBN标准储备液置于2 mL容量瓶中, 以甲醇稀释并定容, 配制成0.5、1、2、5、10和20 μg/mL的系列混合标准溶液。
2.2样品前处理
选取不同产地的30个大麻样本, 经登记备案获批后, 研磨成均匀细粉待用。准确称取10 mg大麻植物粉末, 置于15 mL塑料离心管中, 加入甲醇5 mL, 经水浴超声萃取30 min后, 以6000 r/min离心5 min, 取上清液过0.22 μm针孔滤膜, 供UPLC/PDAQDa分析。
2.3分析条件和数据分析
色谱条件:色谱柱为Waters ACQUITYTM UPLC BEH C18柱(50 mm×2.1 mm, 1.7 μm); 柱温35℃; 样品室温度为20℃; 进样体积为2 μL; 流动相为甲醇(含0.1%甲酸)水(87∶13, V/V), 等度洗脱, 流速为0.2 mL/min; 在220 nm波长处进行检测; 使用10%甲醇溶液清洗密封圈; 运行时间7 min。
质谱条件:Waters质谱检测器QDa, 电喷雾离子源, 扫描质量范围为m/z 100~500 Da。从超高效液相色谱柱流出来的样品直接进入质谱分析, 正离子扫描, 采样速率10点/s, 毛细管电压为0.8 kV, 锥孔电压为30 V, 探头温度为600℃。
利用Waters EmpowerTM3数据处理系统得到3种大麻酚类化合物的含量数据, 采用SIMCAP11.5 (Umetrics AB, Umea, Sweden)软件作主成分分析, 通过得分图获得不同产地大麻样本的分型信息。
3结果与讨论
3.1样品前处理条件的优化
为进一步优化前处理条件, 实验选用甲醇作为提取剂, 以超声方式进行萃取, 考察了不同萃取时间(15、 30和45 min)和萃取次数(1和2次)对大麻酚类提取效率(峰面积)的影响。最终采用30 min超声1次的条件, 第1次提取后, 各目标物峰面积均达到两次提取各目标物峰面积之和的95%以上。
3.2 UPLC/PDAQDa条件的选择
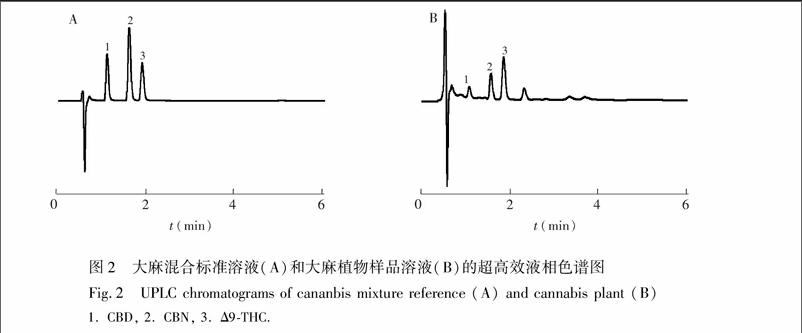
为改善峰形, 本实验尝试在甲醇中加入0.1%甲酸溶液, 采用甲醇水(87∶13, V/V)等度洗脱时, 不仅能达到较好的分离效果, 且分离时间较短, 目标分析物可在4 min内流出色谱柱。为避免天然产物中组分众多可能存在的样品间干扰, 将分离检测时间延长至7min。采用优化后的实验条件, 对大麻混合标准溶液及大麻植物样品溶液检测, 3种目标大麻酚类化合物的色谱图见图2。
3.3UPLC方法学验证
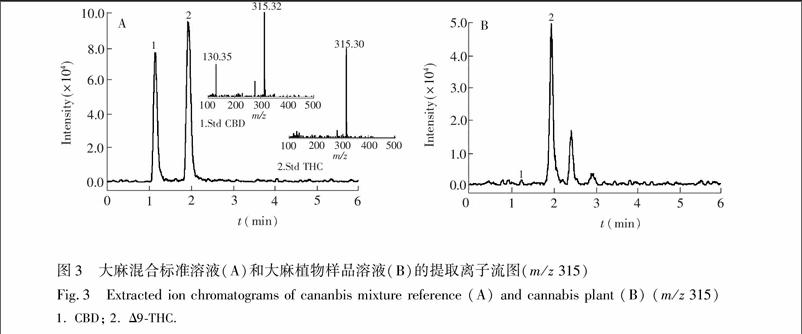
3.3.1方法的专属性在方法建立期间, 通过优化峰间距并增大分离度, 保证峰的专属性。CBD、CBN和Δ9THC的保留时间分别为1.1、1.6和1.9 min, 各成分与其相邻色谱峰的分离度均大于1.6, 拖尾因子在1.16~1.23之间。同时, QDa检测器作为光学数据的补充, 具有更高质量的定性质谱数据, 可对组分进行进一步确证。在正离子模式下扫描, 根据对混合标准溶液的碎片离子质谱图分析, Δ9THC、CBN和CBD的m/z分别为315、311和315。分别在m/z 315和311下提取离子流质谱图, 对大麻样本的洗脱峰进行比对分析。图3和图4是利用质谱检测器QDa对Δ9THC、CBN和CBD各峰的追踪确证结果, 与PDA检测分析一致, 且无基质干扰。在选定实验条件下, 所测的3个大麻酚类组分与其它组分完全分离, 满足含量测定要求。
3.3.2线性关系、检出限和定量限配制3种大麻酚类化合物浓度分别为0.5~20.0 μg/mL的系列混合标准溶液, 按照上述条件进行检测分析。以各分析物的峰面积Y为纵坐标, 浓度X(μg/mL)为横坐标, 绘制标准曲线, 进行线性回归分析。采用向空白样品中逐级降低加标浓度的方法确定检出限(LOD)和定量限(LOQ), 按照信噪比S/N≥3和S/N≥10分别计算检出限和定量限。3种大麻酚类化合物的回归方程、线性范围、相关系数、定量限及检出限见表1, 在0.5~20.0 μg/mL浓度范围内, 3种大麻酚类化合物线性关系良好(R≥0.999), 可满足定量分析的要求。
3.3.3准确度和精密度向已知含量的大麻样品中分别添加低、中、高浓度水平的混合标准品,
每个浓度水平做6次平行实验, 进行加标回收实验, 评价方法的准确度。同时, 对每个浓度水平在一天内重复测定6次, 连续测定6天, 评价方法的日内精密度(Intraday precision)和日间精密度(Interday precision)。由如表2可知, 3种大麻酚类化合物的加标回收率范围为82%~102%, 相对标准偏差(RSD)均小于5%, 表明本方法精确可靠, 重复性良好。
3.4实际样品分析
应用本方法测定不同产地的大麻植物样本中 3种大麻酚类化合物的含量, 依据不同的表型指数计算公式对样本进行化学表型划分, 结果见表3。
受遗传特征、栽培环境、收获时间、储存条件等因素的影响, 大麻植物样本中3种大麻酚类化合物的含量有很大差异。在许多国家, 大麻种植被认为是非法的, 而在允许种植的国家中, 需要测试栽培品种中精神活性物质Δ9THC的含量需低于法律允许下限。在欧洲, 允许种植的大麻, 其Δ9THC最大含量为干物质重量的0.2%或0.3%, 以此作为国家规定限度\[11\]。本实验测定的大麻植物样本中Δ9THC、CBN和CBD含量变化范围分别在0.026%~1.44%、0.006%~3.33%和0.006%~3.84%之间。根据含量结果判断, 表3中有12个大麻样本的Δ9THC含量大于0.3%, 可归为毒品型大麻。
据文献\[4\]报道, 由于对热和光的不稳定性, 大麻植物样品中的Δ9THC浓度会随时间延长而降低。考虑到检材中大麻酚类受环境等因素造成的含量變化, 可以3种大麻酚类化合物的相对组成含量判断化学表型。以表型指数(2)进行样本分型, 有17个样本被归为毒品型, 其中有9个样本的Δ9THC含量均低于0.3%, 但仍归为毒品型大麻。表型指数(3)是对表型指数(2)的拆分, 据此分型, 得到判断与表型指数(2)的结果一致。
3.5基于主成分分析的分型研究
主成分分析(Principal component analysis, PCA)通过对数据进行降维处理后, 可以直观显示各组样品的差异\[18~20\]。以大麻样本中Δ9THC、CBN、CBD的含量为变量, 作主成分(PCA)分析, 将黑龙江、内蒙古、新疆和陕西4个产地大麻样本的30组含量数据导入SIMCAP软件, 将数据标准化后进行PCA分析, 3种大麻酚类化合物的累计贡献率达到94.4%, 所得的载荷图如图5所示, 不同产地的大麻样本被分为2类即毒品型和纤维型大麻, 按照3种大麻酚类化合物的影响进行分类, 获得与表型指数(1)吻合的分型结果。
4结 论
本研究采用光电二极管阵列(PDA)检测器与质谱检测(QDa)技术联用, 建立了同时测定大麻植物中3种大麻酚类化合物含量的超高效液相色谱与质谱联用分析方法, 可对3种大麻酚类实现色谱的快速分离及质谱的追踪确证。利用本方法对不同产地的大麻植物样本进行含量分析, 并对利用不同的表型指数和主成分分析判断大麻植物的化学表型进行了探讨, 为监测和打击毒品型大麻的非法种植提供了高通量快速检测方法和判断依据。
References
1Happyana N, Agnolet S, Muntendam R, Dam V, Schneider B, Kayser O. Phytochemistry, 2013, 87: 51-59
2BenjaminD B, Kevin M, Alain G V, Corinne C. J. Forensic sci., 2012, 57(4): 918-922
3Turner C E, Hadley K W, Fetterman P S, Doorenbos N J, Quimby M W, Waller C. Journal of Pharmaceutical Sciences, 1973, 62(10): 1601-1605
4Trofin I, Vlad C, Dabija G, Filipescu L. Revista de Chimie, 2011, 62(6): 639-645
5Fairbairn J W, Liebmann J A, Rowan M G. J. Pharmacy Pharmacol., 1976, 28: 1-7
6Tipparat P, Natakankitkul S, Chamnivikaipong P, Chutiwat S. Forensic Sci. Inter., 2012, 215: 164-170
7Stefanidou M, Dona A, Athanaselis S, Papoutsis I, Koutselinis A. Forensic Sci. Inter., 1998, 95: 153-162
8Pellegrini M, Marchei E, Pacifici R, Pichini S. J. Pharmaceut. Biomed. Anal., 2005, 36: 939-946
9Oliveira G L, Voloch M H, Sztulman G B, Neto O N, Yonamine M. Forensic Toxicol., 2008, 26: 31-35
10Ambach L, Penitschka F,Broillet A, Knig S, Wolfgang W, Bernhard W. Forensic Sci. Inter., 2014, 243: 107-111
11Backer B D, Debrus B, Lebrun P, Theunis L, Dubois N, Decock L, Verstraete A, Hubert P, Charlier C. J. Chromatogr. B, 2009, 877: 4115-4124
12Gambaro V,Acqua L D, Farè F, Froldi R, Saligari E, Tassoni G. Anal. Chim. Acta, 2002, 468: 245-254
13Peschel W, Politi M. Talanta, 2015, 140: 150-165
14ZHANG Gang, GUO JiangNing, BI KaiShun. Journal of Shenyang Pharmaceutical University, 2003, 34(5): 269-271
张 岗, 郭江宁, 毕开顺. 沈阳药科大学学报, 2003, 34(5): 269-271
15ZHANG AiZhi, WANG QuanLin, MO ShiJie. Chinese Journal of Chromatography, 2010, 28(11): 1015-1019
张爱芝, 王全林, 莫世杰. 色谱, 2010, 28(11): 1015-1019
16ZHANG AiZhi, WANG QuanLin. Food Science, 2011, 32(10): 194-198
张爱芝, 王全林. 食品科学, 2011, 32(10): 194-198
17Waseem G, Shahbaz W G, Mohamed M R, Amira S W, Zlatko M, Ikhlas I K, Maged H S, Mahmoud A E. J. AOAC Inter., 2015, 98(6): 1523-1528
18SIRI Guleng, LIU XiaoLing, LI TongMei, SHI LuWen. Chinese J. Anal. Chem., 2015, 43(5): 675-681
斯日古楞, 刘小玲, 李冬梅, 史录文. 分析化学, 2015, 43(5): 675-681
19LI Xue, PI ZiFeng, XING JunPeng, LIN Na, LIU ZhiQiang, SONG FengRui. Chinese J. Anal. Chem., 2014, 42(11): 1646-1650
李 雪, 皮子鳳, 邢俊鹏, 林 娜, 刘志强, 宋凤瑞. 分析化学, 2014, 42(11): 1646-1650
20ZENG MaoMao, LI Yang, HE ZhiYong, QIN Fang, CHEN Jie. Chinese J. Anal. Chem., 2014, 42(1): 71-76
曾茂茂, 李 洋, 何志勇, 秦 昉, 陈 洁. 分析化学, 2014, 42(1): 71-76
- 高职物流管理专业信息化教学平台构建初探
- 基于应用型人才培养的管理会计教学改革探索
- 浅谈人工智能技术在慕课发展中的应用
- “产教融合”校企合作人才培养模式的新思考
- 互联网环境下高校创新创业平台建设研究
- 劳动争议调解管理体系调研与改进建议
- 我国控烟现状与政策分析
- 浅谈医保基金监管中协议管理模式的优化
- 测绘技术在土地管理中的应用研究
- 公共文化服务体系视角下博物馆品牌授权管理研究
- 我国城市突发事件应急管理能力建设路径研究
- 公共管理模式构建现状及途径研究
- 公共部门人力资源管理研究
- 浅谈福莱特融合统一思想对公共部门人力资源管理的启示
- 大数据时代新型伦理研究
- 新时代公共图书馆数字资源建设探析
- 图书管理信息系统在图书管理中的优势与应用策略研究
- 大数据视角下农业科研信息资源共建共享模式探索
- 浅谈大数据背景下中职学校综合档案管理信息化的实现路径
- 浅谈新时期如何做好事业单位统计工作
- 企业级人脸识别门禁系统的应用研究
- 无线网络安全防护技术研究
- 智能家居用的播放设备构建与实现研究
- 计算机数据库的构建与维护探讨
- 电力安装企业成本管理存在的问题及其原因分析
- unnicely
- unniceness
- unnicenesses
- unnicer
- unnicest
- unniched
- unnicked
- unnicknamed
- unnigh
- unnigher
- unnighest
- unnimble
- unnimbleness
- unnimblenesses
- unnimbler
- unnimblest
- unnimbly
- unnocturnal
- unnocturnally
- unnodding
- unnoised
- unnoisier
- unnoisiest
- unnoisily
- unnoisy
- 胯下辱
- 胯下韩侯
- 胯兜儿
- 胯子
- 胯衫
- 胯裆
- 胯骨
- 胯骨轴儿
- 胰
- 胰子
- 胰子盒儿
- 胰岛素
- 胰脏
- 胰腺
- 胱
- 胲
- 胲作服牛
- 胳
- 胳棱瓣儿
- 胳肢
- 胳肢窝
- 胳肢窝夹耗子——挟吱吱(假积极)
- 胳肢窝生疮——阴毒
- 胳肢窝里夹耗子
- 胳肢窝里放屁——没影子的事