
摘?要:化学是一门以实验为基础的学科,通过化学实验教学让学生亲身参与到对化学知识、概念、理论、原理的理解和探究过程中,从而培养学生科学的学习态度,逐步形成证据推理与模型认知、科学探究与创新意识、科学精神与社会责任的化学学科核心素养。文章阐述如何通过实验探究法开展电解原理教学培养学生的化学学科核心素养。
关键词:实验探究法;发展;学生;化学学科素养
一、 教学主题内容及教学现状分析
本节内容为人教版选修4第四章电化学第三节电解池,属新授课。电解原理和原电池原理都是电化学的重要基础理论。不同的是,原电池原理研究的是如何利用能够自发进行的氧化还原反应将化学能转化为电能;而电解池研究的是如何借助电能使不能自发进行的氧化还原反应能够发生,从而使电能转换成化学能。教材要求将理论研究与实践探讨放在重要位置。运用电解池原理将课本中的理论知识与实际化工生产联系起来,通过氯化铜溶液的电解实验引出電解原理,使学生在理解电解原理的基础上进一步学习电解原理在实际工业生产中的运用如氯碱工业、电解精炼铜、电镀工业等,体现化学学科学以致用的特点。从高二学生的实际情况来看,已具备了很强的观察能力和较好的阅读理解教材的能力,同时也具备了一定的动手操作简单化学实验的能力及实验记录能力。教学中可以充分发挥实验在教学中的作用,引导学生通过自己的观察,了解电解装置和实验过程中的现象,并用学到的知识分析电极表面发生变化的原因,从而体验电解池的功能认识电解质溶液的导电过程就是电解的过程。从知识结构上看,学生已经学习了原电池,因此学习电解原理,可以有效地进行实验探究。
二、 教学思想与创新点
为了使教学具有更强的逻辑性,体现探究精神,突出教学重点和难点,即:电解的基本原理和离子放电顺序,对教材在教学程序上进行了调整。根据原电池的形成条件和学生以前学过的电解水的实验,给出电解池的概念,让学生自己总结电解池的形成条件,将演示实验改为学生实验探究电解原理。并且在讲解放电顺序时,以前教学都是直接给出放电顺序,这次改为学生自己设计实验证明阴、阳极的放电顺序。根据本节课的教学内容和教学特点,采用实验探究方法展开探索的过程。在教学中将电解氯化铜教师演示实验改为学生探究实验,将阴、阳极的放电顺序设计为学生探究实验,使学生潜移默化地受到自然科学方法论思想的熏陶,发展学生证据推理与模型认知、科学探究与创新意识、科学精神与社会责任的化学学科核心素养。
三、 确定教学目标
1. 识记电解及电解池概念,理解电解原理,会通过电源正负极判断电解池的阴、阳极;2. 弄清电解池装置特点、形成条件,会判断阴极及阳极产物和发生的反应类型;3. 通过设计、动手实验,培养学生的观察能力,加强基本操作训练。使学生了解科学研究和探索的基本思路,让学生进行研究性学习。
四、 教学流程设计
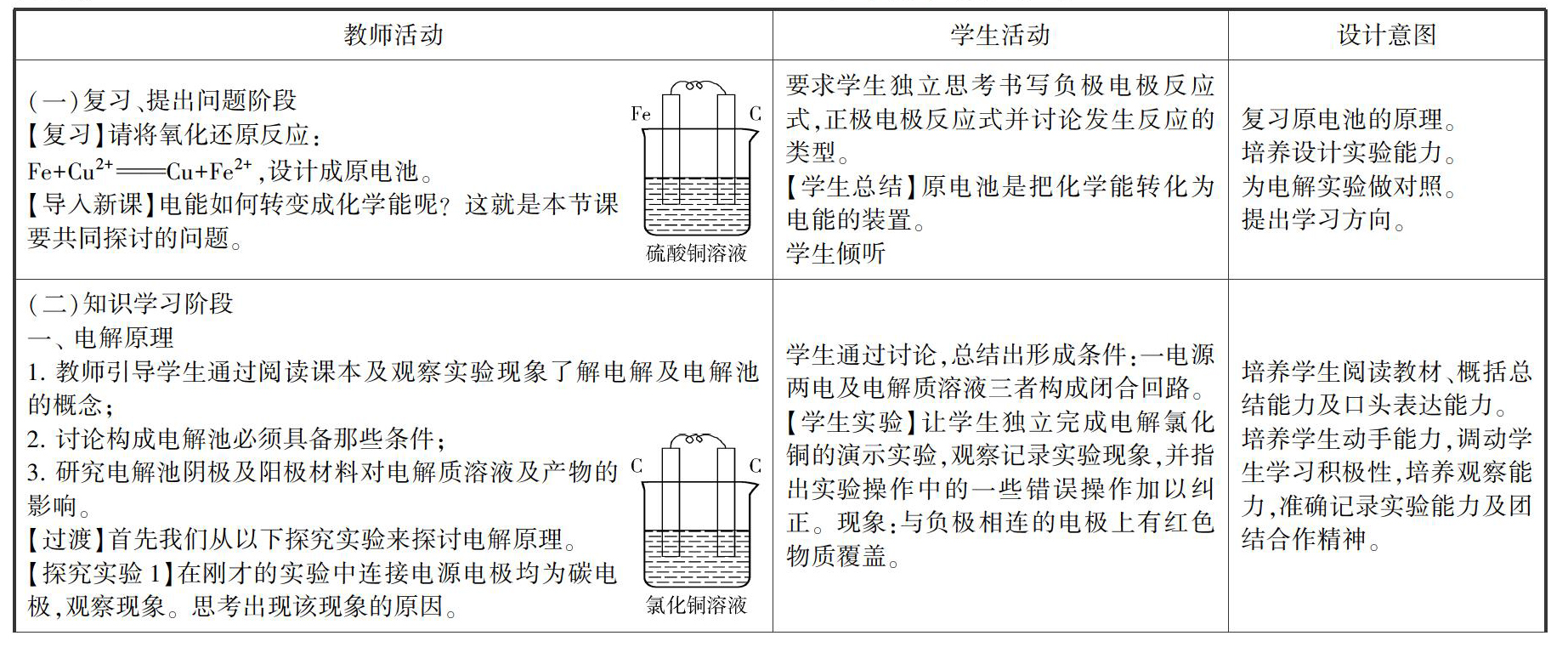
(一)复习、提出问题阶段
【复习】请将氧化还原反应:
Fe+Cu2+Cu+Fe2+,设计成原电池。
【导入新课】电能如何转变成化学能呢?这就是本节课要共同探讨的问题。
要求学生独立思考书写负极电极反应式,正极电极反应式并讨论发生反应的类型。
【学生总结】原电池是把化学能转化为电能的装置。
学生倾听
复习原电池的原理。
培养设计实验能力。
为电解实验做对照。
提出学习方向。
(二)知识学习阶段
一、 电解原理
1. 教师引导学生通过阅读课本及观察实验现象了解电解及电解池的概念;
2. 讨论构成电解池必须具备那些条件;
3. 研究电解池阴极及阳极材料对电解质溶液及产物的影响。
【过渡】首先我们从以下探究实验来探讨电解原理。
【探究实验1】在刚才的实验中连接电源电极均为碳电极,观察现象。思考出现该现象的原因。
学生通过讨论,总结出形成条件:一电源两电及电解质溶液三者构成闭合回路。
【学生实验】让学生独立完成电解氯化铜的演示实验,观察记录实验现象,并指出实验操作中的一些错误操作加以纠正。现象:与负极相连的电极上有红色物质覆盖。
培养学生阅读教材、概括总结能力及口头表达能力。
培养学生动手能力,调动学生学习积极性,培养观察能力,准确记录实验能力及团结合作精神。
【总结】电流通过电解质溶液时,在阴阳两极发生了氧化还原反应。
【启发引导】请大家根据实验现象和氯化铜溶液的组成成分以及原有知识分析推断两极生成物的名称。
【讨论】1. 通电前溶液中存在哪些离子?这些离子是如何运动的?
【讨论】2. 接通直流电后,原来的离子运动发生了怎样的改变?
4. 有关离子在两极发生何反应?
5. 电极的规定和电极反应式的书写
阳极:与电源正极相连的一极
2Cl--2e=Cl2?氧化反应
阴极:与电源负极相连的一极
Cu2++2e=Cu?还原反应
总反应化学方程式:CuCl2通电Cu+Cl2
【概括】通俗记法,利用谐音。
阳(极)—氧(化反应)
与正极相连的电极产生大量有刺激性气味的气体,并能使湿润的淀粉碘化钾试纸变蓝。
学生思考:
产物为氯气和铜
讨论分析、回答:
1. 通电前溶液中Cu2+、Cl-、H+、OH-,自由移动。
2. 通电后带正电的Cu2+、H+向阴极移动;带负电的Cl-、OH+向阳极移动。
3. Cu2+在阴极得电子变成了单质Cu,Cl-在阳极失电子变成了Cl2。
学生记录
调动学生思维,分层次思考,有利于激发学习兴趣,分析方法在教学中潜移默化地渗透。
实现感性认识到理性认识的过程。
加深记忆,培养兴趣。
【理论探究】CuCl2溶液中有自由移动的Cu2+、Cl-、H+、OH-,为什么只有Cu2+、Cl-得失电子,而H+、OH-却不能在两极得失电子呢?
【设计实验】根据所学知识设计实验判断下列粒子的还原性强弱。
Cu、Cl-、Br-、I-、SO2-4、OH-。
【教师分组】将学生分为两大组做探究实驗2、3。
【探究实验2】将实验一中的阳极用铜电极代替,观察现象。
【探究实验3】将实验一中的溶液改为CuSO4溶液。观察现象。
【学生活动】思考:认为与离子的氧化性、还原性强弱有关。
【学生活动】学生讨论,分析可将铜电极代替石墨电极电解CuCl2溶液;和均用石墨电极电解硫酸铜溶液。
学生动手实验:
实验2:现象阳极无气体产生,铜电极溶解;
实验3:两电极均产生无色无味的气体。
调动学生处于积极思考状态,培养思维能力。
创设问题情境激发学生求知欲望,培养学生设计实验的能力、动手能力。
【讲述】电解质溶液中离子在两极上得失电子有一定顺序,我们称之为放电顺序,放电顺序涉及多种因素,在中学阶段只要求掌握常见的一些物质或离子的放电顺序。
学生总结:
阴极放电顺序:按金属活动性顺序越不活泼的金属其阳离子越容易得电子。
阳极放电顺序:金属(除Pt、Au)>S2->I->Br->Cl>OH->含氧酸根。
培养学生语言表达能力、协调能力和总结能力。
【质疑】在电解过程中,电子是如何形成闭合电路的?
【归纳】电子的方向与电流的方向相反从电源负极流出,流向电解池的阴极,阴极附近的Cu2+在阴极得电子被还原为铜,溶液中的阴离子定向移动,阳极附近的Cl-在阳极失电子被氧化为氯原子。氯原子结合形成氯气分子,失去的电子从阳极流回电源的正极,从而形成闭合电路。
看课本第80页,归纳电子流动方向:
电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极
创设问题情境激发学生求知欲望,使学生处于思考问题,探索问题的情境中,有利于训练学生思维,调动学习积极性。
【思考】我们知道金属、电解质溶液都能导电,那么是由于什么原因?
【小结】电解概念及电解的原理,理顺知识,要求会判断电解池的阴阳两极,写电极反应方程式,判断发生氧化还原反应。
回答:金属导电靠自由电子的定向移动,移动过程不发生化学变化。电解质溶液导电是阴阳离子的定向移动,在两极发生氧化还原反应。
明确应该掌握的内容。
【作业】学案相应习题。巩固所学知识
五、 教学效果与反思
从教学效果来看达到了预期的学习目标,较好地完成了教学任务。本课时主要采用了实验、比较、探究等教学方法。这样做的理由是:
1. 可使学生对原电池和电解池的反应原理理解得更深入,更透彻,可有效地避免学生对二者概念的混淆。
2. 用实验作为理论的依据,可直观、形象地说明抽象的道理。在本讲中教师利用电脑、投影等多媒体手段模拟溶液中离子的运动并形象地表达阴阳电极反应,也是为了使学生的印象更加深刻。
3. 让学生动手参与实验、设计实验、探究实验,同时也可发展学生证据推理与模型认知、科学探究与创新意识、科学精神与社会责任的化学学科核心素养,提高学生的综合素质。
另外,本课时还特意补充了金属电极做阳极的知识,这主要是为下一课时的学习做准备,同时加深学生对电解原理的认识。
4. 本节课实验准备工作量大,需要学校化学实验室实验员、高二化学备课组老师通力合作才能完成。
参考文献:
[1]普通高中化学课程标准(2017版).人民教育出版社.
作者简介:
胡金凤,副高级,甘肃省平凉市,甘肃省泾川县第一中学。
- 会计的人文精神
- 新准则下职工薪酬核算的财税处理
- 有关股权投资之间转换的会计核算问题研究
- 成本会计中沉没成本效应分析
- 资讯
- 企业估值的困惑与求索
- 关于扩大启运港退税政策试点范围的通知财政部? 海关总署 ?国家税务总局
- 关于公共基础设施项目享受企业所得税优惠政策问题的补充通知
- 法规·法规解读
- 股市“不死鸟”将成为历史
- 关于实施全国中小企业股份转让系统挂牌公司股息红利差别化个人所得税政策有关问题的通知
- 关于进一步明确国有金融企业直接股权投资有关资产管理问题的通知
- 关于创新税收服务和管理的意见
- 关于纳税人对外开具增值税专用发票有关问题的公告
- IASB就生产性植物修订IAS 16及IAS 41
- FASB发布股份报酬会计准则更新
- 英国多位名人卷入逃税风波
- 国务院决定免征新能源汽车车辆购置税
- 国际货物运输代理服务免征增值税
- 8月1日起启用新版增值税发票
- 中国建筑材料工业新兴产业发展纲要发布
- 证监会修订并购重组两大制度
- 审计署6年联合国审计工作结束
- 三家民营银行获准筹建
- 金砖国家开发银行成立
- repeatabilities
- repeatability
- repeatability's
- repeated
- repeatedly
- repeating
- repeatings
- repeat itself
- repeat performance
- repeats
- repeat yourself
- repeat²
- repeat¹
- repeddle
- repeddled
- repeddles
- repeddling
- repegged
- repegging
- repegs
- repel
- repellants
- repelled
- repellences
- repellent
- 梯子万儿
- 梯子中间止步——上不上,下不下
- 梯子蔓
- 梯山
- 梯山架壑
- 梯山栈谷
- 梯山航海
- 梯峤
- 梯崖
- 梯己
- 梯己人
- 梯己信儿
- 梯己话
- 梯希
- 梯度
- 梯度发展
- 梯形
- 梯形微笑
- 梯径
- 梯恩梯
- 梯接
- 梯林
- 梯栏远眺
- 梯桄
- 梯次