
思维定势是指人们习惯于用某种固定的方式去考虑问题的思维倾向。思维定势对解决问题有积极作用,也有消极作用。不良的思维定势容易把学生引入歧途,产生错误。下面,笔者对化学中常见不良思维定势的成因及其应对策略做个简单地探讨,希望能抛砖引玉。
一、因题目似曾相识而产生思维定势
学生在考试中总会遇到一些似曾相识或很熟悉的题型,
忽略了两者之间的差异性,其结果必然是差之毫厘,缪之千里。
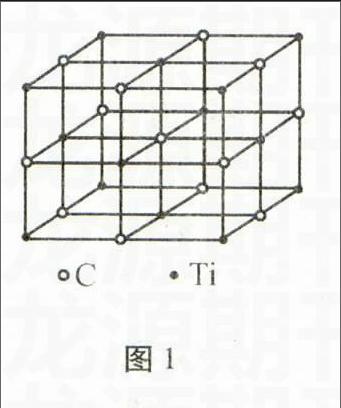
图1
例1最近科学家发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是 ( )。
A.TiC B.Ti5C7 C.Ti14C13 D.Ti13C14
定势错解利用均推法,计算出Ti原子与C原子的个数比为:(1/8×8+1/2×6)∶(1+1/4×12)=1∶1,因此选A。
错误剖析学生平时习惯了利用晶胞图推断晶体化学式,没有注意题中明确图中所表示的是团簇分子,而不是晶胞,于是产生了思维定势,直接利用均推法解题,从而造成错解。
正确解法只要数出Ti原子和C原子个数即可。由图可知,分子中有14个Ti原子和13个C原子,因此,该分子的化学式为Ti14C13,正确答案是C。
应对策略准确理解题意是正确解题的根本前提,学生平时就要养成认真审题的良好习惯。考试中,往往越熟悉的题目越危险,学生越要认真对待,越要咬文嚼字仔细推敲,弄清题意。同时,教师在教学过程中,要适当运用变式训练,让学生比较分析、找出异同,提高学生鉴别能力,克服不良思维定势的影响。
二、因题中初始条件而产生思维定势
在有多个小问的试题中,命题者经常先在一个情形境下设置一个小问题,然后悄然改变情境后再设置另一小问题,引诱学生上当。不少基础不扎实的学生,可能就会因为初始情境的干扰,采用原来方法解决新的问题,从而产生思维定势,给后面的分析带来障碍。
例2通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱。
化学键Si-OSi-ClSi-SiSi-C
键能/kJ·mol-1460360176347
请比较下列两组物质的熔点高低(填“>”或“<”):Si
C Si;SiCl4 SiO2。
定势错解Si-C的键能大于Si-Si的键
能,因此,SiC熔点高于Si。SiCl4中有4个Si-Cl键,SiO2中只有2个Si-O键,360×4 > 460×2,故熔点SiCl4 > SiO2。
错误剖析对于SiC和Si等原子晶体来说,熔化时主要需克服原子间的键能,键能越大其熔点就越高。有了前面的情境,不少学生产生了思维定势,认为只要比较等物质的量SiCl4、SiO2的键能即可判断其熔点高低。这些学生恰恰忽略了SiCl4和SiO2晶体类型不同的事实。
正确解法SiCl4属于分子晶体,熔化时主要需克服范德华力;SiO2属于原子晶体,熔化时主要需克服共价键的键能。因此,SiCl4熔点远低于SiO2熔点。
应对策略对于此类试题学生要注意明察秋毫,洞察题给条件的变化,及时调整解题思路。这种类型的不良思维定势,说到底还是因为双基不够扎实。
三、因片面理解结论或规律而产生思维定势
任何化学结论、规律都有其一定的适用范围,如果不能理解这些化学结论、规律的内涵和外延,死搬硬套必然会产生不良思维定势,发生错误就难以避免了。
例3常温下,用Al、Cu 作电极,用浓HNO3作电解质溶液时, 作负极,电极反应为: ; 为正极,电极反应为: ;总反应为: 。
定势错解活泼金属Al作负极,电极反应为:Al-3e-Al3+;铜为正极,电极反应为:4H++NO-3+3e-NO↑+2H2O;总反应为:Al+4H++NO-3Al3++NO↑+2H2O。
错误剖析错解中犯了思维定势的毛病,片面地认为活泼金属一定做负极,不活泼金属一定做正极。其实,原电池反应的实质是自发氧化还原反应,能自发发生氧化反应的一极才是负极。
正确解法常温下,Al在浓HNO3中会发生钝化现象,此种情况下,是Cu更容易与浓HNO3发生氧化反应,因此Cu才是负极,电极反应为:Cu-2e-Cu2+;Al只能做正极,电极反应为:4H++2NO-3+2e-2NO2↑+2 H2O,总反应为:Cu+4H++2NO-32NO2↑+2H2O。
应对策略对于一些化学结论、规律,学生要理解结论或规律的来龙去脉,掌握结论或规律的内涵和外延,这样才能在考试中做到游刃有余,以不变应万变。以本题中原电池正负极的判断为例:一般情况下,相对活泼的活泼金属更容易失去电子,发生自发氧化反应,是原电池负极。但负极的实质不是因为金属活动性强,而是金属能在电解质溶液中发生自发的氧化反应,如果它不能发生自发氧化反应了,当然就不能做负极。如果学生理解其中的道理,本题就不会犯错了。
四、因某种解题习惯而产生思维定势
学生反复解答某类试题时会逐渐形成自己的解题习惯。这些解题习惯本来就可能有缺陷,在某种情况下如果学生不能学会变通,死守习惯,就可能钻进命题者设置圈套中。
例4熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2CO2-34CO2+4e-
阴极反应式:
总电池反应:
定势错解不少学生习惯于先写出阳极和阴极的反应式,然后二者相加得出总反应式,但一般情况下CO2不能燃烧,也就是说CO2不与O2反应,因此他们写不出阴极反应式,也就写不出总电池反应式。
错误剖析正难则逆。本题如果先写阴极反应式的确有点难度,但我们如果换个思路——先写电池的总反应式,再根据总反应式和阳极的反应式去写阴极反应式,这样就容易多了。
正确解法既然以CO为阳极燃气,那电池的总反应式肯定是2CO+O2→2CO2;用总反应式减阳极反应式就可以得到阴极反应式:O2+2CO2+4e-
→2CO2-3。
应对策略学生思维呆板、缺乏变通是产生不良思维定势的重要原因之一。在教学中,教师要注重培养学生思维的灵活性、发散性和创造性,要引导学生从多个角度思考问题,不拘泥于现成的模式,敢于创新,善于创新,让学生形成良好的思维品质。
(收稿日期:2014-09-22)
- 初中数学小组合作学习课堂评价的探究
- 高中化学核心素养的培养与教学实践
- 微课程在小学英语课堂教学的应用思路
- 多媒体在高中历史教学中的应用研究
- 高考背景下的高中美术教学效率提高的策略探究
- 关于问题导学法在初中数学教学的有效运用思考
- 试论“核心素养”下物理概念的教学
- 浅谈跨学科知识在初中科学教学中的应用
- 自主学习构建高中化学微课高效课堂
- 浅议初中语文高效阅读教学的开展
- 初中数学教学中运用数学概念的有效策略探讨
- 初中语文散文教学新探
- 浅析数形结合在初中数学教学中的运用
- 九年级数学高效课堂构建策略探究
- 翻转课堂在高中生物教学中的应用分析
- 浅析高中物理教学改革的尝试与思考
- 浅析新课标背景下初中语文高效课堂的构建
- 浅谈微课在小学数学课堂教学中的应用
- 新课程标准下语文课堂教学模式初探
- 浅谈合作学习在中职英语教学中的应用
- 武都民俗文化创新第二课堂之探究
- 小学高年级语文阅读教学浅析
- 刍议核心素养背景下初中数学高效课堂的构建
- 道德课堂彰显生命的活力
- 翻转课堂在初中语文教学中的应用探讨
- social climber
- socialcost
- social cost
- social democracies
- social democracy
- social democrat
- social democratic
- social democrats
- socialinsurance
- social insurance
- socialisable
- socialisation
- socialise
- socialised
- socialises
- socialising
- socialism
- socialisms
- socialist
- socialistically
- socialists
- socialite
- socialites
- socializable
- socializations
- 基色
- 基薪
- 基诺族
- 基诺族古俗中的贝崇拜
- 基调
- 基质
- 基趾
- 基趾如星
- 基辅
- 基辅罗斯
- 基部
- 基里巴斯
- 基量范围量词
- 基量词
- 基金
- 基金套餐
- 基阯
- 基隆市
- 基音
- 基频
- 埻
- 埻的
- 埼
- 埽
- 埽穴犁庭