汪定用
摘要:初中化学用语的计算教学存在简单化和技能化倾向,忽略了学科本质。从启蒙和学科价值的角度来重新审视化学用语计算,并提出以计量思想为底色,走向学科智慧品质,即在相对原子质量中体现科学计量思想、用整体局部思想建构有关相对分子质量计算中的宏微关系、用符号表征思想领会根据化学方程式计算的本质等。
关键词:观念启蒙;计量思想;化学用语;计算教学
文章编号:1008-0546(2017)07-0024-04 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2017.07.006
从启蒙的意义上看,初中化学不能视作化学学习的简单阶段,更不能视作所谓文科化的记忆阶段,初三化学应是从生活经验出发并面向学科素养的学科启蒙。在这个阶段,学生的学习既离生活最近,又紧密联系和建构学科根基。这个阶段的学习虽然说在知识上是少的,简单的,但是在形成学科观念上是丰富而深刻的。
初中化学用语计算是初中化学计算中的主体内容,主要涉及有关相对分子质量、化合物中元素质量比、化合物中某元素质量分数、化合物纯度和根据化学方程式的计算,分别安排在化学式和化学方程式的教学主题中。在教学实践中,老师们认为课程标准对这些化学计算定位得比较浅。比如化学式中元素质量比的教学被简单化地视为分子中相对分子质量与原子个数乘积之比的模仿与操练过程,教学重心落在“纯数字”的处理上,而忽视元素质量比的概念含义和用分子中原子质量比来量化宏观元素的质量比等诸多计量上的内涵,忽略了化学计算在培养学科核心素养上的启蒙价值。因此,化学用语计算的教学需要由单一技能性知识教学转向关注学科观念本质的智慧教学,需要由固定的教学模式即“教师示范、学生模仿、教师讲解、学生操练”向生动深刻的学科理解性课堂教学转型。
一、计量思想催生了化学符号系统
质和量是物质存在的兩个基本属性,其中量包括质量和数量两个基本物理量。计量是用一个规定的标准已知量作单位,和同类型的已知量相比较而加以检定的过程。化学计量学源自于希腊语stoicheion(元素)和metron(测量)。是在德国化学家里希特的建议下提出的,目的是要得到某些化合物中各元素之间的质量比。近代科学史上的化学计量经历了当量定律、定比定律、原子量测定、化学符号和分子学说等阶段,由宏观计量领域走向微观计量领域。可以说,计量的发展成就了化学学科发展,尤其是催生了化学符号系统的发展[1]。例如,化学用语“H2O”的发展过程,普鲁斯特提出参与反应的物质,它们的质量都成一定的整数比,即1克氢气和8克氧气化合生成9克水,假如不按此比例,多余的就要剩余而不参加反应(即定比定律)。道尔顿在此基础上又提出组成化合物时,不同元素的原子之间以简单整数比相结合(即倍比定律),他认为水为二元分子,即HO,并测定出氧的相对原子质量为8。贝采里乌斯认为道尔顿测定的相对原子质量有误,重新测定了氧的相对原子质量为16,认为一个水分子是由一个氧原子和两个氢原子构成,并更新了新的化学符号系统,从而为水的化学式“H2O”的最终确定奠定了科学基础。
由此可见,化学用语是伴随着计量产生和发展的,既是计量的结果,又具有计量的内涵。由此,化学用语“语境”中的计算不只是简单意义上的数的运用,更不是一个单一的算的处理,而是计量层次上的内涵表达。这就是作为启蒙的初中化学用语计算的本质所在。
二、计量思想在化学用语计算教学中的实践
化学研究的物质及其物质变化存在着计量关系。从计量角度来看,物质的化学计量关系主要有两个物理量,即数量和质量,并由此延伸出浓度、酸碱度、反应速率等物理量;从计量思想来看,定量观是研究化学问题的重要思想方法,是用统计思想将宏观事实与微观本质联系起来,并将结果用符号来表征[2]。这里的计量思想主要是指在获取、表达和分析物质及其物质变化存在的数量和质量关系中提炼出来,有利于计量知识深刻理解的思维方法。初中化学定量观的计量思想主要有科学计量思想、整体局部思想、符号表征思想和量变质变思想。
1. 在相对原子质量中体现科学计量思想
相对原子质量既是原子质量的计量,又是后续有关分子质量和化学反应计量的基础,从计量思想的角度来把握相对原子质量这个概念,是化学用语计算教学的关键开局。
教学片断(人教版)
引入:微观上原子虽小,但它也是有质量的,不然宏观上的物质也就没有了质量。同学们估计一下,原子的质量有多大呢?
呈示与说明:
(1)观察图1。
(2)6.02×1023个碳原子虽说是一个天文数据,但却只有12g。
(3)出示与12g碳质量相当的砝码,即两个5g砝码和两个1g砝码。
感受:碳原子质量很小。
讲述:碳原子质量大约是1.993×10-26kg,氧原子质量约为2.657×10-26 kg,氢原子质量约为1.67×10-27 kg,可见用千克、克等计量单位来衡量原子的质量不合适,它使得数值太小,书写和使用都不方便。
思考:原子质量用怎样的计量单位来衡量比较合适?
讨论与汇报:用接近10-27 kg的计量单位。
介绍:
(1)以一种碳原子原子质量的1/12作为标准,即图2。
(2)列出氧原子、氢原子、碳原子等与这个标准的比式及比值。
(3)相对原子质量H-1、C-12的比较(见图3)。
(4)相对原子质量的定义。
练习:查阅铁原子和锌原子相对原子质量;由铁的相对原子质量56和锌的相对原子质量65,可以得出铁原子和锌原子在质量和数量上的哪些信息?
相对原子质量属于微观计量,以上片段包含三个教学环节:第一是通过天平情境勾勒出计量背景,在微观与宏观的联系中建立微观直观,并体会原子质量的真实存在和极其微小,为探寻合适的计量单位打下伏笔,并为高中“物质的量”提前建立一致性关联;第二是寻找合适的计量单位,并在求算中体验计量标准和相对原子质量的概念,这是教学的难点;第三是在具体情境中运用相对原子质量,体会相对原子质量的计量意义。而这三个环节都是围绕科学计量思想这个核心来展开。让学生感受到使用什么样的标准而使计量结果准确简约是计量智慧层面上的思考,亦即科学计量思想。而这里科学计量思想的启蒙对于后续化学用语计算,还有溶液的浓度表示、溶解度等教学具有迁移作用。
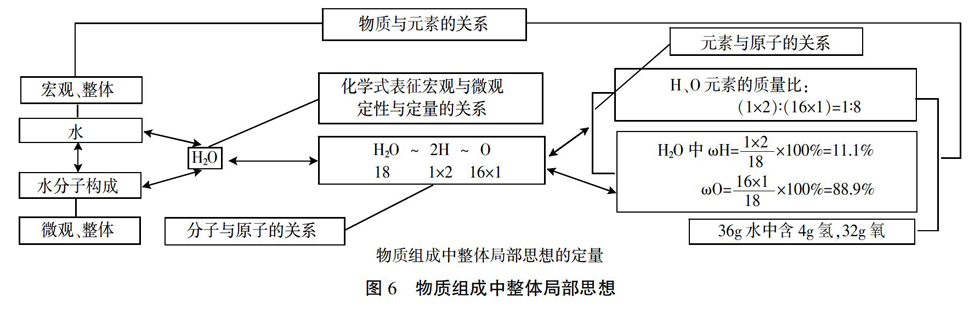
2. 用整体局部思想建构有关相对分子质量计算中的宏微关系
有关相对分子质量的计算包括相对分子质量、物质组成中元素质量比和物质中某元素质量分数三部分内容,其中相对分子质量是基础,宏观上的元素质量比、元素质量分数与微观上的分子中原子质量比、原子质量分数建立实质性联系是教学难点。
教学片断(人教版)
环节一:相对分子质量
谈话:
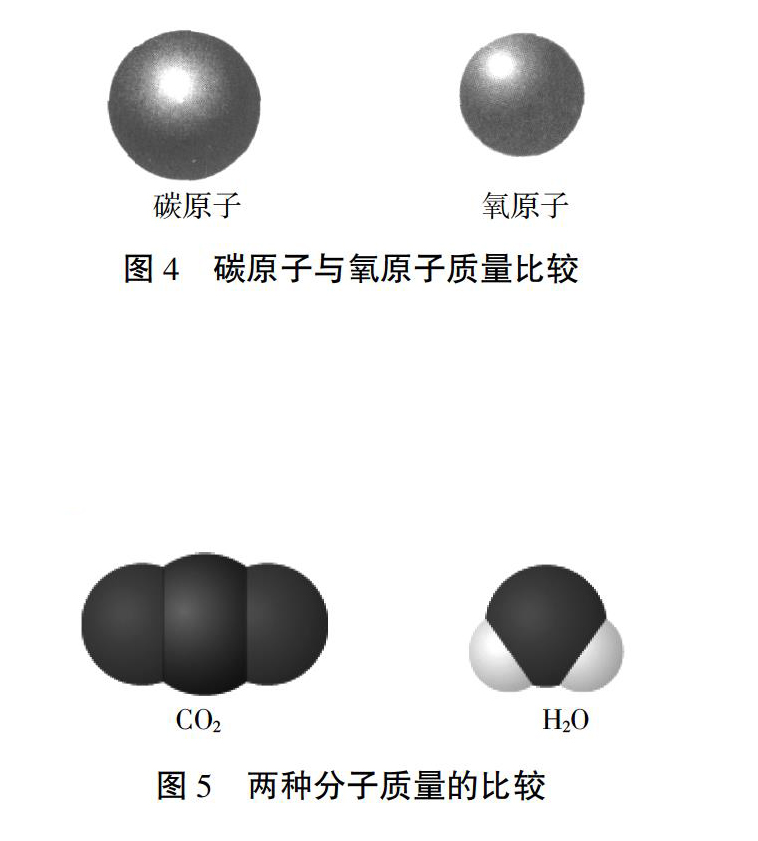
谁的质量大,如何来说明?
指出:相对原子质量是原子质量计量上的伟大发明。
引入:
谁的质量大?大多少?
思考与汇报:44>18,说明二氧化碳分子质量大;比例为44∶18。
追问:44和18是怎么来的,分别表示了什么?
学生说明:12×1+16×2=44,1×2+16×1=18,即分别表示二氧化碳和水的相对分子质量。
追问:相同质量的水和二氧化碳中,谁所含的分子个数多?
学生说明:(1÷44)<(1÷18)或44a = 18b,可以说明水分子个数多。
形成:相对分子质量。
精要练习(略)
环节二:元素质量比与元素质量分数
对话:H2O中,1×2∶16×1=1∶8,表示的是什么?
得出:1∶8表示了水分子中氢原子与氧原子的质量比。
思考与讨论:宏观上水是由氢元素和氧元素组成的,水中氢元素的质量与氧元素质量的比值即为氢、氧元素质量比,那么如何求算这个质量比呢?
汇报与提炼:1.宏观上氢元素、氧元素的质量就是微观上所有氢原子、氧原子的质量,所以氢元素与氧元素的质量比在数值上等于所有水分子中氢氧原子质量比,又因为每一个水分子都相同,所以这个质量比又等于一个水分子中的氢氧原子质量比,即1×2∶16×1=1∶8;2.宏观上水的質量就是微观上所有水分子的质量和,因为每个水分子都相同,所以宏观上的水与微观上的水分子是对应的,于是水中氢、氧元素质量比在数值上等于一个水分子中的氢、氧原子质量比。
指出:宏观上物质组成元素的质量比可以通过微观上一个分子来计量,即以点代面。
追问:如何求算水中氢元素质量分数(即氢元素的质量与各元素的总质量之比)?
汇报:与求算元素质量比一样,可以通过水分子中氢原子质量分数来求算,即1×2/18×100%。
环节三:提炼计算公式与巩固(略)
环节一中,先通过比较碳原子、氧原子的质量来温习原子质量的计量即相对原子质量的概念,接下来在比较二氧化碳与水分子质量的情景中引出对分子质量的计量,并在对“44、18”的列式与表述中让学生体会分子的质量为各原子质量和,反之各原子相对质量和就是相对分子质量,即计量中的整体局部思想,从而形成相对分子质量的概念。环节二中进一步应用了整体局部思想,体现在“为什么水中氢氧元素质量比在数值上等于一个分子中氢氧原子质量比和如何求算水中氢元素质量分数”的思考与追问之中,让学生感受到图6所呈现的完整的整体局部思想[2],即物质质量与元素质量,元素质量与原子质量,物质质量与分子质量,分子质量与原子质量等。
3. 用符号表征思想领会根据化学方程式计算的本质
根据化学方程式的计算是从量的方面研究物质的变化,而量的关键并不是具体计算问题中的数字,也不是计算过程中所列的比例式,而是深刻领会化学方程式这个符号表征所蕴含的计量。
教学片断(人教版)
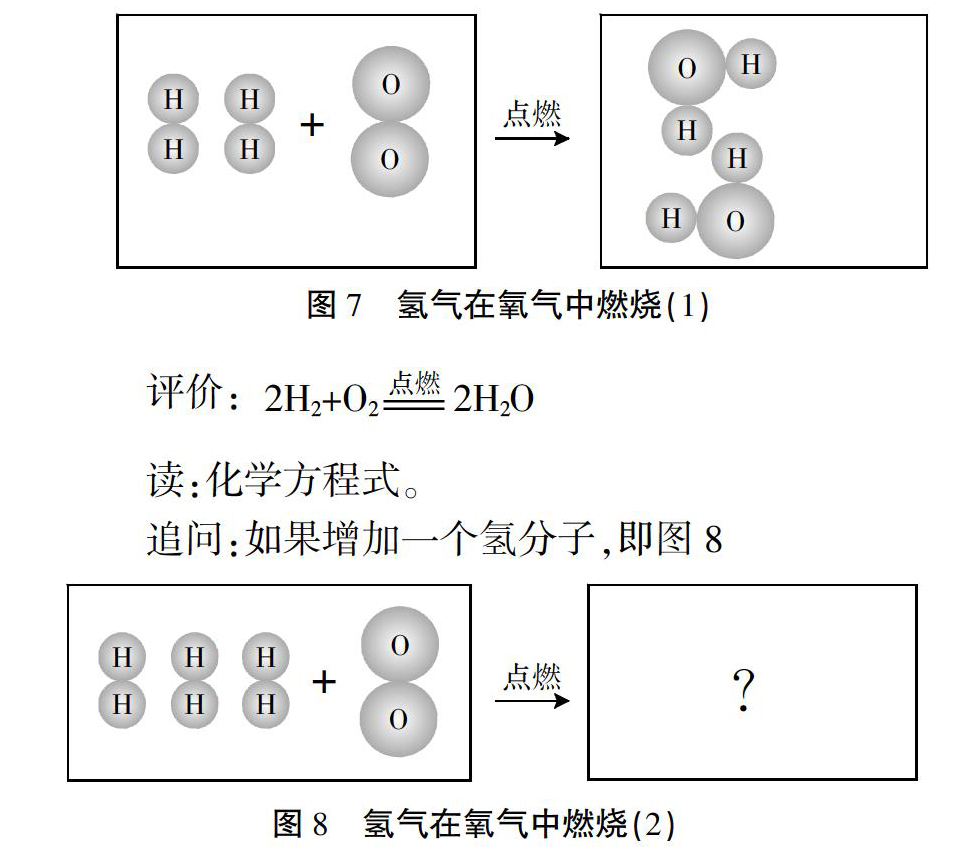
环节一:体会化学方程式中的计量数
回顾:根据微观图示,写出对应的化学方程式。
评价:
读:化学方程式。
追问:如果增加一个氢分子,即图8
对应的是几个水分子?
阐述:还是两个水分子。
体会:化学计量数是成比例的,比例是固定的。
环节二:领会根据化学方程式计算的“根据”
辨析:根据化学方程式判断“8g氢气与4g氧气燃烧后生成12g水”的说法是否正确?
思考与交流
汇报:1.根据化学方程式的计量数关系:v(H2)∶v(O2)∶
v(H2O)=2∶1∶2,得出:m(H2)∶m(O2)∶m(H2O)=2×2∶1×32∶2×18,因为8∶4∶12≠4∶32∶36,所以不可能生成12g水;
2.根据化学方程式,在质量上m(H2)∶m(O2)=2×2∶1×32即1∶8,所以8g氢气与4g氧气中,8g氢气有剩余,不可能生成12g水。
体会:化学方程式中的各物质质量比是固定的,这是根据化学方程式计算的根本依据。
追问:如何计算生成的水的质量呢?
展示:计算思路与格式。
环节三:巩固(略)
化学方程式作为化学学科中独特语言,它将宏观反应事实准确、简洁地用数字和符号来表示,变繁为简地将宏观与微观联系起来,是化学反应定性与定量思维的核心工具。学生能否理解“可观察的宏观世界,分子、原子和离子构成的微观世界,化学式、化学方程式和元素符号构成的符号世界”这三者之间的联系,是影响学生化学学习的重要因素,而这也是符号表征思想的基本内涵[3]。以上教学就是紧扣符号表征思想,先由微观示意图入手引出化学方程式,然后通过增加一个氢分子后生成几个水分子的追问,让学生体会化学方程式中计量数的微观计量内涵,为后续“定量”打下基础。在教学环节二中通过对定量化的具体反应实例的辨析和体会,让学生深刻领悟微观计量与宏观计量的联系,并体会宏观上反应中的各物质质量比的确定性,从而确立根据化学方程式计算的本质。
综上所述,关注计量思想的化学用语计算教学,是为了将计算教学由单一技能向智慧层面提升,是试着从计量的角度抵达学科核心素养的实践探索。当然,由计算到计量的教学转向,并不排斥计算技能,而是给计算技能一个温暖的学科本质的底色,是朝向学科核心素养的回归。
参考文献
[1] 曹英.“物质的量”概念的形成历史与科学本质观 [D].上海:华东师范大学,2012
[2] 罗月旺,李珍.初中化学定量观的内涵及其教学价值[J].化学教与学,2016(8):20-23
[3] 朱纷,肖红梅.基于培养学科观念的“依据化学方程式的计算”教学[J].化学教育,2015(11):4-7
- 基于自建语料库的阅读教学模式构建
- 基于文本解读的高中英语阅读教学设计
- 高校英语教师跨文化交际能力的培养策略
- 基于语篇教学的高中英语听力教学策略探究
- 大学英语课程与网络教学的实践思考
- 论高中英语写作素养的培养
- 文化传承在本科院校翻译专业教学中的应用与融合研究
- 试论初中生英语探究学习能力的培养
- “翻译工作坊”模式在商务英语翻译教学中的应用
- 提升初中英语作业设计有效性的几点思考
- 探究大数据时代大学英语写作教学的改革创新
- 核心素养视域下英语文学作品阅读课程开发与实践分析
- B-SLIM理念下基于任务型教学法的《艺术设计英语》线上课程教学设计
- 浅谈自然拼读在小学英语教学中的渗透
- 在英语教学中培养学生的文化自信
- 视听素材在高中英语课堂教学中的应用
- 高职英语分步教学新模式构建
- 基于职业技能大赛口语赛项的高职高专英语教学改革研究
- 浅论如何培养学生课外阅读的兴趣
- 以学生为中心的高职英语线上教学设计及效果研究
- 思维导图辅助高中英语语篇教学理论分析
- 中职学业水平考试背景下英语词汇教学策略研究
- 初中英语作业有效设计与评价
- 微课应用促进技校英语教学的有效性探索
- 思维导图在初中英语教学中的应用
- respaces
- re-spacing
- respacing
- respeak
- re-specification
- respecification
- respecifications
- re-specifications'
- respecified
- respecifies
- respecify
- respecifying
- respect
- respectabilities
- respectability
- respectable
- respectableness
- respectablenesses
- respectables
- respectably
- respected
- respecters
- respectful
- respectfully
- respectfulness
- 抢先不按次序
- 抢先发言
- 抢先据有
- 抢先着手进行
- 抢先讨好
- 抢先说话
- 抢先说话,插嘴
- 抢光
- 抢光杀尽
- 抢劫
- 抢劫、叛乱、破坏社会治安的人
- 抢劫一空
- 抢劫人和财物
- 抢劫偷盗
- 抢劫夺取
- 抢劫掠夺
- 抢劫掠夺、违法作乱的人
- 抢劫掳掠
- 抢劫杀戮
- 抢劫案
- 抢劫财物
- 抢劫贩卖人口
- 抢卖族
- 抢占
- 抢占别人的功劳