陈可可 李瑞 李彤彤 程立琴 顾天赐 叶金云 明建华


摘要 ? ?在青鱼幼鱼饲料中添加不同剂量的还原型谷胱甘肽(GSH),研究其对青鱼生长、非特异性免疫与抗氧化能力以及肠道消化酶活性的影响。结果表明,与CK相比,在饲料中添加GSH,能显著提高青鱼增重率、特定生长率和成活率,以及血清中总蛋白、溶菌酶、碱性磷酸酶、超氧化物歧化酶活性水平,增加补体C3、补体C4的含量;在饲料中添加GSH对青鱼肝脏中超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性和GSH含量,以及肠道中胰蛋白酶、淀粉酶等活性水平有促进作用;在饲料中添加GSH对青鱼幼鱼肝体指数、脏体指数、肥满度以及肠道脂肪酶活性无显著影响;在饲料中添加GSH可显著降低饲料系数和肝脏中丙二醛含量。由此可见,在饲料中添加适宜的GSH能促进青鱼幼鱼的生长,提高鱼体非特异性免疫力和抗氧化能力,增强青鱼幼鱼肠道消化酶活性。经过增重率的回归分析,青鱼幼鱼饲料中GSH最适含量为431.5 mg/kg。
关键词 ? ?青鱼;谷胱甘肽;生长特性;非特异性免疫;抗氧化能力;酶活性
中图分类号 ? ?S965.11 ? ? ? ?文献标识码 ? ?A
文章编号 ? 1007-5739(2020)20-0182-04 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?开放科学(资源服务)标识码(OSID)
谷胱甘肽(glutathione,GSH),通常是指还原型谷胱甘肽,其是由谷氨酸、半胱氨酸和甘氨酸经肽键缩合而成的三肽物质[1]。谷胱甘肽能参与机体自由基清除、解毒、物质吸收、细胞生长、细胞免疫及DNA生物合成等,对鱼类的促生长、增强抗氧化应激能力以及解毒能力有着重要作用[2]。另外,GSH作为解毒酶—谷胱甘肽S-转移酶(GST)的作用底物,参与机体的解毒作用,能够与毒素结合形成一种新的可溶性物质,使毒素的毒性大幅降低[3]。
青鱼(Mylopharyngodon piceus Richardson),又名青鲩、黑鲩、螺蛳青等,是我国传统养殖的四大家鱼之一。据《2017中国渔业统计年鉴》报道,我国2017年青鱼养殖产量为6.2×108万t,作为一种优质淡水鱼,青鱼养殖产量还有逐年上升的趋势[4]。本文采用含有不同剂量的还原型谷胱甘肽饲料饲喂青鱼幼鱼,探讨还原型谷胱甘肽对青鱼生长的影响,以期为青鱼的配合饲料开发和绿色健康养殖提供参考。
1 ? ?材料与方法
1.1 ? ?试验材料
青鱼幼鱼,购自湖州吴兴丰溢现代水产养殖场。谷胱甘肽(GSH),购自美国AMRESCO公司,纯度≥98%。
1.2 ? ?基础饲料配制
试验以进口鱼粉、豆粕、菜籽粕为主要蛋白源,面粉为主要糖源,豆油为主要脂肪源,配成基础饲料,详细日粮配方如表1所示。营养成分为89.91%干物质、34.96%粗蛋白、5.78%粗脂肪、8.75%粗灰分,总能达17.34 MJ/kg。饲料原料经过粉碎后过60目筛,采用逐级扩大的方法添加微量成分,将谷胱甘肽溶于水,混入各组分中,充分混匀后,使用小型饲料造粒机将饲料制成粒径为2 mm的沉性颗粒饲料,40 ℃烘干后冷却装于密封袋中,于4 ℃冰柜中保存待用。
1.3 ? ?试验方法
试验共设6个处理,分别为在基础饲料添加0、100、200、400、600和800 mg/kg的GSH,分别标记为 G0、G100、G200、G400、G600和G800,以在饲料中添加0 mg/kg的GSH为对照(CK)。饲料中GSH含量的实测值为 15.16、110.34、213.32、406.51、603.45、796.72 mg/kg。青魚幼鱼正式试验前先暂养7 d,选630尾体质健壮、规格和体质量基本一致的青鱼幼鱼,初体质量为(12.55±0.42)g,随机将青鱼分成6组,每组设3个重复,分别饲养于浙江省湖州师范学院生命科学学院浙江省重点实验室室内循环水养殖系统的18个养殖桶内,每桶放养35尾鱼。
1.4 ? ?饲养管理
试验采用饱食投喂,每天投喂2次(8:00、16:00),并根据摄食和生长情况适当调整,以每次投饲后无残饵为宜。水源为经过曝气的自来水,养殖桶每天换水1次,每次换水1/3,每天吸污1次,日夜连续充气增氧。饲养试验中,前期驯化7 d,后期正式养殖60 d。饲养期间水温24~28 ℃、pH值6.9~7.8、氨氮<0.05 mg/L、溶氧>5 mg/L以及硫化氢<0.01mg/L。
1.5 ? ?样品采集
青鱼幼鱼正式饲养60 d后进行采样,采样前禁食24 h。每桶鱼计数,每桶随机选3尾体质量相近的青鱼幼鱼,快速深度麻醉使用浓度为100 mg/L的MS-222,经称重和测量体长后,使用一次性医用注射器从幼鱼尾静脉采血。血样在4 ℃冰箱中静置1~2 h后,以4 ℃ 3 000 r/min离心10 min制备血清,在-80 ℃条件下冻存备用。鱼体采血后立即剖开腹腔,剥离内脏和肝胰脏并称重,取适量肝脏和肠道用于检测分析,并在-80 ℃条件下保存。
1.6 ? ?指标测定
1.6.1 ? ?生长与形体指标。增重率(WGR)、特定生长率(SGR)、饵料系数(FCR)、成活率(SR)、肝体指数(HSI)、脏体指数比(VSI)、肥满度(CF)分别按以下公式计算:
增重率(%)=(Wt-W0)/W0×100;
特定生长率(%)=(lnWt-lnW0)/t×100;
饲料系数=FI/(Wt-W0);
成活率(%)=Nt/N0×100;
肝体指数(%)=Wh/Wb×100;
内脏比(%)=Wv/Wb×100;
肥满度(%)=Wb/L3×100。
式中,Wt为鱼末体质量,g;W0为鱼初体质量,g;t 为饲喂天数,d;FI为每尾鱼平均摄食饲料总量(风干样重),g;N0为初鱼尾数;Nt为末鱼尾数;Wh为每尾鱼末肝脏重,g;Wv为每尾鱼末内脏重,g;Wb为每尾鱼末体质量,g;L为每尾鱼末体长,cm。
1.6.2 ? ?血清生化指标的测定。血清中溶菌酶(LSZ)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)、补体C3、补体C4、皮质醇(COR)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)和葡萄糖(GLU)等的水平按照南京建成生物工程研究所试剂盒说明书进行测定。
1.6.3 ? ?肝脏抗氧化相关指标的测定。肝脏中总蛋白、超氧化物歧化酶、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、GSH和丙二醛(MDA)等的水平按照南京建成生物工程研究所试剂盒说明书进行测定。
1.6.4 ? ?肠道生化指标的测定。肠道中总蛋白、胰蛋白酶(Trypsin)、淀粉酶(Amylase)和脂肪酶(Lipase)的水平等按照南京建成生物工程研究所试剂盒说明书进行测定。
1.7 ? ?数据统计
采用SPSS 16.0统计软件进行数据处理的单因素方差分析和Tukey多重比较。试验结果以平均值±标准差(Means±SD)表示。
2 ? ?结果与分析
2.1 ? ?饲料中添加GSH对青鱼生长性能的影响
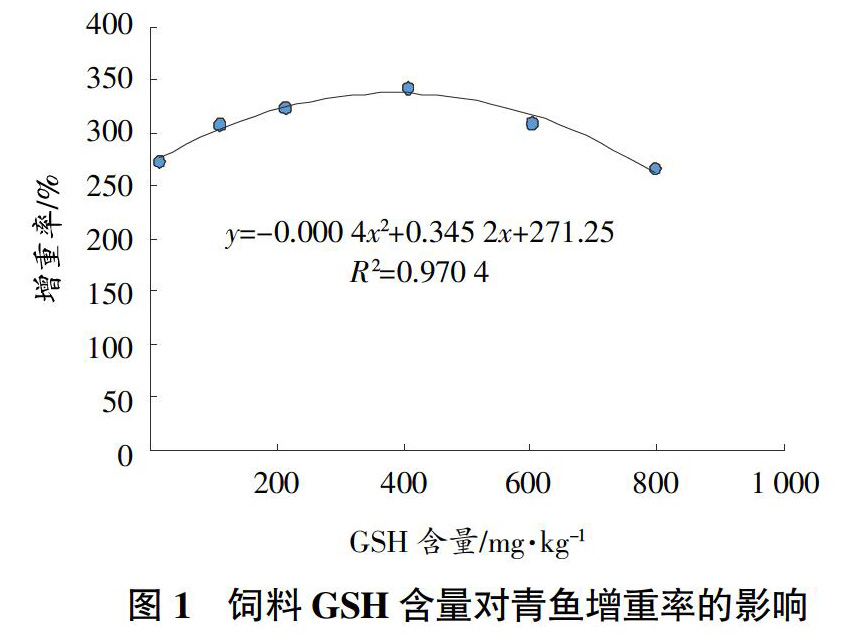
从表2可以看出,当饲料中GSH添加量实测值为406.51 mg/kg时,与CK相比,青鱼幼鱼的增重率、特定生长率和成活率均显著提高(P<0.05);其他处理饲料系数较CK显著下降(P<0.05)。各处理的青鱼肝体指数、脏体指数和肥满度与CK差异不显著(P>0.05)。通过回归分析,得到青鱼增重率与饲料中GSH含量的关系为y=-0.000 4x2+0.345 2x+271.25,R2=0.970 4(y表示增重率,x表示饲料GSH含量),其拟合曲线图1所示。当饲料中GSH含量实测值为431.5 mg/kg时,青鱼将获得最大的增重率。
2.2 ? ?饲料中添加GSH对青鱼血清非特异性免疫指标的影响
从表3可以看出,饲料中添加GSH对青鱼血清非特异性指标均产生影响。当饲料中GSH含量实测值为406.51 mg/kg时,青鱼幼鱼血清中碱性磷酸酶、总蛋白、超氧化物歧化酶、溶菌酶、补体C3、补体C4的含量等均较CK显著提高(P<0.05);当饲料中GSH含量实测值为796.72 mg/kg时,总蛋白、碱性磷酸酶、补体C3、补体C4与CK差异不显著(P>0.05)。
2.3 ? ?饲料中添加GSH对青鱼肝脏抗氧化指标的影响
从表4可以看出,当饲料中GSH含量实测值为406.51 mg/kg时,青鱼肝脏中超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶和GSH含量均较CK显著升高(P<0.05),丙二醛含量较CK显著降低(P<0.05);当饲料中GSH含量实测值为796.72 mg/kg时,各处理中的上述指标变化差异不显著。
2.4 ? ?饲料中添加GSH对青鱼肠道消化酶活性的影响
从表5可以看出,当饲料中GSH含量实测值为406.51 mg/kg时,青鱼肠道中胰蛋白酶活性、淀粉酶活性均显著高于CK(P<0.05);當饲料中GSH含量实测值为796.72 mg/kg时,青鱼的上述指标变化与CK差异不显著。各处理青鱼幼鱼肠道脂肪酶活性与CK差异均不显著(P>0.05)。
3 ? ?结论与讨论
3.1 ? ?饲料中添加GSH对青鱼生长的影响
本试验结果表明,饲料中添加一定量的还原型谷胱甘肽能显著提高青鱼的特定生长率、增重率和成活率,显著降低饲料系数,从而改善青鱼的生长性能。以增重率为指标,青鱼饲料中GSH最适添加量实测值为431.5 mg/kg。本结果与部分学者对牙鲆、花鲈、黄颡鱼、凡纳滨对虾的研究结果相似[3,5-7]。当青鱼饲料中GSH添加量实测值为406.51 mg/kg时,青鱼的生长状况最好。现有研究表明,还原型谷胱甘肽能够增强肝脏中IGF-1的分泌和肌肉组织的IGF-1 mRNA表达,提高了血中IGF-1水平,从而改善了鸡只的生长性能[8],而关于水产动物的研究非常有限。本试验结果认为,青鱼饲料中GSH的水平应该控制在一定范围内,含量过低则效果不显著;而过高的GSH水平,则会产生一定的抑制性,这也在刘晓华等[7]关于凡纳滨对虾的研究中得到了证实。
3.2 ? ?饲料中添加GSH对青鱼血清非特异性免疫指标的影响
现有报道表示,GSH可用于提高机体免疫性能[9]。鱼类血液指标可反映其生活环境、营养和健康状态[10]。溶菌酶是一种宿主防御外源微生物的重要物质[11],在鱼体中有重要作用。磷酸酶、超氧化物歧化酶和补体系统主要起着免疫防御的作用[12-14],超氧化物歧化酶水平升高,鱼体的免疫力也相应提高;磷酸酶活性可作为检测肝脏和骨骼代谢状况的指标[15],因而磷酸酶的水平可间接反映其生长状况。
在饲料中添加适量的GSH对青鱼生长有一定的促进作用,提高了青鱼的非特异性免疫能力,这与周艳玲等[6]在黄颡鱼上的研究结果一致。研究表明,草鱼鱼体对蛋白质的吸收分解程度能利用总蛋白水平表示,提高血清总蛋白水平,有利于提高有机体免疫能力[16]。本试验中,在飼料中添加实测值为406.51 mg/kg GSH处理的青鱼总蛋白水平与添加15.16 mg/kg GSH处理有显著差异,而饲料中添加实测值为796.72 mg/kg GSH处理的青鱼总蛋白水平与添加15.16 mg/kg GSH处理差异不大,这表明过量的GSH添加量对鱼体吸收分解蛋白质有抑制作用。李晓美等[17]研究结果表示,在日粮中添加一定的GSH,能够提高大菱鲆非特异性免疫。本试验结果与李晓美等[17]的研究结果相似。
3.3 ? ?饲料中添加GSH对青鱼肠道消化酶活性的影响
消化酶能够催化有机体内各种化学变化,为生物体提供能量和营养[18]。淀粉在动物肠道内的消化率比人们预期的低[19],因而淀粉酶水平的升高,可以增加对淀粉的吸收,从而转化成能量,满足动物体生长需求。在肉鸡中,脂肪酶可以促进脂肪释放出脂肪酸,抑制有害微生物的生长,促进有益菌的生长[20],而在水产动物上的研究较少。本试验中,在饲料中添加实测值为406.51 mg/kg GSH处理的青鱼淀粉酶水平显著高于添加 15.16 mg/kg GSH处理,说明一定的GSH能够促进淀粉、脂肪和蛋白质的消化利用;而在饲料中添加实测值为796.72 mg/kg GSH处理的青鱼与添加15.16 mg/kg处理差异不显著,可知GSH的含量并不是越多越好。
3.4 ? ?饲料中添加GSH对青鱼抗氧化能力的影响
动物体内存在着许多与谷胱甘肽相关的抗氧化物酶,如谷胱甘肽还原酶、超氧化物歧化酶、过氧化氢酶等,这些酶可以清除机体内多余的自由基,同时这些酶有助于缓解饥饿产生的氧化反应、多不饱和脂肪酸氧化等[5]。本试验中随着饲料GSH水平升高,饲料中添加实测值为406.51 mg/kg GSH处理的青鱼肝脏中超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性与添加15.16 mg/kg GSH处理有显著差异,说明一定程度下GSH能够促进鱼体的抗氧化能力。本试验发现,饲料中添加GSH可显著降低青鱼肝脏丙二醛含量,鉴于以上结果,可以推断缺乏GSH,青鱼肝脏抗氧化能力降低,肝脏中丙二醛含量升高,脂质过氧化,降低抗氧化相关酶活性或基因的表达;若GSH过高,则带来促氧化作用,破坏青鱼体内的氧化-抗氧化动态平衡,自由基增多,产生氧化损伤,抑制了抗氧化酶的表达。GSH添加量实测值在431.5 mg/kg左右时青鱼幼鱼的抗氧化能力较强,具体范围还需进一步研究。
4 ? ?参考文献
[1] 贾贞,王丹,游松.谷胱甘肽的研究进展[J].沈阳药科大学学报,2009,26(3):238-242.
[2] 周艳玲,孙育,黄燕华,等.水产动物谷胱甘肽营养生理作用的研究进展[J].饲料研究,2016(19):38-43.
[3] 王芳倩,张文兵,麦康森,等.饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响[J].中国海洋大学学报(自然科学版),2011(4):55-60.
[4] 农业部渔业渔政管理局.2017中国渔业统计年鉴[M].北京:中国农业出版社,2018.
[5] 李国明,孙育平,王国霞,等.饲料中添加谷胱甘肽对花鲈幼鱼生长性能、血清生化指标和抗氧化能力的影响[J].动物营养学报,2019(7):274-284.
[6] 周艳玲,孙育平,曹俊明,等.饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响[J].动物营养学报,2017(11):360-368.
[7] 刘晓华,曹俊明,吴建开,等.饲料中添加谷胱甘肽对凡纳滨对虾生长及组织生化组成的影响[J].水生生物学报,2008(3):148-152.
[8] 刘丽,韦建福,傅伟龙,等.还原型谷胱甘肽对肉鸡生长及血清IGF-1水平、组织IGF-1 mRNA表达的影响[J].中国兽医学报,2008(8):114-118.
[9] 卓肇文.还原型谷胱甘肽(GSH)的功能与应用[J].氨基酸杂志,1989(1):44-45.
[10] 周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001(2):68-70.
[11] 彭喜春,欧亦群,孙晞.食品中非致病菌向致病菌转化机制研究进展[J].中国公共卫生,2008(6):743-744.
[12] 杨贵强,张颖,王念民,等.三种鲟鱼血清及组织中磷酸酶和补体活性的比较[J].水产学杂志,2008(1):57-62.
[13] 徐桂花,于颖.羊血中超氧化物歧化酶(SOD)活性的测定[J].肉类工业,2009(1):35-37.
[14] 周显青,牛翠娟,孙儒泳.饵料维生素E含量对酸应激中华鳖幼鳖血清补体C3和C4的影响[J].动物学研究,2003(6):52-56.
[15] 喻丽娟,文华,周书华,等.维生素A对吉富罗非鱼生长、血清生化指标和肌肉品质的影响[J].西北农林科技大学学报(自然科学版),2019(2):22-30.
[16] 赵红霞,曹俊明,朱选,等.日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响[J].动物营养学报,2008(5):55-61.
[17] 李晓美,赵曼茜,吴立新,等.还原型谷胱甘肽对大菱鲆生长及血清生化指标的影响[J].饲料工业,2019 (16):47-51.
[18] 李开放,徐奇友.白藜芦醇对松浦镜鲤生长性能、肠道消化酶活性、肝脏抗氧化指标和血清生化指标的影响[J].动物营养学报,2019(4):370-378.
[19] 郭玉光,杨博,王敏,等.淀粉酶组合对肉鸡生产性能、肠道形态和屠宰性能的影响[J].畜牧与兽医,2019 (4):23-28.
[20] 胡虹,范国歌,张秀江,等.脂肪酶对肉鸡生产性能和肠道菌群的影响研究[J].河南科学,2013(9):54-56.
- 企业内部沟通机制分析
- 大数据时代电商企业网络口碑危机预警研究
- 绿色消费影响因素及刺激绿色消费对策研究
- 新生代卷烟消费体验评价指标体系构建研究
- 互联网企业并购研究
- 我国医药电商企业战略分析
- 传统手工艺次代五维化研究
- 电子商务对传统商业模式的影响分析
- 东营涉海工业企业发展困境研究
- 有限公司增资时股东对放弃份额优先认购问题探讨
- 建设银行信贷资产证券化对其经营绩效的影响
- 新审计报告中的关键审计事项探究
- 董事会特征与审计质量的关系研究
- 营运中的农村基础设施资产绩效管理研究
- 商业银行P2P资金存管业务的风险控制分析
- 会计电算化对医院财务内控的影响研究
- 基于财务共享服务模式的大数据审计探究
- 新个税下个人所得税纳税筹划探讨
- 财务共享服务中心对企业的影响分析
- 利益相关者会计信息需求的比较与分析
- 证券投资风险的类型及规避措施研究
- 会计信息化对企业财务管理的影响分析
- 金融监管模式的博弈与选择
- 金融工具分类计量变化分析
- 行政事业单位国有资产管理探讨
- deadlily
- deadline
- deadlined
- deadlines
- deadliness
- deadlinesses
- deadlining
- deadload
- dead load
- deadlock
- deadlocked
- deadlocking
- deadlocks
- dead-locks'
- deadlock/stalemate
- dead loss
- deadly
- deadly²
- deadly¹
- deadness'
- deadness
- deadnesses'
- deadnesses
- deadness's
- dead on
- 滑过
- 滑过去了
- 滑铁卢战役
- 滑雪
- 滑雪之乡
- 滑雪之父
- 滑雪服
- 滑雪衫
- 滑鱼
- 滑麻
- 滑鼠
- 滑(猾)着
- 滑(猾)蛋
- 滑(猾)蛋一个
- 滓
- 滓尘
- 滓敝
- 滓杂
- 滓污
- 滓浊
- 滓秽
- 滓秽太清
- 滓窳
- 滓累
- 滔