赵毅 石文昊 潘昊磊 张克亮

摘 要:为探讨凤丹种子是否存在抑制萌发的物质,以新成熟的凤丹种子作为试验材料,分别提取种皮和胚乳浸提液,研究不同浓度浸提液对白菜种子萌发、幼苗生长以及几种主要抗氧化酶活性的影响。结果表明,凤丹胚乳浸提液能显著抑制白菜种子的萌发与幼苗生长,抑制作用随着浸提液浓度的增加而增强,而种皮浸提液的抑制作用不显著,主要起到延缓幼苗生长的作用;凤丹胚乳浸提液显著抑制了白菜幼苗的POD和CAT酶活性,间接影响SOD酶活性。可见,凤丹种子中确实存在抑制种子萌发的内源抑制物,这些物质很可能是造成种子休眠的重要原因。
关键词:白菜;浸提液;抗氧化酶;抑制作用;种子休眠
中图分类号 S63 文献标识码 A 文章编号 1007-7731(2021)01-0025-04
Effects of Crude Extracts of Paeonia ostii Seeds on Germination and Activities of Antioxidant Enzyme of Brassica pekinensis
ZHAO Yi et al.
(College of Horticulture and Plant Protection,Jiangsu Key Laboratory of Crop Genetics and Physiology,Yangzhou University,Yangzhou 225009,China)
Abstract: To determine whether seeds of Paeonia ostii contain substance that inhibit seed germination, we studied the effect of different concentrations of P. ostii seed coat and endosperm crude extract on seed germination, seedling growth and several antioxidant enzyme activities of Brassica pekinensis. The results indicates that endosperm of P. ostii seeds could significantly inhibit seed germination and seedling growth of B. pekinensis, and the inhibitory effect increases with the increase of the extract concentration, while the seed coat extract has no significant inhibitory effect, and mainly delays the growth of seedlings. The endosperm extract of P. ostii seeds significantly inhibited the POD and CAT enzyme activities of B. pekinensis seedlings, and indirectly affect the SOD enzyme activity. Therefore, P. ostii seeds do have endogenous inhibitors that inhibit seed germination, and these substances are likely to be important reasons for seed dormancy.
Key words: Brassica pekinensis; Water crude; Antioxidant enzyme; Inhibiting effect; Seed dormancy
鳳丹(Paeonia ostii)是芍药科芍药属的一种多年生药用牡丹,主要分布在江南区域,具有重要的药用价值和经济价值[1]。凤丹根表皮中含丰富的丹皮酚,具有抗炎、解热和调节免疫系统的功效[2];大规模种植后发现,凤丹种子还具有重要的油用价值,凤丹籽油不饱和脂肪酸和α-亚麻酸含量高达92.26%、42%[3]。
凤丹主要以种子繁殖为主,但由于其种子具有较长的休眠期,育苗周期长,普遍存在发芽率低、出苗参差不齐的现象,严重影响了凤丹的生产和开发利用[4,5]。目前,对造成凤丹种子休眠原因的研究主要集中在发育不完全的种胚和生理后熟方面,而对种子内源性物质可能诱导种子休眠的研究则较少[5,6]。为此,笔者以新成熟的凤丹种子为试验材料,以白菜种子为受体材料,从种子不同部位浸提液对白菜种子萌发、幼苗生长和抗氧化酶活性的影响来研究凤丹种子休眠的原因,以期为快速打破凤丹种子休眠,充分发挥凤丹的药用价值和经济价值提供科学依据。
1 材料与方法
1.1 供试材料 以2019年8月底采自扬州大学芍药牡丹资源苗圃新成熟的凤丹种子为实验材料,实验室阴凉通风处自然晾干,低温避光保存。以采购于扬州农贸市场的白菜(Brassica pekinensis)种子为受体材料。
1.2 试验方法 选取外形饱满有光泽的凤丹种子,将种皮和胚乳分离,于40℃条件下烘干至恒重。将种皮和胚乳用研磨机粉碎后,各称取10g放入100mL锥形瓶中,加入80mL去离子水,封口膜封口。放入20℃培养箱内浸提24h,收集浸提液,4000r离心10min,过滤得上清液,定容至100mL,即为0.1g·mL-1的粗提液。将上述粗提液用去离子水稀释成浓度依次为0.025、0.050、0.075和0.100g·mL-1的培养液,置于4℃冰箱中备用。测定项目如下:
1.2.1 种子萌发率 将白菜种子放置在铺有2层滤纸的直径为9cm的培养皿中。每个培养皿分别加入7mL不同浓度的培养液,实验设置5个重复,每个重复50粒种子,以加入同体积的去离子水为对照。培养皿置于25℃光照培养箱内进行萌发实验,以胚根突破种皮为发芽标志[7],72h后统计种子发芽率、胚根长度和下胚轴长度。
1.2.2 幼苗生理指标 用去离子水将胚乳粗提液配制成浓度依次为0、0.025、0.050、0.075和0.100g·mL-1的培养液。按1.3中的方法将白菜种子在不同浓度的培养液中培养,分别在24h、48h和72h参照参考文献[8]方法分别测定白菜幼苗的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性。
1.3 数据统计分析 采用SPSS 20.0进行数据统计与分析。采用二因素方差分析法,分析浸提物浓度和提取部位对白菜种子萌发率、根长和上胚轴长度的影响以及天数和浸提液浓度对白菜抗氧化酶活性的影响。
2 结果与分析
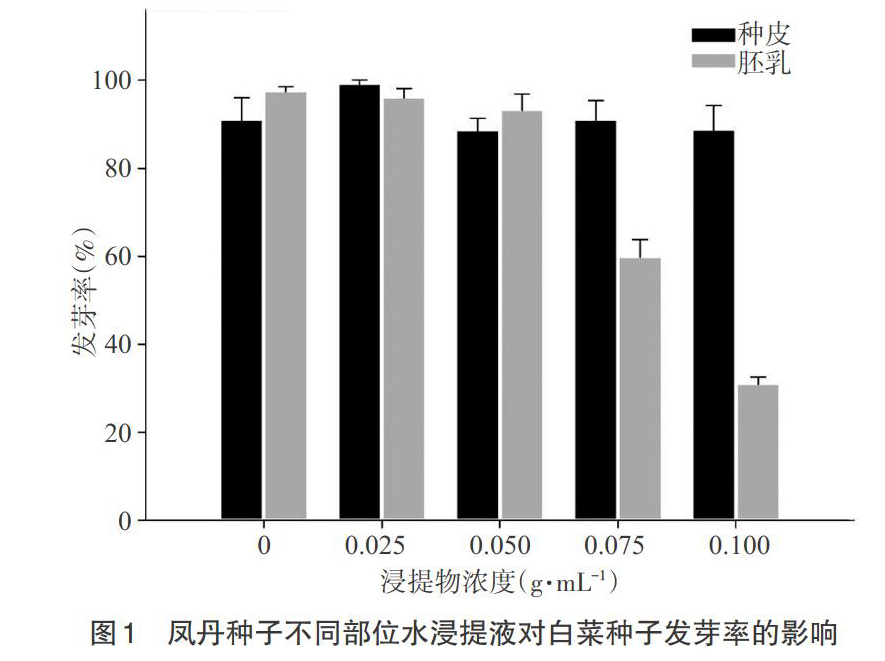
2.1 凤丹种子不同部位浸提液对白菜种子萌发的影响 由图1可知,凤丹胚乳浸提液处理能抑制白菜种子的萌发,萌发率随着浸提液浓度的增加而下降;而种皮浸提液对白菜种子无明显的抑制作用。与对照相比,0.075和0.100g·mL-1浓度的胚乳浸提液显著抑制了白菜种子的萌发(P<0.05),浓度为0.100g·mL-1时发芽率仅为32%。
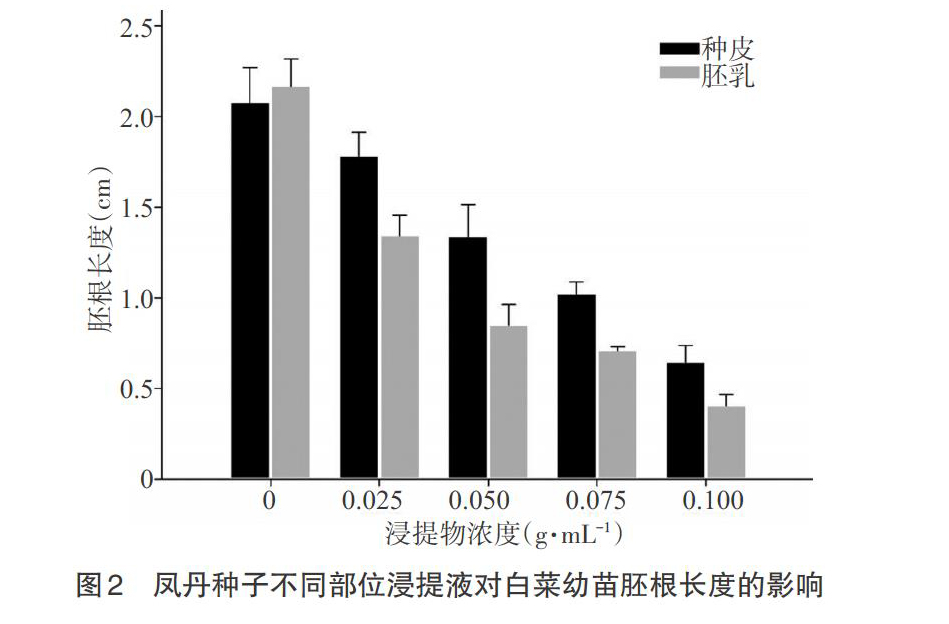
2.2 凤丹种子不同部位浸提液对白菜幼苗生长的影响 由图2可知,凤丹种皮和胚乳浸提液对白菜幼苗胚根的伸长均有显著的抑制作用,随着浓度的增加,白菜幼苗胚根长度呈下降趋势。浸提液浓度为0.100g·mL-1时,白菜幼苗胚根长度分别为0.6、0.4cm;在相同浓度下,胚乳浸提液对白菜幼苗胚根伸长的抑制作用显著高于种皮浸提液。由图3可知,凤丹胚乳浸提液对白菜幼苗上胚轴的伸长有显著的抑制作用,且随着浓度的增加抑制作用越明显;而种皮浸提液对白菜幼苗上胚轴伸长的抑制作用明显弱于胚乳浸提液。与对照相比,浓度为0.025g·mL-1时,种皮浸提液对上胚轴伸长抑制作用最明显,长度为0.38cm,但随着浓度的增加,抑制作用有所减弱;当胚乳浸提液浓度为0.100g·mL-1时,上胚轴长度仅为0.14cm。
2.3 凤丹胚乳浸提液对白菜幼苗抗氧化酶活性的影响 如图4所示,凤丹胚乳浸提液能显著提高白菜幼苗的SOD活性,活性整体呈现随浸提物浓度增加而升高的趋势;在相同浓度下,不同处理天数的白菜幼苗SOD活性存在差异。与对照相比,处理1、2d后浸提液浓度为0.100g·mL-1时,幼苗SOD活性最大,为180U/FW;而处理3d后幼苗SOD活性最大时(160U/FW)的浓度为0.075g·mL-1,之后随着浓度的增加,SOD活性显著下降。
如图5所示,凤丹胚乳浸提液对白菜幼苗POD活性具有显著的抑制作用,且随着浓度的增加抑制作用越明显;在任意相同浓度下,随着处理时间的延长,POD活性呈显著上升的趋势。与对照相比,浸提液浓度为0.100g·mL-1时,处理1、2、3d后的活性分别为50U/FW、190U/FW、260U/FW。
如图6所示,凤丹胚乳浸提液能显著抑制白菜幼苗的CAT活性,活性随着浓度的增加而显著下降;在相同浓度下,不同处理天数下白菜幼苗的CAT活性存在一定的差异。与对照相比,当浓度较低时,处理天数越短,活性越高;而当浓度为0.100g·mL-1时,处理1d后幼苗的CAT活性最低,仅为15U/FW。
3 结论与讨论
种子只有在适宜的时间和空间下萌发,才能保障幼苗的生长发育,实现种群的成功更新[9]。因此,确定影响种子休眠的原因,调控萌发时间的机制或原理,对于保障植物幼苗生长发育以及种群的繁衍具有重要的生态意义。本研究发现,凤丹种子浸提液能显著抑制白菜种子的萌发、胚根和上胚轴的伸长,当浓度为0.100g·mL-1时抑制效果最显著,且胚乳浸提液的抑制作用明顯高于种皮浸提液。在黄牡丹和四川牡丹种子浸提液对白菜种子萌发的影响研究中也发现了相似的结果[10,11]。这表明凤丹种子尤其是胚乳中确实存在抑制种子萌发的内源性物质。值得注意的是,凤丹种皮浸提液虽然对白菜种子萌发的抑制作用不明显,但却能显著抑制胚根的伸长,这说明种皮浸提液中物质的作用更多的是延缓种子萌发,对最终萌发率的影响可能较小,而胚乳中物质在抑制萌发和延缓幼苗生长上具有双重抑制作用。造成这种现象的原因是不同部位所含内源物质的种类不同,还是内源物质含量上的较大差异,有待进一步研究探讨。
当植物受到环境胁迫时,会产生大量的自由基或活性氧以及一些脂质过氧化产物,如MDA、HNE,严重阻碍种子的萌发和幼苗正常生长,而抗氧化酶是清除这些有害物质的主要组成成分[12,13]。本试验测定了凤丹胚乳浸提液对白菜幼苗SOD、CAT、POD活性的影响,结果表明,胚乳浸提液能显著抑制CAT、POD的活性,但显著提高了幼苗SOD的活性,这与邓岚和宋会兴的研究结果一致。牛欢欢等研究发现,光叶紫花苕子浸提液能显著增加紫花苜蓿与白三叶幼苗POD活性,同时增加了白三叶幼苗的CAT活性,但降低了紫花苜蓿幼苗的CAT活性[14]。我们推测这可能是由于不同物种抗氧化酶活性对不同浸提液的敏感度不一样,当浸提液浓度较低时,一些酶活性会被提高,而当浓度增加或处理时间延长时,这些酶的活性最终会下降。白菜幼苗SOD活性随着浓度的增加而显著提高,但当处理天数延长到3d时,SOD活性出现了明显的下降趋势。紫斑牡丹种子胚乳浸提液浓度在0.025g·mL-1时提高了白菜幼苗SOD活性,但随后其活性显著下降,该结果也证明了我们推测的可靠性[15]。此外,在凤丹的根际中发现了以阿魏酸、香草醛、香豆素和丹皮酚为主的酚酸类物质,这表明种子内源性物质中很可能存在酚酸类物质,这些物质抑制了抗氧化酶活性,同时阻碍了种子休眠的打破和萌发[16,17]。
本研究结果表明,凤丹种子中确实存在抑制种子萌发的内源抑制物,同时这些物质还会显著抑制胚根、上胚轴的伸长,降低POD和CAT的活性。这些内源抑制物主要存在于胚乳中,而在种皮中较少。鉴于胚乳是凤丹种子萌发所需营养物质的主要来源,这很可能是种子休眠的重要原因。
参考文献
[1]徐国均.生药学[M].北京:人民卫生出版社,1995.
[2]杨玉珍,张志浩,王国霞.凤丹愈伤组织中丹皮酚含量的测定[J].天然产物研究与开发,2018,30(03):412-417.
[3]张凯月,贺春玲,侯小改,等.油用牡丹经济价值和景观生态价值研究现状[J].中国农学通报,2019,35(10):66-71.
[4]黄青云.解除休眠处理对凤丹种子萌发和幼苗生长的影响[J].三亚热带植物科学,2008,37(4):35-37.
[5]郭丽萍,张延龙,牛立新,等.凤丹种子休眠特性研究[J].西北林学院学报,2016,31(4):165-169.
[6]韦祖粉,蒲振蕊,鲁清清,等.油用牡丹凤丹种子休眠解除及组织培养研究[J].种子,2020,39(01):54-58,63.
[7]吴啸业.红豆杉种子抑制物质的初步研究[J].植物生理学通1985(4):23-26.
[8]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社,2003:68,31,55,127.
[9]Huang Z,Liu S,Bradford K J,et al. The contribution of germination functional traits to population dynamics of a desert plant community [J]. Ecology,2016,97(1):250-261.
[10]邓岚,张翔宇,曾秀丽,等.黄牡丹种子浸提液对白菜种子萌发及幼苗抗氧化酶活性的影响[J].西南农业学报,2017,30(2):305-308.
[11]宋会兴,刘光立,高素平,等.四川牡丹种子浸提液内源抑制物质活性初探[J].园艺学报,2012,39(2):370-374.
[12]Ebone,L.A.,Caverzan,A.,Chavarria,G., Physiologic alterations in orthodox seeds due to deterioration processes[J]. Plant Physiol. Biochem.,2019,145:34–42.
[13]Waszczak,C.,Carmody,M.,Kangasj?rvi,J., Reactive oxygen species in plant signaling[J].Annu Rev. Plant Biol.,2018,69:209–236.
[14]牛欢欢,王森森,贾宏定,等.光叶紫花苕子浸提液对4种牧草种子萌发过程的化感作用[J].草业学报,2020,29(09):161-168.
[15]李婉茹,唐紅,何丽霞.紫斑牡丹种子浸提液对植物种子萌发和幼苗生长的影响[J].东北林业大学学报,2020,48(03):8-12.
[16]覃逸明,聂刘旺,黄雨清,等.凤丹自毒物质的检测及其作用机制[J].生态学报,2009,29(3):1153-1161.
[17]杨勇,刘光立,宋会兴,等.四川牡丹胚乳浸提液对油菜种子萌发与幼苗生长的影响[J].西南农业学报,2013,26(1):89-92.
(责编:张宏民)
- 构建有利于幼儿语言能力发展的家园环境
- 青少年学生沉迷网络的心理分析及对策
- 浅析高校社团文化的思想政治功能
- 高校机器人技术应用教学探究
- 浅谈如何利用沙土建构小班幼儿适宜性游戏
- 智障儿童生活自理能力干预方法的探究
- 整合课程状态下幼儿语言教育中的问题及对策探讨
- 无处不飞花
- 有话可说,有情可抒
- 浅析新媒体背景下小学道德与法治教育存在的问题和应对方案
- 浅谈通过班级文化建设促进问题学生的转化
- 浅谈如何培养和提高小学生发散思维
- “互联网+”视域下高职思政课融合创新创业教育的思考
- 初探外来工子女教育发展的后发优势
- 基于网络平台的初中德育教育探析
- 新时代下女大学生创业教育体系构建模式研究
- 中职学校学生就业路上的德育教育
- 家庭教育中心理健康教育不容忽视
- 言传身教和爱的教育
- 中学德育教育中传统文化的应用策略分析
- 有关农民工子女小学高年级青春期前期性教育实践
- 护理朗诵对护生心理健康的影响
- 中职学生德育教育方法探析
- 当代大学生对微课认知状况的实证研究
- 小学德育教学中学生责任感的培养对策
- load²
- load¹
- loaf
- loafed
- loafer™
- loafing
- loafs
- loaf's
- loam
- loamed
- loamier
- loamiest
- loaminess
- loaminesses
- loaming
- loamless
- loams
- loamy
- loan
- loan a painting/work of art etc
- loancapital
- loan capital
- loaned
- loan/facility/home loan/mortgage/overdraft
- loaning
- 钏
- 钏击钗飞
- 钏动钗飞
- 钏臂
- 钐
- 钐利
- 钐镰
- 钑
- 钑花
- 钑镂
- 钒
- 钓
- 钓上来的鱼
- 钓丝
- 钓乡
- 钓五湖
- 钓位
- 钓六鳌
- 钓具
- 钓几
- 钓利
- 钓卷
- 钓友
- 钓叟
- 钓台